溶血磷脂酰胆碱酰基转移酶3调控内皮细胞激活论文
2024-05-08 14:22:17 来源: 作者:zhoudanni
摘要:动脉粥样硬化是心血管疾病发生发展的主要 致病因素,由于脂质在血管内膜下的沉积、炎症细 胞的浸润,病因复杂,其发病机制和病理过程目前 还没有完全被阐明[1];内皮细胞可以感受来自血液 的各种机械信号和化学信号刺激,介导炎性反应, 是心血管疾病发生的主要病理机制[2]。研究发现局 部血流动力学改变在内皮细胞激活及动脉粥样硬 化形成中起着重要作用[3]。
[摘要] 目的 探究溶血磷脂酰胆碱酰基转移酶 3(Lyso-PL Acyltransferases 3. LPCAT3)在湍流(Oscillatory Flow, OSS)介导的内皮细胞激活中的作用。 方法 于 2020 年 11 月—2023 年 6 月济宁市第一人民医院分离 5 只 C57BL/6 雄 性 小 鼠 的 主 动 脉 弓(Aortic Arch, AA)及 胸 主 动 脉(Thoracic Aorta, TA),用 于 提 取 mRNA 检 测 LPCAT3 的表达。将原代内皮细胞随机分为对照组(Static)和研究组(OSS),检测 LPCAT3 的 mRNA 水平。同 时,敲减 LPCAT3.验证血管细胞黏附因子-1(Vascular Cell Adhesion Molecule 1. VCAM-1)、细胞间黏附因子 -1(Intercellular Adhesion Molecule 1. ICAM-1)的 mRNA 表达。 结果 与胸主动脉(1±0.42)相比,小鼠主动脉弓 LPCAT3 的 mRNA 相对表达水平(2.03±0.5)明显上调,差异有统计学意义(P<0.05)。与研究组 mRNA 的相对 表达水平(2.72±0.72)( 3.04±0.56)相比,OSS+siLPCAT3 组其 VCAM-1 及 ICAM-1 表达明显降低为(1.31±0.4) ( 1.81±0.51),差异有统计学意义(P 均<0.05),这意味着抑制内皮细胞 LPCAT3 能够明显减少湍流介导的炎症 因子的表达。 结论 LPCAT3 能够调控湍流介导的内皮细胞激活。
[关键词] 内皮细胞,炎症,溶血磷脂酰胆碱酰基转移酶 3
动脉粥样硬化是心血管疾病发生发展的主要 致病因素,由于脂质在血管内膜下的沉积、炎症细 胞的浸润,病因复杂,其发病机制和病理过程目前 还没有完全被阐明[1];内皮细胞可以感受来自血液 的各种机械信号和化学信号刺激,介导炎性反应, 是心血管疾病发生的主要病理机制[2]。研究发现局 部血流动力学改变在内皮细胞激活及动脉粥样硬 化形成中起着重要作用[3]。
溶血磷脂酰胆碱酰基转移酶 3(Lyso-PL Acyl ‐ transferases 3. LPCAT3)可 以 调 控 甘 油 磷 脂 sn-2 位 置的脂肪酸合成,催化多不饱和脂肪酸与磷脂的结 合,参与磷脂重塑、内质网应激、炎症反应,进而可 以调控细胞的功能[4]。前期天津医科大学的研究发 现湍流通过调控 Integrin α5-ANXA2 信号轴引起内 皮细胞激活,还可以通过抑制哺乳动物 MST1 的激酶活性介导动脉粥样硬化的形成[5-6] 。 基于 LPCAT3 调控磷脂重塑的重要作用,其是否可以参 与内皮细胞激活还没有被研究,探究 LPCAT3 在内 皮细胞激活以及动脉粥样硬化的作用具有重要意 义。因此本研究于 2020 年 11 月—2023 年 6 月在济 宁市第一人民医院对 5 只 C57BL/6 雄性小鼠及原代 人脐静脉内皮细胞进行实验研究 ,旨在探索 LPCAT3 在内皮细胞激活中作用。现报道如下。
1 材料与方法
1.1 材料
1.1.1 试 剂 M199 培养基(武汉普诺赛科技公司; PM150612)、胎牛血清(广州汉强生物科技公司 ; UB96728)、胰酶(美 国 Gibco 公 司 ;25200-056)、 RNAiMAX 转染试剂(美 国 ThermoFisher 公司 ; 13778075)、LPCAT3小分子干扰RNA(北京唯尚立德生 物科技公司;序列 CAAGUUCCUUGGAAAUAAATT)、 mRNA提取试剂盒(广 州 Omega Bio-Tek 公 司 ; R6834)。
1.1.2 仪器 CO2 细胞培养箱(美国 Thermo 公司)、 PCR 仪(美国 Bio-rad 公司)、实时荧光定量PCR仪(美国 Bio-rad公司)、4℃离心机(美 国 Bio-rad 公司)。
1.2 方法
1.2.1 动物模型的构建5只8周龄雄性背景为C57BL/6 的 Wide-Type(WT)小鼠购自济南朋悦公司。小鼠在温湿度控制的环境中适应 1 周,按 12 h 的光-暗周期饲养,给予正常饮食,自由获取食物和 水。 1 周后分离小鼠主动脉弓(Aortic Arch, AA)以及胸主动脉(Thoracic Aorta, TA)并提取组织的 mRNA。动物实验均通过本院医学实验动物伦理委 员会审查(JNMC-2021-PW-047)。
1.2.2 原代人脐静脉内皮细胞的培养与湍流模型 构建 进行原代人脐静脉内皮细胞培养(以下简称 内皮细胞)及湍流模型构建[7]。将培养的原代人脐 静脉内皮细胞,随机分为对照组(Static)(n=3)和研 究组(OSS)(n=3),研究组用阶梯式平板流体系统 给予内皮细胞湍流(0.5±4)dyn/cm2 处理 12 h,最后 将流体系统置于 5% CO2、37℃细胞培养箱中运行, 对照组静止处理 12 h,与研究组一起置于 5 % CO2、 37℃细胞培养箱。
1.2.3 SiRNA基因沉默将内皮细胞分为沉默 LPCAT3 组(siLPCAT3)(n=3)与 对 照 组(siNC)(n= 3)。将内皮细胞铺于六孔板进行培养,细胞密度在 75% 左右进行转染;LPCAT3 组每孔分别将转染试 剂 RNAimax、SiRNA-LPCAT3( 10 μM)与 Opti-MEM 充分混匀并静置 ,对照组每孔分别将转染试剂 RNAimax、阴性对照 SiRNA( 10 μM)与 Opti-MEM 充 分混匀并静置;将复合物转染到相应处理孔,孵育 6 h 换液,24 h 后收集细胞裂解液提取 mRNA 验证敲 减效率。为了进一步研究 LPCAT3 在湍流介导的内 皮细胞激活中作用,将内皮细胞分为 siNC(n=3)、 siLPCAT3(n=3)、OSS(n=3)、OSS+siLPCAT3(n=3)4 组,分别给予 SiRNA-LPCAT3 转染 12 h 及湍流(0.5± 4)dyn/cm2 处理 12 h,收集细胞裂解液。
1.2.4 mRNA的提取按mRNA提取试剂盒(广 州 Omega Bio-Tek 公司;R6834)步骤提取。
1.3 统计方法
本研究中收集的实验数据采用 GraphPad Soft ‐ ware 分析、制图,mRNA 表达水平以(±s)表示,两组 间比较采用非配对 t 检验;4 组间比较采用双因素方差分析,进一步两组组间比较采用邦弗朗尼(Bon ‐ ferroni)后续检验。 P<0.05 为差异有统计学意义。
2 结果
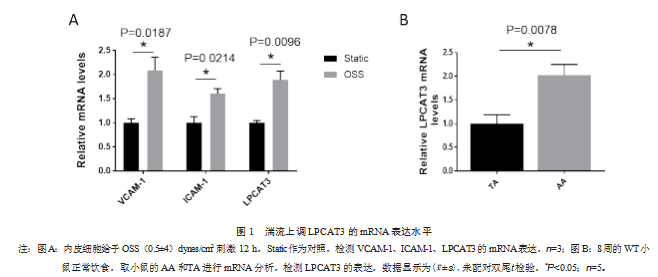
2.1 湍流上调 LPCAT3 的 mRNA表达水平
与对照组(Static)VCAM-1、ICAM-1、LPCAT3 的 相对 mRNA 表达水平(1.0±0.14)、( 1.0±0.22)、( 1.0± 0.08)相 比 ,研 究 组(OSS)(2.01±0.61)、( 1.6±0.18)、 ( 1.89±0.32)显著增加(见图 1A),差异有统计学意 义(P 均<0.05);为了进一步验证湍流对于 LPCAT3 的影响,提取 Wide Type 小鼠 AA(血流形式主要是 湍 流)以及TA组织的 mRNA,结果表明AA其 LPCAT3 的 相 对 mRNA 水 平(2.03±0.5)较 TA( 1.0± 0.42)明显上调(见图 1B),差异有统计学意义(P< 0.05)。研究组内皮细胞 LPCAT3 的 mRNA 表 达 水 平相比于对照组升高 1.88 倍,差异有统计学意义 ( P<0.05 )。
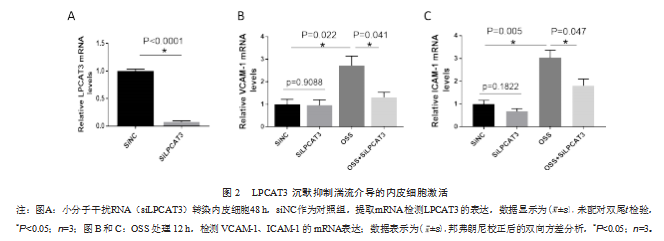
2.2 LPCAT3 沉默抑制湍流介导的内皮细胞激活
与对照组(siNC)内皮细胞(1±0.06)相比,沉默 LPCAT3 组(siLPCAT3)其 mRNA表达水平(0.07± 0.04)明显被抑制(见图 2A),差异有统计学意义(P< 0.001);siNC 组(1.0±0.38)( 1.0±0.29)与 siLPCAT3 组 内皮细胞 VCAM-1、ICAM-1 的 mRNA 相对表达水平 (0.96±0.41)(0.68±0.2)比较,,差异无统计学意义(P 均 >0.05)(见 图 2B、2C);对 比 研 究 组( OSS)(2.72± 0.72)( 3.04±0.56 ),OSS+siLPCAT3组内皮细胞 VCAM-1、ICAM-1 的 mRNA 相对表达水平( 1.31± 0.4)( 1.81±0.51)显著降低(见图 2B、2C),差异有统 计学意义(P<0.001)。
3 讨论
血管内皮细胞在动脉粥样硬化的发病过程中 发挥着首要的作用,其在血管分叉处或弯曲处被激 活 ,触发炎症反应 ,进而介导动脉粥样硬化的形成[8]。研究表明细胞外基质蛋白COMP与整合素锚定,通过湍流改变 integrin 的构象介导 NF-κB 激 活[9];在湍流的作用下,ANXA2 通过在内皮细胞中 发生构象变化直接与整合素 α5 相互作用,促进整 合素 α5 向质膜脂筏转运引起内皮细胞激活[5];最 新研究表明湍流通过抑制 MST1 的激酶活性,使其 对底物 Cx43 的磷酸化水平降低,引起 Cx43 介导的 半通道开放,进而介导内皮细胞激活和动脉粥样 硬化[6] 。目前内皮细胞激活以及动脉粥样硬化的 发病机制被广泛研究,但其病因复杂,具体发病机 制还没有完全被阐明。本研究发现湍流可以促进 LPCAT3 的 mRNA 表达 ,说 明 LPCAT3 在 湍 流 引 起 的内皮细胞激活中可能发挥重要作用。
LPCAT3 在细胞和组织中都广泛参与溶血磷脂 酰转移酶的诸多生理过程,其可以调节不同磷脂 酰胆碱种类的丰度,进而在脂代谢和生态稳定中 发 挥 重 要 作 用 [10] 。 O. Demeure 等[11]研究发现LPCAT3受肝脏X受体调控,参与肝脏和小肠脂蛋白生成,许多疾病的发展都与LPCAT3的促炎作用有关 [12] 。Jiang X 等[13] 研 究 显 示 ,与 对 照 组 相 比 ,SiNPs显著增加内皮细胞LPCAT3的mRNA表达,诱导内皮细胞发生铁死亡。吴思毅等 [14] 研究 显示秦皮素通过减轻内皮细胞铁死亡,延缓高脂 饮食小鼠动脉粥样硬化的发展 。 这些研究结果 说明了内皮细胞中 LPCAT3 高表达可能与动脉粥 样硬化形成密切相关。本研究显示,通过对比对照组 LPCAT3 的相对 mRNA 表达水平(1.0±0.08)与研究组(1.89±0.32)( P<0.05),发现湍流可以促进内皮细胞 LPCAT3 的 mRNA 表 达 。 与小鼠胸主动脉LPCAT3的相对 mRNA( 1.0±0.42)比 较 ,主动脉弓表达(2.03±0.5)明显升高(P<0.05),提示湍流在生理状态下同样会促进血管内皮 LPCAT3 的 mRNA 表达。对比研究组(OSS)VCAM-1 、ICAM-1的相对 mRNA 表达水平(2.72±0.72)( 3.04±0.56 ), OSS+siLPCAT3 组 为(1.31±0.4 )( 1.81±0.51 )( P 均 < 0.05),发现沉默 LPCAT3 能够明显抑制湍流介导的内皮细胞 VCAM-1 、ICAM-1 的 mRNA 水 平 ,这说明了湍流通过促进 LPCAT3 生成介导的内皮细胞激活。
越来越多的研究表明 LPCAT3 主要调节花生四 烯酸-PC 的水平,是游离花生四烯酸的主要调节因 子,而游离花生四烯酸是动脉粥样硬化发生的重要 因素[15-16]。湍流是否可以调节花生四烯酸-PC 的丰 度以及是否可以通过 LPCAT3 介导溶血磷脂酰胆碱 以及花生四烯酸的表达目前还没有完全被揭示,因 此还需要进一步研究湍流对于 LPCAT3 的调节是否 会影响花生四烯酸-PC 以及游离花生四烯酸的表 达进而引起内皮细胞的激活以及动脉粥样硬化的 形成。
综上所述,本研究证实湍流通过上调 LPCAT3 的表达介导内皮细胞的激活,可能为动脉粥样硬化 的治疗和预防提供了新的干预靶点。
[参考文献]
[1] 王梦艳 ,刘杰 , 黄聿 , 等 . 非血管性疾病与动脉粥样硬 化:内皮炎症和氧化应激的关键作用[J]. 中国动脉硬 化杂志,2023.31(4):287-296.
[2] 单高俊,董国,杨树森 . 剪切力与动脉粥样硬化形成研究的进展[J]. 心血管康复医学杂志 , 2021. 30(6): 707-710.
[3] 唐植辉,汪南平,钱煦 . 血流剪切力在动脉粥样硬化形 成中的作用[J].生理科学进展,2007.38(1):37-42.
[4] Li Z, Jiang H, Ding T, et al. Deficiency in lysophosphati ‐ dylcholine acyltransferase 3 reduces plasma levels of lip ‐ ids by reducing lipid absorption in mice[J]. Gastroenterol ‐ ogy,2015.149(6):1519-1529.
[5] Zhang C, Zhou T, Chen Z, et al. Coupling of Integrin α5 to Annexin A2 by Flow Drives Endothelial Activation[J]. Circ Res,2020.127(8):1074-1090.
[6] Quan M, Lv H, Liu Z, et al. MST1 Suppresses Disturbed Flow Induced Atherosclerosis[J]. Circ Res, 2022. 131(9): 748-764.
[7] Sun X, Fu Y, Gu M, et al. Activation of integrin α5 medi‐ ated by flow requires its translocation to membrane lipid rafts in vascular endothelial cells[J]. Proc Natl Acad Sci USA,2016.113(3):769-774.
[8] 瞿凯,邱菊辉,王贵学 . 血管内皮细胞屏障功能的血流动力学调控及其与动脉粥样硬化的关系[J]. 中国动脉 硬化杂志,2020.28(1):1-6.
[9] 李博川 .Hippo-YAP 通路在湍流引起血管内皮激活和 动脉粥样硬化中的作用和机制研究[D].天津:天津医 科大学,2018.
[10] 贺超 ,廖君 , 兰斌 , 等 . 脑泰方对脑梗死后铁死亡-脂 质代谢通路蛋白表达的影响[J]. 中华中医药杂志 , 2020.35(11):5491-5494.
[11] O.Demeure,晋大鹏 . 肝脏 X 受体(LXR)调控溶血磷脂 胆碱酰基转移酶 3(LPCAT3) 的研究[J]. 中国畜牧兽 医,2011(3):38.
[12] 王虎年,柴克霞,张莉.铁死亡通路中ACSL4、 LPCAT3 蛋白表达在特发性炎性肌病中的研究[J].系统医学,2023.8(11):190-193.198.
[13] Jiang X, Gao H, Cao Y, et al. SiNPs induce ferroptosis in HUVECs through p38 inhibiting NrF2 pathway[J]. Front Public Health,2023.11:1024130.
[14] 吴思毅 ,梁远盈 ,翁依佳 ,等 . 基于铁死亡调节探讨秦 皮素对动脉粥样硬化的作用及机制研究[J].广西医 科大学学报,2023.40(5):716-723.
[15] 庞炜 , 张栩 ,李丹 ,等 . 花生四烯酸代谢组学在动脉粥 样硬化发生机制研究中的应用[J/CD]. 中国医学前 沿杂志:电子版,2012.4(8):23-27.
[16] 郭歌 ,祖凌云 , 高炜 . 花生四烯酸代谢产物与动脉粥 样硬化[J].心血管病学进展,2014(5):526-530.










