探讨阴道微生态的改变对HPV 致宫颈病变的影响论文
2024-04-30 09:54:16 来源: 作者:zhoudanni
摘要: 宫颈疾病是指宫颈癌、宫颈炎、宫颈上皮内瘤变 (Cervical Intraepithelial Neoplasia, CIN)等 宫 颈 组 织 区域发生的各种病变 。有研究报道,阴道微生物可 作为肿瘤疾病早期诊断的体液标志物[1],而高危人类 乳头瘤病毒(Human Papillomavirus, HPV)持续感染 是宫颈癌的主要致病因素[2],其中 HPV-16、18 型约 占 70%[3] 。近 年来 多项研究 报道 阴道微 生 态失衡 、 HPV 感染与宫颈病变间相互影响[4-5],阴道乳酸菌减
[摘要] 子宫颈病变的阴道菌种结构复杂性、多样性明显,阴道乳杆菌种类和丰度对阴道微生态平衡起着重要 作用,惰性乳杆菌则反之;犬布鲁氏菌 、戴阿李斯特琥珀酸纤毛杆菌 、阴道加德纳菌和短普雷沃菌与人类乳 头瘤病毒(Human Papillomavirus, HPV)感染致宫颈病变密切相关 。维持阴道微生态平衡可有效地消除病毒, 防止宫颈癌的发生 。本研究就阴道微生态的改变对 HPV 致宫颈病变的影响进行探讨。
[关键词] 高通量测序,人乳头瘤病毒,阴道微生态,宫颈病变
宫颈疾病是指宫颈癌、宫颈炎、宫颈上皮内瘤变 (Cervical Intraepithelial Neoplasia, CIN)等 宫 颈 组 织 区域发生的各种病变 。有研究报道,阴道微生物可 作为肿瘤疾病早期诊断的体液标志物[1],而高危人类 乳头瘤病毒(Human Papillomavirus, HPV)持续感染 是宫颈癌的主要致病因素[2],其中 HPV-16、18 型约 占 70%[3] 。近 年来 多项研究 报道 阴道微 生 态失衡 、 HPV 感染与宫颈病变间相互影响[4-5],阴道乳酸菌减少 、阴道内炎症可导致宫颈病变[6-7];阴道微生态改 变 可 激 活 机 体 炎 症 反 应 ,增 加 高 危 HPV 感 染 风 险 等[8] 。到目前为止,仅有少数的有关于阴道微生态变 化、HPV 感染致宫颈病变的相关性研究报道 。为此, 本次通过分析阴道微生态多样性、HPV 感染与宫颈 病变的相关性,为临床诊疗宫颈病变提供新的思路。
1 正常阴道微生态可以降低 HPV 感染
女性生殖系统的第一道防线是阴道微生态,其构成为阴道微生物菌群 、宿主内分泌调节系统 、生 殖道解剖结构和免疫系统,通常保持相对的动态平 衡 。女性阴道内复杂的微生物群落与宿主共生,属 于相对厌氧的生态环境[9] 。 阴道微生物群可分为 5 种 主 要 的 群 落 类 型(Communitystate Type, CST),其 核心优势菌群为卷曲乳杆菌 、格氏乳杆菌 、惰性乳杆菌以及詹氏乳杆菌,以4种乳酸菌( CST Ⅰ 、Ⅱ 、 Ⅲ 、Ⅴ型)为主,存在于 73% 的女性,而 CST Ⅳ则主 要有非乳杆菌属和大量专性厌氧菌 ,包括奇异菌 属、加德纳菌、普氏菌等;以乳杆菌为主要优势菌的 微生物群落是免受病原菌感染和避免性传播疾病 的有效屏障[10-12]。
乳酸杆菌在阴道菌群密集度及多样性Ⅱ ~ Ⅲ 级、阴道 pH 值 3.8~4.5 时为阴道优势菌,无病原微生 物,这时的阴道微生态为正常[13-14] 。乳杆菌分泌乳 酸菌上皮黏附素 、细菌素和生物表面活性剂,形成 占位效应,阻止病原菌黏附及生长,促进上皮细胞 DNA 损伤修复及基因转录;增加宫颈黏液的黏度, 提高抗体捕获病毒颗粒的能力;由其产生的过氧化 氢(Hydrogen Peroxide, H2O2可发挥促使蛋白抑制剂的作用,以达到抑制 HPV 的生长的目的[14-17] 。多项研究表明,阴道乳酸菌还可诱导生殖道局部免疫应答,产生抗菌肽等下调促炎因子白细胞介素 (Interleukin, IL)、肿瘤坏死因子-α(Tumor Necrosis Factor-α , TNF-α)等的分泌 ;低炎症性环境能有效减少HPV-DNA的病毒载量,降低高危型HPV (High Risk HPV, HR-HPV)的感染[18-20]。
2 阴道微生态失衡导致 HPV 感染
研究表明,生殖道微生态失衡对 HPV 感染引起 宫颈病变的影响是通过影响女性生殖道免疫微环 境起作用[21-22] 。生殖道菌群失调使乳酸 、H2O2 及细 菌素等分泌减少,阴道 pH 值升高,大量病原菌繁殖 黏附,阴道菌群多样性增加或极度减少;病原菌及 其代谢产物破坏局部免疫力,降低中性粒细胞的吞 噬作用和对趋势性的刺激反应,激发炎性反应损害 宫颈上皮细胞,导致局部细胞抑菌能力及病毒清除 能力降低 。当女性生殖道免疫调节发生异常时,会 影响机体释放成纤维细胞生长因子等细胞因子,使 宫颈病变没有彻底清除的病灶再次激活 、生长,加 快宫颈癌前病变的发生;此外,阴道菌群还可以通 过降解局部雌激素 ,增加体内游离雌激素的再吸 收,提高循环雌激素的水平,增加宫颈疾病发生率。
阴道微生态持续失调降低了生殖道对 HPV 的抵御 能力 、激活高水平的氧化应激反应,生成大量的活 性 氧使 宿 主 和 病 毒 的 DNA 双链 断 裂 ,病 毒 DNA 整 合在宿主细胞 DNA 片段并进行转化复制形成大量 异常增殖细胞并出现组织学可见的病变—宫颈上 皮内瘤样病变[23-24]。
秦 勤 等[25]也研究了宫颈环形电切术术后HPV 感染与阴道菌群的关系,发现 CIN 患者持续 HPV 阳 性 与 阴 道 菌 群 失衡 、细 菌 性 阴 道 病(Bacterial Vagi ‐ nosis, BV)、外阴阴道假丝酵母菌病(Vulvovaginal Candidiasis, VVC)感染有关 。这进一步提示积极纠正阴道菌群失衡,治疗阴道炎,可有效预防 CIN 复 发 。夏玉洁等[26]对 149 例 HR-HPV 患者进行研究分 析 ,得 出 BV、VVC、需 氧性 阴 道 炎(Aerobic Vaginitis, AV)、pH>4.5、乳酸菌减少可能与HR-HPV感染有关,提示 VVC 可引起蛋白质降解,增强抗原应答、宿 主易感性,协同促进 HPV 癌变。
3 高危 HPV 感染、阴道微生态失衡与宫颈病变的相关性
HPV 阳性的患者阴道分泌物中卷曲乳酸杆菌丰度下降,其可能会造成其他菌属在子宫颈中的定 殖,导致阴道正常菌群出现失衡,从而使宫颈病变 的风险增加[27]。
研究证实,HR-HPV 持续感染与宫颈癌的发生 密切相关 。多项研究表明阴道微生态的失调与高 危 HPV 的感染致 宫 颈 癌 密切 相关[28],BV 可 能增 加 HPV 感染的风险并与高危 HPV 感染呈正相关,为高 危 HPV 发 生 的 独 立 危 险 因 素[29-32] 。HPV 阳性 的 患 者阴道分泌物中细菌多样性(特别是与细菌性阴道 病相关的细菌)增加[14],BV 的厌氧菌代谢产物中含 有胺及有致 癌作 用 的 亚 硝基胺 ,BV 分 泌 物 中也含 有大量磷脂酶 C 及 A 2.后者可提高 HPV 的易感性, 延长鳞状上皮内化生时期并促进上皮细胞发育不 良[33];BV 的 加 德 纳 菌 不但 产 生 溶 细 胞 作 用 的 蛋 白 毒素,导致机体黏膜损伤,还能形成生物被膜,为其 他微生物寄生提供栖息地,坚固的生物被膜使得细 菌 对抗 生 素 产 生 耐 药 性[34];BV 患 者 阴 道 内 乳 酸 菌 的耗竭导致厌氧微生物的过度生长,削弱了对 HPV 病毒的抑制作用,使宫颈组织的免疫平衡被破坏, HPV 蛋白的表达增强,异常菌群的黏附 、侵袭和定 植增加,进一步加剧了阴道菌群的失衡,形成恶性 循环,最终导致宫颈癌的发生[32.35]。
有研究显示,通过二代高通量测序技术对阴道 菌群进行分类,阴道微生物菌群种类的多样性及复 杂性与宫颈病变呈正相关;与治疗后 HPV 转阴呈负 相关,转阴患者菌群密集度阳性检出率、乳酸杆菌、 菌群多样性、白细胞计数相较于治疗前 HR-HPV 阳 性 组 均 更 低(P<0.05);HR-HPV 阳 性 者 加 德 纳 菌 属 、奇异菌属 、巨球菌属 、欧陆森氏菌属等菌属增 多,特别是与细菌性阴道病相关的细菌增多,阴道 乳杆菌丰度减少 。从 CIN I 到宫颈癌卷曲乳杆菌和 穹隆乳杆菌丰度呈下降趋势;惰性乳杆菌丰度呈增 加趋势;定植菌犬布鲁氏菌丰度呈下降趋势;致病 菌戴阿李斯特琥珀酸纤毛杆菌、阴道加德纳菌和短 普雷沃菌丰度呈上升趋势 ;在各类宫颈病变患者 中,病情与阴道滴虫及念珠菌检出率呈正相关。
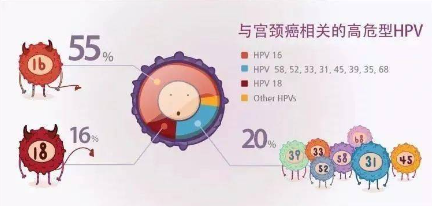
国内外研究均表明,宫颈病变患者生殖道感染率相较于无宫颈病变者更高,且与 HR-HPV 感染有 关[36-37] 。多重感染概率方面,妇女阴道 pH 值增高者 比未增高者 HPV 增加了 30 %[38] 。表明阴道微生态的改变可能与HPV感染和宫颈癌的发生具有相关性。
综上分析 ,子宫颈病变的阴道菌种结构复杂 性 、多样性明显 。 HR-HPV 持续感染所致的宫颈癌前病变与下生殖道感染 、阴道微生态失调密切 相关 。 阴道致病菌感染可导致宫颈黏膜损伤 ,局 部免疫功能减弱,导致 HPV 感染致病性增加;HPV 感染也能改变阴道黏膜的新陈代谢和免疫应答 , 导致菌群失调最终发生宫颈癌;因此,认为宫颈癌 的危险因素之一为阴道微生态失衡 。通过积极预 防和治疗生殖道传染病等有效措施可预防宫 颈癌 。
[参考文献]
[1] 谭 丁及 , 尹洪莉, 朱锐,等. 宫颈皮内瘤变和宫颈癌患者的阴道微生态特点[J].昆明医科大学学报 ,2021. 42(8):118-122.
[2] Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J].J Pathol, 1999. 189(1):12-19.
[3] 谢幸,孔北华,段涛 . 妇产科学[M].1 版 . 北京:人民卫生 出版社, 1980:295.
[4] 李杨 . 人乳头瘤病毒感染对绝经后妇女阴道微生态变化 及免疫功能的影响[J].黑龙江科学,2021. 12(14):68-69.
[5] 刘建华 , 王耀玲 . 阴道微生态变化与宫颈人乳头瘤病 毒感 染及 相关 病 变 的关 系 [J]. 中 国 实 用 妇科 与 产科 杂志,2017.33(8):807-809.
[6] 杨彩虹 ,孟焕然 . 宫颈癌患者阴道微生态变化及其与 细胞免疫的相关性探讨[J]. 中国微生态学杂志 ,2022. 34(2):210-215.
[7] 李健芳 ,冯 勤 梅 ,孙 晋瑞 , 等 . 阴 道微 生 态 与 免疫微 环 境 的 变 化 对 宫 颈 癌 的 影 响 [J]. 中 国 微 生 态 学 杂 志 , 2022.34(4):493-496.
[8] 王捷 , 丁玲 , 吕元婧 , 等 . 高危型 HPV 感染状态下阴道 微环境因子联合检测对低度宫颈上皮内瘤变诊断的 优 化 模 式 研 究 [J]. 中 华 流 行 病 学 杂 志 , 2021. 42(6): 1108-1112.
[9] Chen X, Lu Y, Chen T, et al. The female vaginal micro ‐biome in health and bacterial vaginosisi[J]. Front Cell In ‐ fet Microbiol,2021.7(11):631972.
[10] Braundmeiedkr AG, Lenz KM, inman KS, et al. Indi- vidualized medicine and the microbiome in reproduc ‐ tive tract[J].Front Physiol,2015.6:97.
[11] Van Der Veer C, Hertzberger RY, Bruisten SM, et al. Comparative genomics of human Lactobacillus crispatus isolates reveals genes for glycosylation and glycogen degradation: implications for in vivo dominance of the vaginal microbiota[J].Microbiome,2019.7(1):49.
[12] Witkin SS, Linhares IM. Why do Lactobacilli dominate the human vaginal microbiota[J]. Biog, 2017. 124(4): 606-611.
[13] 李婷,黎欢,李金灵,等 . 阴道微生态研究进展概述[J]. 中国妇幼保健,2022.37(3):574-576.
[14] Dareng EO, Ma B, Famooto AO, et al. Prevalent high- risk HPV infection and vaginal microbiota in Nigerian women[J].Epidemiol Infect,2016. 144(1):123-137.
[15] Klein C, Gonzalez D, Samwel K, et al. Relationship be ‐ tween the cervical microbiome, HIV status, and prec- ancer-ous lesions[J].mBio,2019. 10(1):e02785-18.
[16] Schooley RT. The human microbiome: implications for health and disease, including HIV infection[J].Top Anti‐ vir Med,2018.26(3):75-78










