替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者的效果论文
2026-01-30 14:16:29 来源: 作者:xuling
摘要:替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者,可提高疾病缓解率,改善生命质量,降低肿瘤标志物水平,抑制癌细胞生长,效果优于单纯吉西他滨与吡柔比星治疗。
【摘要】目的:观察替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者的效果。方法:回顾性分析2020年4月至2023年5月该院收治的64例膀胱癌患者的临床资料,根据治疗方法不同将其分为对照组(n=30)、观察组(n=34)。对照组给予吉西他滨联合吡柔比星治疗,观察组在对照组基础上联合替雷利珠单抗治疗。比较两组临床疗效,治疗前后生命质量[卡氏功能状态评分(KPS)]评分、肿瘤标志物[膀胱肿瘤抗原(BTA)、膀胱特异性核基质蛋白-4(BLCA-4)、尿核基质蛋白22(NMP22)]水平、血管生成因子[血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)、成纤维细胞生长因子(FGF)、基质金属蛋白酶-9(MMP-9)]水平,以及不良反应发生率。结果:观察组疾病控制率为91.18%(31/34),高于对照组的66.67%(20/30),差异有统计学意义(P<0.05);治疗后,两组KPS评分均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05);两组BTA、NMP22、BLCA-4水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05);两组VEGF、ICAM-1、FGF、MMP-9水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05);两组骨髓抑制、恶心呕吐、白细胞减少、肾功能损害等不良反应发生率比较,差异无统计学意义(P>0.05)。结论:替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者,可提高疾病缓解率,改善生命质量,降低肿瘤标志物水平,抑制癌细胞生长,效果优于单纯吉西他滨与吡柔比星治疗。
【关键词】膀胱癌;替雷利珠单抗;吉西他滨;吡柔比星;肿瘤标志物;生命质量;血管生成因子
膀胱癌为泌尿系统膀胱黏膜上的恶性肿瘤,患者早期表现为无痛、间歇性肉眼可见的血尿,部分患者可伴有尿频、尿痛、排尿困难等膀胱刺激症状,确诊时多已处于中晚期,5年生存率仅30%左右[1-2]。化疗是膀胱癌常见治疗手段,吡柔比星与吉西他滨通过膀胱灌注可直接到达病灶,抑制肿瘤细胞DNA合成,延缓疾病进展[3]。替雷利珠单抗为程序性死亡受体1(PD-1)抑制剂,其可与T细胞表面的PD-1特异性结合,发挥抗肿瘤作用[4]。本文观察替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者的效果。
1资料与方法
1.1一般资料回顾性分析2020年4月至2023年5月本院收治的64例膀胱癌患者的临床资料。纳入标准:符合《外科学》中膀胱癌的诊断标准[5],经超声、尿路静脉造影、病理检查等确诊;预计生存期≥6个月;卡氏功能状态评分[6](KPS)>70分;符合化疗指征。排除标准:精神异常;合并其他部位恶性肿瘤;存在靶向治疗、化疗禁忌证;伴有血液、免疫系统疾病;既往有肿瘤手术史;伴急慢性感染、全身性疾病。根据治疗方法不同将其分为对照组(n=30)、观察组(n=34)。对照组男23例,女7例;年龄47~68岁,平均(60.14±3.11)岁;临床分期:Ⅲ期18例,Ⅳ期12例;病理类型:腺细胞癌1例,尿路上皮癌23例,鳞状细胞癌6例。观察组男26例,女8例;年龄50~70岁,平均(60.85±2.89)岁;临床分期:Ⅲ期20例,Ⅳ期14例;病理类型:腺细胞癌2例,尿路上皮癌27例,鳞状细胞癌5例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2方法对照组给予注射用盐酸吡柔比星(瀚晖制药有限公司,国药准字H20045983,10 mg)40 mg/次,与40 mL 5%葡萄糖注射液混匀后膀胱灌注给药,15 min更换1次体位,1 h后排出,1次/周;注射用盐酸吉西他滨(辰欣药业股份有限公司,国药准字H20113371,0.2 g)1 g/次,与40 mL 0.9%氯化钠注射液混匀后膀胱灌注给药,15 min更换1次体位,1 h后排出,1次/周。
观察组在对照组基础上增加替雷利珠单抗注射液(广州百济神州生物制药有限公司,国药准字S20190045,100 mg)静脉滴注治疗,200 mg/次,1次/3周。
两组均持续治疗12周。
1.3观察指标(1)比较两组临床疗效。根据实体瘤疗效评价标准(RECIST)[7]:治疗后,病灶完全消失,且持续≥1个月为完全缓解(CR);治疗后,肿瘤体积缩小≥50%,且持续≥1个月为部分缓解(PR);肿瘤体积缩小<50%或增大<20%且未出现新病灶为稳定(SD);肿瘤体积增大>20%或出现新病灶为进展(PD)。疾病控制率=(SD+PR+CR)例数/总例数×100%。(2)比较两组治疗前后生命质量评分。采用KPS评估,总分0~100分,包括11个条目,评分越高生命质量越好。(3)比较两组治疗前后肿瘤标志物水平。收集患者晨起中段尿20 mL,经室温离心分离(速度1000 r/min、时间10 min),取上清液后采用酶联免疫吸附法检测尿核基质蛋白22(NMP22)、膀胱肿瘤抗原(BTA)、膀胱特异性核基质蛋白-4(BLCA-4)水平。(4)比较两组治疗前后血管生长因子水平。采集患者空腹静脉血5 mL,离心分离(速度3000 r/min、时间10 min、半径5 cm),提取血清,采用酶联免疫吸附法检测血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)、基质金属蛋白酶-9(MMP-9)、细胞间黏附分子-1(ICAM-1)水平。(5)比较两组不良反应发生率。
1.4统计学方法应用SPSS 25.0软件进行统计学分析,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两组临床疗效比较观察组疾病控制率为91.18%(31/34),高于对照组的66.67%(20/30),差异有统计学意义(P<0.05)。见表1。
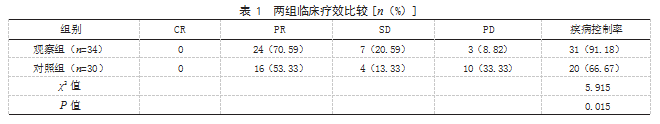
2.2两组治疗前后KPS评分比较治疗前,两组KPS评分比较,差异无统计学意义(P>0.05);治疗后,两组KPS评分均高于治疗前,且观察组高于对照组,差异有统计学意义(P<0.05)。见表2。
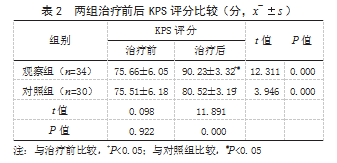
2.3两组治疗前后肿瘤标志物水平比较治疗前,两组BTA、NMP22、BLCA-4水平比较,差异均无统计学意义(P>0.05);治疗后,两组BTA、NMP22、BLCA-4水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。见表3。
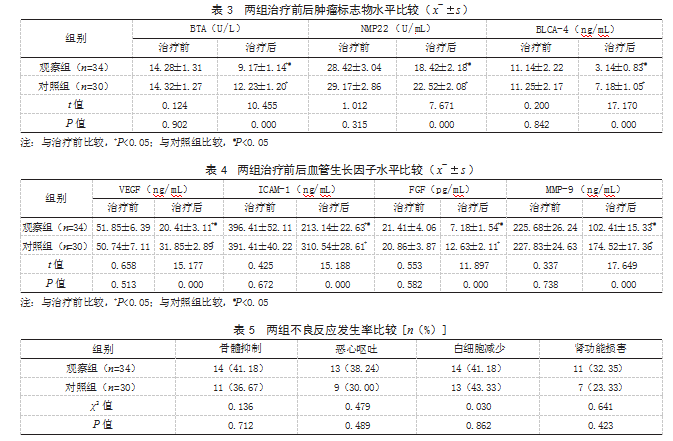
2.4两组治疗前后血管生长因子水平比较治疗前,两组VEGF、ICAM-1、FGF、MMP-9水平比较,差异均无统计学意义(P>0.05);治疗后,两组VEGF、ICAM-1、FGF、MMP-9水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05)。见表4。
2.5两组不良反应发生率比较两组骨髓抑制、恶心呕吐、白细胞减少、肾功能损害等不良反应发生率比较,差异均无统计学意义(P>0.05)。见表5。
3讨论
我国膀胱癌发病率约为5.80/10万,居全身恶性肿瘤第13位,严重威胁高年龄段人群生命健康[8-9]。吡柔比星可干扰癌细胞DNA的有丝分裂,促进癌细胞凋亡[10]。吉西他滨为新型胞嘧啶核苷衍生物,可产生活性代谢产物进入肿瘤细胞DNA,降低核苷酸还原酶的活性,增高凋亡相关蛋白的表达,从而抑制肿瘤细胞增殖和分裂[11]。
本研究结果显示,观察组疾病缓解率、KPS评分均高于对照组,BTA、NMP22、BLCA-4水平均低于对照组。分析原因为替雷利珠单抗为新型免疫检查点抑制剂,其通过阻断PD-1与程序性死亡配体1结合,再次激活T细胞抗肿瘤应答,继而促进T细胞发挥免疫杀伤功能;通过调节免疫抑制通路,激活机体免疫系统,减轻正常细胞损伤,且可长期维持免疫系统活性,联合吡柔比星与吉西他滨可发挥协同抗肿瘤作用。
已知ICAM-1可介导淋巴细胞与肿瘤细胞黏附,促进肿瘤转移、浸润;VEGF参与肿瘤细胞生长,加快肿瘤侵袭转移;MMP-9可促进肿瘤浸润、转移;FGF异常表达可导致膀胱上皮细胞过度增殖[12]。本研究结果同时显示,观察组VEGF、ICAM-1、FGF、MMP-9等血管生长因子水平均低于对照组。分析原因为雷利珠单抗可通过与PD-1结合,抑制肿瘤血管生成和肿瘤生长,进而发挥抗肿瘤作用。本研究结果还显示,两组骨髓抑制、恶心呕、白细胞减少、肾功能损害等不良反应发生率比较,差异均无统计学意义。提示联合替雷利珠单抗治疗未增加安全风险。
综上所述,替雷利珠单抗联合吉西他滨与吡柔比星治疗膀胱癌患者,可提高疾病缓解率,改善生命质量,降低肿瘤标志物水平,抑制癌细胞生长,效果优于单纯吉西他滨与吡柔比星治疗。
参考文献
[1]谢逸轩,王赛,朱飞鹏,等.基于中西医临床病证特点的膀胱癌动物模型分析[J].中药药理与临床,2023,39(10):83-86.
[2]杨佳健,盖年鑫,林宇鑫,等.膀胱癌化疗耐药机制的研究进展[J].中华实验外科杂志,2022,39(10):2046-2049.
[3]胡啸,邓丽,周琴.膀胱癌电切术后应用吉西他滨与吡柔比星治疗膀胱癌的临床疗效比较[J].临床合理用药杂志,2023,16(3):92-94.
[4]王丛巍,吴启哲,冯源康,等.PD-1抑制剂联合化疗与单独化疗对转移性膀胱癌患者的有效性和安全性比较[J].中华泌尿外科杂志,2023,44(11):806-811.
[5]陈孝平,王建平.外科学[M].8版.北京:人民卫生出版社,2013:585-587.
[6]MCNAIR K M,ZEITLIN D,SLIVKA A M,et al.Translation of Karnofsky Performance Status(KPS)for use in inpatient cancer rehabilitation[J].PM R,2023,15(1):65-68.
[7]杨学宁,吴一龙.实体瘤治疗疗效评价标准—RECIST[J].循证医学,2004,4(2):85-90.
[8]李辉章,郑荣寿,杜灵彬,等.中国膀胱癌流行现状与趋势分析[J].中华肿瘤杂志,2021,43(3):293-298.
[9]李森林,李心远,陈勇,等.维迪西妥单抗联合替雷利珠单抗在膀胱癌新辅助治疗中的疗效和安全性分析[J].中华泌尿外科杂志,2023,44(11):812-817.
[10]罗婉茹,田军,章慧平,等.HAL光动力治疗联合吡柔比星对膀胱癌细胞的杀伤作用及其机制的体外实验研究[J].现代泌尿生殖肿瘤杂志,2023,15(3):166-172.
[11]张新军.吉西他滨联合顺铂新辅助化疗方案治疗晚期局部膀胱癌的效果研究[J].实用癌症杂志,2022,37(4):656-658.
[12]唐澜南,杜娟,陈小龙,等.膀胱癌TURB术后灌注卡介苗与吉西他滨毒副反应分析[J].贵州医药,2021,45(11):1742-1744.










