育龄期女性缺铁性贫血患者血清富亮氨酸 α2- 糖蛋白 1、MCV 、RDW 及铁代谢指标的表达水平及临床意义论文
2025-11-20 18:00:35 来源: 作者:xuling
摘要:育龄期女性IDA患者LRG1、MCV、RDW及铁代谢指标明显异常,这些指标的变化与贫血的严重程度密切相关,LRG1和sTfR与Hb呈负相关关系,而MCV和血清铁与Hb则呈正相关关系。
[摘要]目的探讨育龄期女性缺铁性贫血(iron deficiency anemia,IDA)患者血清富亮氨酸α2-糖蛋白1(leucine-richα-2 glycoprotein 1,LRG1)、平均红细胞体积(mean corpuscular volume,MCV)、红细胞分布宽度(red blood cell distribution width,RDW)及铁代谢相关指标的表达水平及临床意义。方法目的选取2022年3月—2024年3月在常州市武进人民医院住院的79例育龄女性IDA患者为研究对象,作为IDA组,再根据贫血严重程度分为轻度IDA组(43例)和中重度IDA组(36例)。同期选取76名健康女性作为对照组。比较3组LRG1、MCV、RDW及铁代谢指标[血清铁、可溶性转铁蛋白受体(soluble transferrin receptor,sTfR)、铁蛋白(fer⁃ritin,FER)]的差异,并分析LRG1、MCV、RDW及铁代谢指标与血红蛋白(hemoglobin,Hb)水平的相关性。结果对照组与IDA组LRG1、MCV、RDW及铁代谢指标比较,差异均有统计学意义(P均<0.05)。中重度IDA组MCV、血清铁水平低于轻度IDA组,RDW、sTfR、LRG1水平高于轻度IDA组,差异均有统计学意义(P均<0.05)。MCV、血清铁变化程度与Hb水平成正相关(r=0.585,0.398;P均<0.001)。LRG1、sTfR与Hb水平成负相关(r=-0.416,-0.510;P均<0.001)。结论育龄期女性IDA患者LRG1、MCV、RDW及铁代谢指标明显异常,这些指标的变化与贫血的严重程度密切相关,LRG1和sTfR与Hb呈负相关关系,而MCV和血清铁与Hb则呈正相关关系。
[关键词]育龄期女性;缺铁性贫血;富亮氨酸α2-糖蛋白1;铁代谢指标
铁是维持生物细胞功能的关键金属,涉及DNA合成、酶活性和氧气传输等[1]。缺铁性贫血(iron de⁃ficiency anemia,IDA)是体内铁代谢失衡,导致红细胞生成障碍而引发的一种贫血,其发病原因较为复杂,严重时可发生心血管代偿性病变。富亮氨酸α2-糖蛋白1(leucine-richα-2 glycoprotein 1,LRG1)是一种主要由肝脏合成的富含亮氨酸重复序列的糖蛋白,与糖尿病、心脏病以及癌症等多种疾病有关[2]。在对儿童IDA人群中的研究中显示LRG1的表达明显增加[3]。平均红细胞体积(mean corpuscu⁃lar volume,MCV)、红细胞分布宽度(red blood cell distribution width,RDW)及铁代谢指标常用来评估体内铁的代谢、储存及IDA与其他类型贫血的鉴别诊断。本研究旨在分析LRG1、MCV、RDW及铁代谢指标的水平变化,以及与贫血严重程度之间的关系,探讨LRG1、MCV、RDW及铁代谢指标在育龄期女性IDA发生发展中的作用。以期为深入了解IDA的发病机制以及寻找潜在的治疗靶点提供新的视角和思路。现报道如下。
1资料与方法
1.1一般资料
目的选取2022年3月—2024年3月在常州市武进人民医院住院的79例育龄女性IDA患者为研究对象,IDA组患者年龄21~49岁,平均(39.33±6.55)岁。同期选取76名健康女性作为对照组,年龄22~49岁,平均(38.66±6.59)岁。两组受试者一般资料比较,差异均无统计学意义(P均>0.05),具有可比性。根据血红蛋白(hemoglobin,Hb)水平判断贫血严重程度,并据此将育龄期IDA患者进行分组,轻度IDA组43例,Hb 90~110 g/L;中重度IDA组36例,Hb<90 g/L。本研究已按照规定获得患者知情同意,并经过常州市武进人民医院伦理委员会批准(2024-SR-103)。
1.2纳入与排除标准
纳入标准:符合《血液病诊断及疗效标准》[4]中的诊断标准;近期未使用铁剂、促红细胞生成素等药物。
排除标准:合并糖尿病者;合并血红蛋白病者;合并恶性肿瘤者;患有心、肝、肾功能异常引起的贫血者。
1.3检测方法
仪器与试剂:希森美康全自动血细胞分析仪XN9000及配套试剂,贝克曼全自动生化分析仪AU5800及配套试剂,贝克曼全自动微粒子化学发光仪DXi800及配套试剂,人LRG1 ELISA试剂盒(日本IBL,27769)。
于清晨空腹采集EDTA-K2抗凝血3 mL,混匀后2 h内进行血细胞分析,获得MCV、RDW检测结果。采集促凝血5 mL,静置30 min后,3 000 rpm,半径10 cm,离心10 min,取血清检测血清铁、可溶性转铁蛋白受体(soluble transferrin receptor,sTfR)、铁蛋白(ferritin,FER),另吸取0.5 mL血清置于冻存管内-80℃保存,严格按照LRG1 ELISA试剂说明书操作,检测LRG1,样本稀释比例1∶10 000。
1.4观察指标
对比IDA组和对照组MCV、RDW、血清铁、sTfR、FER、LRG1。对比不同严重程度贫血患者的MCV、RDW、血清铁、sTfR、FER、LRG1。分析LRG1及其他指标与Hb水平的相关性。
1.5统计方法
采用SPSS 21.0统计学软件处理数据,计量资料(LRG1、MCV、RDW及铁代谢指标)经Shapiro-Wilk检验,符合正态分布,以(±s)表示,组间比较行两独立样本t检验。变量间的相关性分析应用Spearman分析,绘制散点图。P<0.05为差异有统计学意义。
2结果
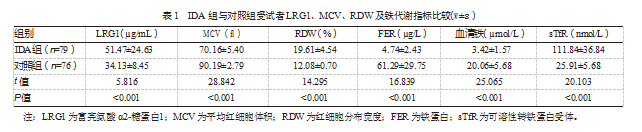
2.1 IDA组与对照组受试者LRG1、MCV、RDW及铁代谢指标比较
与对照组相比,IDA组患者MCV、FER和血清铁水平更低,RDW、sTfR和LRG1水平更高,差异均有统计学意义(P均<0.05)。见表1。
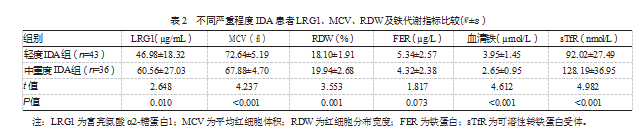
2.2不同严重程度IDA患者LRG1、MCV、RDW及铁代谢指标比较
中重度IDA组MCV、血清铁水平低于轻度IDA组,RDW、sTfR、LRG1水平高于轻度IDA组,差异均有统计学意义(P均<0.05);两组FER水平比较,差异无统计学意义(P>0.05)。见表2。
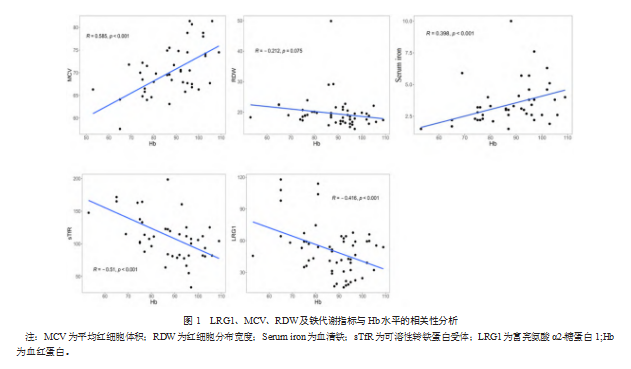
2.3 LRG1、MCV、RDW及铁代谢指标与Hb水平的相关性分析
MCV、血清铁变化程度与Hb水平成正相关(r=0.585,0.398;P均<0.001)。LRG1、sTfR与Hb水平成负相关(r=-0.416,-0.510;P均<0.001),而RDW与Hb水平不相关(r=-0.212,P>0.05)。见图1。
3讨论
铁是人体内至关重要的微量元素之一,参与众多的生理过程与代谢反应。缺铁会影响整体健康以及认知和运动发育[5]。IDA是铁缺乏症的最终阶段,早期以非特异性症状为主(如倦怠、耐力下降),随铁储备耗竭逐渐出现缺氧体征(如活动心悸、呼吸困难)。其发生与铁吸收-丢失失衡直接相关,可累及免疫及心血管系统。
细胞内铁稳态主要由FER、转铁蛋白和转铁蛋白受体介导,细胞膜上的转铁蛋白受体与转铁蛋白形成复合物,通过膜内吞作用摄取和利用铁元素。细胞内多余的铁则以FER的形式储存,从而确保铁在细胞内的稳态平衡。这一机制对于维持细胞的正常生理功能至关重要。sTfR是转铁蛋白受体的截短形式,血清中的sTfR不随炎症反应的波动而变化,是提示缺铁性红细胞生成期的首选标志物。在排除炎症、肿瘤、氧化应激等因素的影响后,血清铁蛋白常用于监测铁缺乏或铁过载的情况,能够间接反映体内的铁负荷水平[6-8]。本研究显示,育龄期女性IDA患者中,血清铁、MCV、FER水平明显下降,RDW、sTfR和LRG1水平明显增加(P均<0.01),与李丽等[9]的研究结果一致。本研究还发现血清铁和sTfR与贫血严重程度密切相关,可能是随着贫血程度的加重,铁元素消耗增加,因此导致血清铁明显降低,而sTfR明显增高。
LRG1是新型促血管生成因子,其血清浓度与乳腺癌、肾脏纤维化等疾病进展显著相关,可作为诊断及预后的新型生物标志物[10-11]。值得注意的是,缺铁与缺氧之间存在密切联系,缺铁状态会促进缺氧诱导因子-1α(Hypoxia-Inducible Factor-1α,HIF-1α)的形成,而LRG1同样具有调节HIF-1α表达的能力,这使得LRG1与IDA之间的关系变得尤为引人关注。本研究结果显示,育龄期女性IDA患者血清LRG1水平明显增加,这与ALHAMMAD R等[3]的研究结果类似。目前关于LRG1与IDA之间关系的研究相对较少,其具体机制尚未完全明确。缺铁会增加HIF-1α蛋白的表达,从而上调白细胞介素6(interleukin 6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的表达[12]。细胞因子如IL-6和TNF-α,可直接通过调控LRG1启动子,进而在转录水平上调LRG1的表达。本研究观察到LRG1变化程度与Hb水平密切相关,提示LRG1可能是评估贫血严重程度的一个潜在指标,LRG1升高可能是IDA的结果,监测血清LRG1水平,可能有助于更准确地评估贫血的严重程度。
综上所述,本研究结果表明育龄期女性IDA患者LRG1和铁代谢参数存在明显异常,且与Hb水平密切相关。对于IDA患者,联合检测LRG1、MCV、RDW和铁代谢参数更好地判断机体的贫血及缺氧状态,有助于早期干预,减少继发性损害的发生。
[参考文献]
[1]郭州,彭雅文,孙凯,等.铁代谢及其与骨关节炎关系的研究进展[J].骨科,2020,11(5):457-462.
[2]于菁,张俊.富亮氨酸α-2糖蛋白-1的研究进展[J].实用医学杂志,2019,35(17):2818-2823.
[3]ALHAMMAD R,ABU-FARHA M,RAHMAN A,et al.LRG1 associates with iron deficiency anemia markers in adolescents[J].Nutrients,2023,15(14):3100.
[4]沈悌,赵永强,周道斌,等.血液病诊断及疗效标准[M].4版.北京:科学出版社,2018.
[5]张一妙,朱丽红.妊娠期铁缺乏和缺铁性贫血对子代大脑发育影响的研究进展[J].现代医学,2023,51(3):412-416.
[6]王胜,冯益,侯思雨,等.血清铁蛋白、转铁蛋白联合25-羟基维生素D指标检测对婴幼儿缺铁性贫血的预测价值[J].中国初级卫生保健,2024,38(7):40-43.
[7]侯立安,徐二木,夏良裕,等.铁代谢相关生化指标在缺铁性贫血诊断中的应用[J].中国实验诊断学,2022,6(26):881-886.
[8]吴冬.RBC、RDW、MCV、MCH、HB、A2、铁结合力铁、铁蛋白检验鉴别地中海贫血与缺铁性贫血的价值分析[J].中国科技期刊数据库医药,2024(5):7-10.
[9]李丽,邓茜,李海荣,等.血清铁调素及MCV、MCH等红细胞参数在不同严重程度缺铁性贫血患者中的比较研究[J].疑难病杂志,2024,23(5):585-589.
[10]王虹娟,赵辉,刘雅琳,等.血清铁蛋白结合红细胞参数及形态学检查在妊娠期铁缺乏症和缺铁性贫血诊断中的价值[J].国际检验医学杂志,2023,44(9):1101-1104.
[11]CAMILLI C,HOEH AE,DE ROSSI G,et al.LRG1:An emerging player in disease pathogenesis[J].J Biomed Sci,2022,29(1):6.
[12]DRITSOULA A,DOWSETT L,PILOTTI C,et al.An⁃giopathic activity of LRG1 is induced by the IL-6/STAT3 pathway[J].Sci Rep,2022,12(1):4867.










