免疫耐受对帕金森小鼠的神经保护机制论文
2025-11-20 17:57:07 来源: 作者:xuling
摘要:高剂量LPS注射可引发小鼠黑质区促炎因子水平升高、抗炎因子下降、纹状体DA减少以及DA能神经元数量减少,导致行为学损伤。免疫耐受预处理可减轻PD小鼠的炎症反应,保护多巴胺能神经元,改善运动障碍。免疫耐受本身不引起炎症及神经损伤等。
[摘要]目的通过腹腔注射低剂量脂多糖(lipopolysaccharide,LPS)(0.3 mg/kg)诱导小鼠免疫耐受,随后注射高剂量LPS(1 mg/kg)建立帕金森(parkinson's disease,PD)小鼠模型,探讨免疫耐受对PD的神经保护机制。方法将购自牡丹江医学院动物实验中心的40只SPF级C57BL/6J小鼠按随机数字表法分为对照组、免疫耐受组、模型组和干预组,每组10只。使用不同剂量LPS分别连续腹腔注射,末次注射后28 d,通过悬尾实验和握力实验,观察小鼠运动状态。采用酶联免疫吸附试验检测各组小鼠纹状体多巴胺(dopamine,DA)、黑质区的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)、白细胞介素10(interleukin 10,IL-10)的水平;免疫荧光法检测黑质区酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性细胞数。结果干预组的悬尾实验和握力实验结果优于模型组,差异均有统计学意义(P均<0.05)。与对照组相比,模型组TNF-α、IL-1β的表达更高,IL-10、DA的表达更低,差异均有统计学意义(q=8.76,7.93,5.12,7.84;P均<0.05)。与模型组相比,干预组TNF-α、IL-1β的表达水平更低,DA表达更高,差异均有统计学意义(q=7.25,4.87,5.23;P均<0.05)。模型组小鼠TH阳性细胞数少于对照组,干预组TH细胞数多于模型组,差异均有统计学意义(P均<0.05)。结论高剂量LPS注射可引发小鼠黑质区促炎因子水平升高、抗炎因子下降、纹状体DA减少以及DA能神经元数量减少,导致行为学损伤。免疫耐受预处理可减轻PD小鼠的炎症反应,保护多巴胺能神经元,改善运动障碍。免疫耐受本身不引起炎症及神经损伤等。
[关键词]帕金森病;免疫耐受;炎症细胞因子;多巴胺能神经元;神经保护机制
帕金森病(parkinson's disease,PD)是一种以运动迟缓、静止性震颤为主要表现的神经系统退行性疾病,其典型病理变化是黑质致密部多巴胺(dopa⁃mine,DA)能神经元进行性丢失伴纹状体内DA分泌减少[1]。当前已经确定神经炎症及过度免疫反应介导的神经毒性能促进DA能神经元的死亡进程[2]。非甾体抗炎药物因血脑屏障阻碍等因素难以达到克服和逆转神经炎症所必需的血药浓度[3],免疫抑制剂可以阻止或部分逆转PD样变化[4-5],但由于成本过高、损伤过大而限制了其使用范围。因此,迫切需要新的免疫调节方法来对抗神经炎症。低剂量脂多糖(lipopolysaccharide,LPS)诱导的免疫耐受为炎症相关疾病的防治带来了新的转机,且具有便捷、低价的优势,应用前景值得关注。高剂量的LPS常用于构建与炎症相关的PD动物模型[6-7]。因此,本研究运用低剂量LPS诱导小鼠形成免疫耐受,选用高剂量LPS来构建PD小鼠模型,探索免疫耐受在PD小鼠神经炎症机制中所起到的作用,从全新的角度去理解PD的病理机制,为开发针对PD的免疫干预手段提供有益的参考和指引。
1资料与方法
1.1实验动物
40只8周龄雄性SPF级C57BL/6J小鼠,由牡丹江医学院动物实验中心提供,体质量为20~24 g。小鼠被饲养在标准饲养笼具内,每笼5只,饲养条件如下:温度为23~25℃,小鼠自由采食和饮水。本研究经牡丹江医科大学动物伦理委员会批准(IACUC-20240919-193)。
1.2药物、主要试剂与仪器
LPS阿拉丁试剂有限公司、小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(武汉博士德生物工程有限公司)、小鼠白细胞介素1β(interleukin 1β,IL-1β)检测试剂盒(武汉博士德生物工程有限公司)、小鼠白细胞介素10(interleukin 10,IL-10)检测试剂盒(武汉博士德生物工程有限公司)、小鼠的DA检测试剂盒(武汉博士德生物工程有限公司)、二辛可宁酸(bicincho⁃ninic acid,BCA)检测试剂盒(碧云天试剂有限公司)、酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体(CST试剂有限公司)、Alexa Fluor 594驴抗兔免疫球蛋白G(immunoglobulin G,IgG)(CST试剂有限公司)。主要仪器:冰箱、4℃低温离心机、荧光显微镜、电子显微镜。
1.3实验方法
1.3.1动物分组及实验处理应用随机数字表法将小鼠分为4组,每组10只。对照组:连续8 d接受8次磷酸盐缓冲液(phosphate buffered saline,PBS)腹腔注射。免疫耐受组:前4 d连续腹腔注射4次LPS(0.3 mg/kg),随后4 d腹腔注射4次PBS。模型组:连续4 d给予PBS腹腔注射,之后连续4 d腹腔注射LPS(1 mg/kg)。干预组:连续4 d腹腔注射LPS(0.3 mg/kg),随后连续4 d腹腔注射LPS(1 mg/kg)。末次处理后28 d进行行为学实验,行为学实验后处死取材并检测。给药方式按照Wendeln的方法[8]。实验过程中无动物死亡。每天上午10点记录各组小鼠体质量。
1.3.2鼠尾悬挂实验实验中倒挂小鼠,小鼠为了对抗这种异常的姿势,会进行强烈的挣扎以试图逃脱。当小鼠无法通过努力摆脱这种困境时,便会表现出间歇性的停止挣扎,出现“行为绝望”的现象,以此评估小鼠的抑郁样行为损伤。通过将小鼠尾部的1/3处用不粘胶粘贴,悬挂于悬尾箱中,确保其头部面向摄像头,且距离箱底部约10 cm。利用摄像装置捕捉小鼠在6 min测试期间的行为动态,详细记录其首次进入不动状态的时刻和不动状态的总时长。不动状态是指小鼠停止所有积极挣扎行为,呈现出完全静止的姿态。基于这些行为指标,对小鼠的行为反应进行最终评分。具体测量以下参数:运动时间、不动时间、挣扎程度。根据以下标准,将每只小鼠的挣扎程度从1~3分进行打分:1分为完全不挣扎;2分为轻到中度挣扎;3分为剧烈挣扎。首次不动潜伏期作为鼠尾悬挂实验的稳定参数。
1.3.3握力实验使实验小鼠两只前爪抓住正前方直径约为3 mm的水平绳子,其尾部距离箱底约20 cm,小鼠通过肌肉收缩发力来保持身体平衡以不掉落地面,以此评估小鼠的肌肉张力以及运动协调能力。用摄像系统记录60 s内的行为,并根据表现情况评分。具体测量参数包括:①保持在绳子上不掉落的时间。②保持不掉落时的四肢发力情况,根据以下标准,将每只小鼠的表现从1~4分进行打分:1分为5 s内从绳上掉落;2分为只用两只前爪抓住绳子;3分为用四只爪抓住绳子但保持不动;4分为用四只爪抓住绳子同时爬到绳子一端。
1.3.4 ELISA ELISA检测小鼠脑内DA的表达以及炎症因子的表达,炎症因子包括促炎因子TNF-α和IL-1β、抗炎因子IL-10。小鼠处死后,冰上迅速断头取脑,分离出脑组织,放入无菌1.5 mL EP管中。按照100 mg∶1 mL的比例加入无菌生理盐水,匀浆机冰上匀浆,匀浆后12 000 r/min 4℃离心15 min。转移上清至另一1.5 mL EP管中,采用BCA法测定各个样品的蛋白浓度。按照ELISA试剂盒操作指南依次完成。
1.3.5免疫荧光实验免疫荧光染色检测小鼠脑组织中TH阳性细胞数。2%戊巴比妥钠腹腔注射麻醉小鼠,再用生理盐水及4%多聚甲醛依次心脏灌注后取脑。脑组织在4%多聚甲醛中固定24 h后浸入15%、30%蔗糖溶液中梯度脱水,脑组织沉底后取出,吸干表面水分,使用包埋剂包埋脑组织,冰冻切片机进行切片,切片厚度为10µm,固定在多聚L-赖氨酸包被的载玻片上。PBS洗涤3次(5 min/次),2%驴血清室温封闭40 min后,加入TH抗体,4℃孵育过夜。再次PBS洗涤3次(5 min/次),加入Alexa Fluor 594驴抗兔IgG,37℃孵育30 min,PBS洗涤3次(5 min/次)。室温晾干,防淬灭封片液封片。荧光显微镜下观察切片,借助分析测量图像软件Image-J统计分析。
1.4统计方法
采用SPSS 23.0统计学软件处理数据。采用Kolmogorov-Smirnov test(K-S test)评估数据的正态性,未进行异常值检验。数据比较采用单因素方差分析,两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2结果
2.1免疫耐受预处理改善持续腹腔高剂量LPS注射诱导的行为学损伤
从行为学角度观察免疫耐受预处理对持续腹腔高剂量LPS注射所致DA能神经元损伤的保护作用,通过悬尾实验和握力实验进行评估。
2.1.1悬尾实验在悬尾实验中,模型组小鼠表现出显著的动作缓慢和迟钝现象,而其他组未见此现象。与对照组相比,模型组的不动时间增加、运动时间和挣扎程度降低,差异均有统计学意义(q=8.24,7.65,6.92;P均<0.01)。免疫耐受组与对照组的运动时间、不动时间、挣扎程度相比,差异均无统计学意义(q=1.23,0.98,0.55;P=0.427,0.443,1.000)。与模型组相比,干预组的不动时间显著减少、运动时间和挣扎程度均显著增加,差异均有统计学意义(q=7.89,6.45,5.82;P均<0.01)。见图1。2.1.2握力实验在握力实验中,模型组小鼠在实验过程中表现出肢体僵硬、姿态不稳及震颤现象,而其他组未见明显异常。与对照组相比,模型组小鼠保持在绳子上维持时间显著缩短、挣扎程度减弱,差异均有统计学意义(q=9.37,8.65;P均<0.01)。免疫耐受组与对照组维持时间、挣扎程度相比,差异均无统计学意义(q=0.72,1.52;P=0.836,0.372)。与模型组相比,干预组小鼠维持时间延长、挣扎程度改善,差异均有统计学意义(q=7.89,6.94;P均<0.01)。见图2。
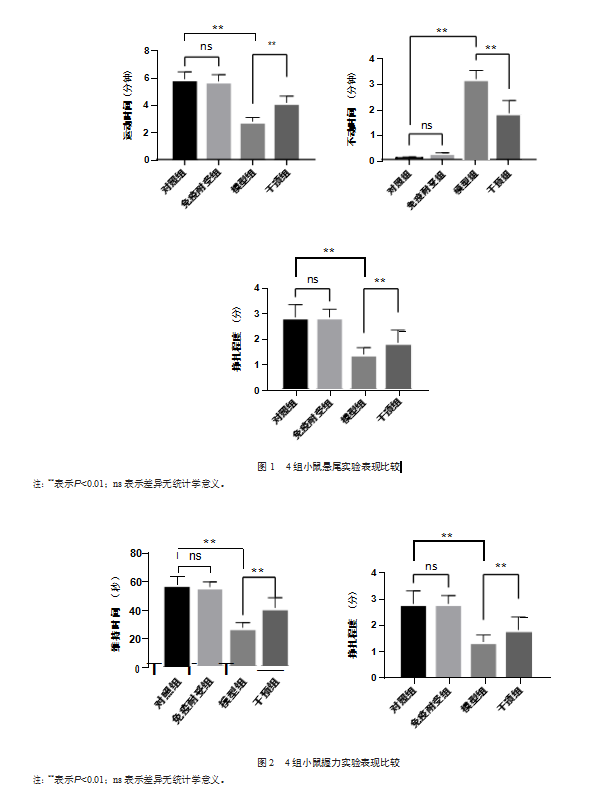
2.2免疫耐受预处理降低小鼠的炎症反应
与对照组相比,模型组中脑黑质区(substantia nigra,SN)中TNF-α、IL-1β的表达更高,IL-10的表达更低,差异均有统计学意义(q=8.76,7.93,5.12;P均<0.05)。免疫耐受组与对照组的TNF-α和IL-1β的表达水平比较,差异均无统计学意义(q=1.34,1.89;P均>0.05);但免疫耐受组IL-10表达水平高于对照组,差异有统计学意义(q=6.45,P<0.01),说明免疫耐受预处理不会导致小鼠的促炎因子增加。与模型组相比,干预组TNF-α、IL-1β的表达水平更低,差异均有统计学意义(q=7.25,4.87;P均<0.05)。见图3。免疫耐受能使高剂量LPS诱导的PD小鼠模型中的促炎细胞因子降低,抗炎细胞因子增加,从而降低炎症反应的强度。
2.3免疫耐受预处理改善了小鼠纹状体中DA分泌的减少
与对照组相比,模型组纹状体DA的表达更低,差异有统计学意义(q=7.84,P<0.01)。但免疫耐受组DA的水平与对照组相比,差异无统计学意义(q=1.62,P>0.05)。与模型组相比,干预组DA表达更高,差异有统计学意义(q=5.23,P<0.05)。见图3。免疫耐受预处理能够改善持续腹腔高剂量LPS注射导致的DA表达减少的情况。
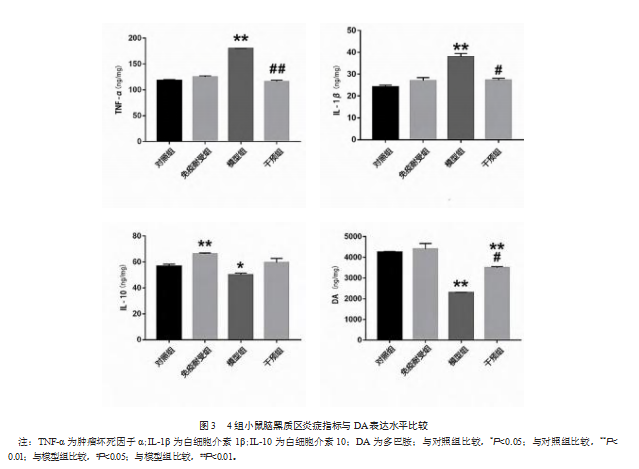
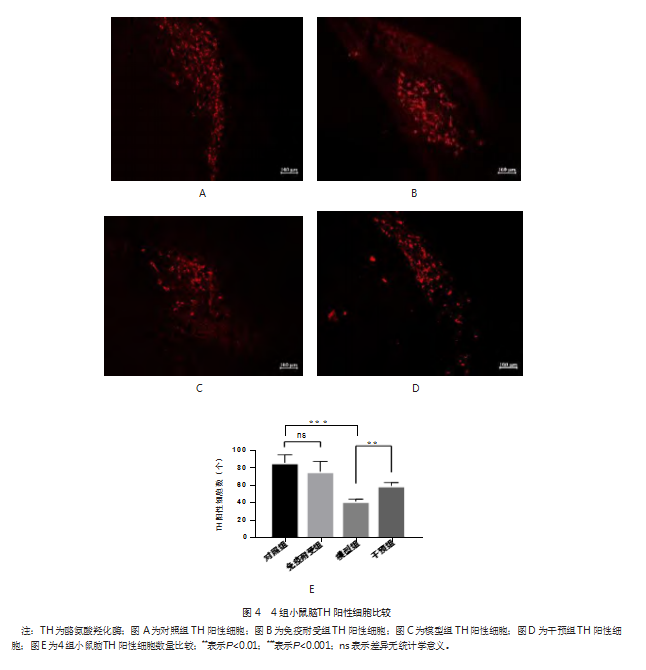
2.4免疫耐受预处理改善小鼠脑TH阳性细胞数下降
与对照组相比,模型组小鼠TH阳性细胞数更少,差异有统计学意义(q=9.15,P<0.001)。免疫耐受组TH细胞数与对照组相比,差异无统计学意义(q=1.45,P>0.05)。与模型组相比,干预组TH细胞数更多,差异有统计学意义(q=6.72,P<0.01)。见图4。免疫耐受预处理可以减轻腹腔持续高剂量LPS诱导的PD小鼠模型中的DA能神经元损伤。
3讨论
PD作为一种常见的神经退行性疾病,已成为全球人口老龄化进程中的重要公共卫生问题。现有治疗策略,如药物替代治疗或脑深部电刺激,虽然可以改善运动症状,但不能有效延缓或逆转神经退行性损伤[9-10],因此探索新的治疗策略,特别是早期干预治疗PD成为研究的重点。
多项研究已证实神经炎症是神经退行性疾病发生和发展的重要机制。PD患者神经炎症的增加,会加速黑质致密部DA能神经元变性,神经元变性进一步放大脑内的神经炎性反应,导致神经退变的恶性循环。因此及时限制、下调炎症反应极为重要,免疫耐受对脑内炎症的有效调控是接下来研究治疗PD的关键。已有研究表明免疫耐受预处理可以改善小鼠PD样病理损伤[11]。本研究进一步证实,免疫耐受预处理可抑制持续高剂量LPS注射诱导的炎性细胞活化,缓解高剂量LPS注射介导的神经系统炎症,表现为促炎因子TNF-α、IL-1β水平下降和抗炎因子IL-10水平提高。同时免疫耐受预处理抑制了模型组TH阳性细胞的减少,说明抑制了DA能神经元的丢失。免疫耐受预处理抑制了模型组纹状体DA分泌的减少,说明保护了DA能神经元的功能。行为学实验表明,免疫耐受预处理改善了小鼠抑郁及运动障碍等行为表现。免疫耐受未影响健康小鼠脑黑质内的炎症因子表达、多巴胺能神经元数量以及行为状态。说明免疫耐受作为一种干预手段,其安全性是可靠的。
以上实验结果为免疫耐受作为PD预防和干预手段提供了有力的证据,免疫耐受预处理在神经炎症诱导的神经退行性疾病中的保护作用说明通过对免疫状态的调节能够影响神经系统炎症的发展,其可能机制为,①免疫耐受可以减少从腹腔渗透进入脑内的促炎因子的分泌[12];②免疫耐受可通过干扰外周血单核巨噬细胞与脑内其他细胞如血管周细胞、血脑屏障的内皮细胞等之间的交互作用来重塑神经系统炎症刺激下的中枢系统微环境[13-14];③免疫耐受可能通过抑制氧化应激、保护线粒体功能而促进神经元存活[15];④可能与外周T细胞向脑内的浸润减少有关[16-17]。
综上所述,本研究证明免疫耐受作为PD预防和干预的一种手段具有显著的神经保护作用。低剂量LPS诱导的免疫耐受通过减轻神经炎症、保护DA能神经元和改善行为功能而显示出在PD治疗中的潜力。但是,免疫耐受的具体机制、临床可行性及其广泛适用性仍需深入研究。未来的研究应利用更多PD动物模型、分子基因组学分析和临床试验,进一步验证免疫耐受在PD中的作用和潜力,为开发新的预防和干预策略奠定理论和实验基础。
[参考文献]
[1]王晓蕊,朱松鑫,温晓鸣,等.多巴胺代谢异常在帕金森病相关病理变化中的作用[J].生理学报,2021,73(1):89-102.
[2]任怡,叶民.胶质细胞与帕金森病免疫/炎症机制的关系[J].临床神经病学杂志,2014,27(1):70-71.
[3]单江晖,储超扬,陈是燏,等.不同干预手段改善神经炎症在治疗阿尔茨海默病中的效果分析[J].生物化学与生物物理进展,2025,52(2):310-333.
[4]周美,倪慧心,刘海鑫,等.帕金森病神经炎症的发生与免疫调节疗法[J].海南医学院学报,2024,30(18):1433-1440.
[5]RACETTE BA,GROSS A,VOURI SM,et al.Immuno⁃suppressants and risk of Parkinson disease[J].Ann Clin Transl Neurol,2018,5(7):870-875.
[6]袁廷伟,孙芳玲,蒋莹,等.炎症在帕金森病中的作用[J].中国康复理论与实践,2013,19(7):640-644.
[7]CHIA SJ,TAN EK,CHAO YX.Historical perspective:models of Parkinson's disease[J].Int J Mol Sci,2020,21(7):2464.
[8]WENDELN AC,DEGENHARDT K,KAURANI L,et al.Innate immune memory in the brain shapes neurological disease hallmarks[J].Nature,2018,556(7701):332-338.
[9]TANNER CM,OSTREM JL.Parkinson's disease[J].N Engl J Med,2024,391(5):442-452.
[10]JANKOVIC J,TAN EK.Parkinson's disease:Etiopatho⁃genesis and treatment[J].J Neurol Neurosurg Psychiatry,2020,91(8):795-808.
[11]张小军.基于小胶质细胞免疫记忆研究外周炎症刺激对帕金森病样病理的影响及机制[D].苏州:苏州大学,2022.
[12]王璟,夏杰,赵娜,等.运动通过调节肠道菌群-肠-脑轴免疫途径改善阿尔茨海默症炎症病理的研究进展[J].生命科学,2022,34(5):599-607.
[13]WASCHBISCH A,SCHRODER S,SCHRAUDNER D,et al.Pivotal role for CD16+monocytes in immune sur⁃veillance of the central nervous system[J].J Immunol,2016,196(4):1558-1567.
[14]MAN S,TUCKY B,COTLEUR A,et al.CXCL12-in⁃duced monocyte-endothelial interactions promote lym⁃phocyte transmigration across an in vitro blood-brain barrier[J].Sci Transl Med,2012,4(119):119ra14.
[15]ELFAWY HA,DAS B.Crosstalk between mitochon⁃drial dysfunction,oxidative stress,and age related neu⁃rodegenerative disease:Etiologies and therapeutic strat⁃egies[J].Life Sci,2019,218:165-184.
[16]杨宏霞,赵琳琳,石书贤,等.帕金森病免疫损伤机制研究[J].自然杂志,2024,46(6):461-465.
[17]ZENG J,LIAO Z,YANG H,et al.T cell infiltration me⁃diates neurodegeneration and cognitive decline in Al⁃zheimer's disease[J].Neurobiol Dis,2024,193:106461.










