基于病理指标探讨 AHSG/TLE1 轴介导 PD-L1 促进肺腺癌免疫逃逸的机制论文
2025-11-20 17:48:06 来源: 作者:xuling
摘要:探究AHSG/TLE1/PD-L1轴对肺腺癌细胞免疫逃逸的机制。方法利用癌症基因组图谱(the can⁃cer genome atlas,TCGA)数据库和细胞实验分析a2-HS糖蛋白(alpha2-heremans-schmid glycoprotein,AHSG)在肺腺癌中表达趋势,并分析AHSG对靶分子TLE1表达影响。
[摘要]目的探究AHSG/TLE1/PD-L1轴对肺腺癌细胞免疫逃逸的机制。方法利用癌症基因组图谱(the can⁃cer genome atlas,TCGA)数据库和细胞实验分析a2-HS糖蛋白(alpha2-heremans-schmid glycoprotein,AHSG)在肺腺癌中表达趋势,并分析AHSG对靶分子TLE1表达影响。利用CCK8、Transwell、酶联免疫吸附试验(ELISA)及T细胞毒性实验,检测HSG/TLE1对肺腺癌细胞增殖、迁移、免疫微环境调控及免疫逃逸的影响。使用纳武利尤单抗(程序性死亡配体1抑制剂,PD-L1抑制剂)并结合CCK8、Transwell、ELISA及T细胞毒性实验,探究AHSG/TLE1/PD-L1轴对肺腺癌细胞免疫微环境及免疫逃逸作用。结果肺腺癌患者(n=515)的AHSG、TLE1水平高于健康体检者(n=59),并且AHSG高表达的128例患者显示出早期生存率较低的现象。AHSG在A549中呈现高表达趋势,并且A549中高表达的AHSG可以正向调控同样在肺腺癌中高表达的TLE1。高表达的AHSG/TLE1促进了A549细胞增殖、侵袭及免疫因子分泌,降低了白细胞分化抗原簇8+(cluster of differentiation 8+,CD8+)T细胞百分率。高表达的AHSG具有较高的PD-L1 mRNA表达水平。在AHSG过表达的A549细胞中,敲低PD-L1恢复CD8+T细胞杀伤能力,并且敲低PD-L1也缓解了AHSG的过表达引发的炎症反应。结论AHSG/TLE1可通过调控PD-L1作用于肺腺癌细胞免疫逃逸。
[关键词]肺腺癌;程序性死亡配体1;免疫逃逸
肺腺癌(lung adenocarcinoma,LUAD)是全球第二常见的癌症,致死率高。尽管肺部疾病诊疗有所改进,但LUAD患者死亡率高、预后差。其发展过程复杂、涉及多步骤,可能与特定基因异常表达有关[1]。深入了解LUAD分子机制,可为肿瘤诊疗提供更精准的生物标志物。目前,LUAD治疗主要是手术切除、化疗、放疗和分子靶向治疗。但和其他癌症不同,肺癌总体生存率改善不明显,原因在于缺少有效治疗靶点。因此,亟待明确LUAD新分子机制和有效治疗靶点。随着药物研发提速,针对肺癌的药物治疗方案日益完善,涵盖化疗、分子靶向治疗和免疫治疗。在非小细胞肺癌临床治疗中,当前一线治疗适应症主要依据程序性细胞死亡配体1(programmed death-ligand 1,PD-L1)表达。PD-L1虽临床疗效显著,但耐药比例较高[2-3]。因此,需进一步探究如何在临床早期识别可能预测患者耐药的分子表型,深入剖析其分子机制,以更好地指导诊疗。α2-HS糖蛋白(alpha2-heremans-schmid gly⁃coprotein,AHSG)在多种肿瘤进展中发挥作用。既往研究显示,AHSG可促进乳腺癌进展及肺癌肿瘤发生,也能抑制肠道肿瘤进展[4-5]。AHSG异常表达与多种疾病肿瘤微环境改变相关[6],肿瘤微环境过度分泌的干扰素γ(interferon-gamma,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)等促炎细胞因子会诱导肿瘤细胞PD-L1表达,促使肿瘤细胞免疫逃逸。不过,AHSG在肺腺癌中与PD-L1的相互作用及机制尚不明晰,有待进一步探索。研究假设AHSG通过调控PD-L1影响肺腺癌细胞的免疫逃逸。通过检测AHSG在肺腺癌中的表达水平及其对免疫微环境和CD8+T细胞杀伤能力的影响,推测AHSG/TLE1/PD-L1轴在肺腺癌细胞免疫逃逸中的作用,旨在将AHSG作为肺腺癌临床诊疗的新指标和靶点。现报道如下。
1材料与方法
1.1细胞培养
人腺癌细胞系A549(CCL-185TM,ATCC)和正常人支气管上皮细胞系BEAS-2B(AC338205,ATCC)购自美国典型培养物保藏中心(ATCC,马纳萨斯,弗吉尼亚州,美国)。细胞培养在DMEM/F-12培养基(DMEM/F-12:11320033,Gibco,Thermo⁃Fisher Scientific)中培养。将细胞维持在37°C和5%CO2的潮湿环境中。培养细胞直至75%~100%的融合度时将细胞暴露于纳武利尤单抗(nivolumab,PD-L1抑制剂,16µg/mL,OPDIVO)处理48 h。
1.2细胞转染
A549和BEAS-2B以1×106个/孔细胞的密度接种于6孔板(Corning,Inc.,Corning,NY,USA),并在37°C下孵育24 h。将4µg特异性质粒OV-NC,si-NC,OV-AHSG,si-AHSG,OV-TLE1加入250µl无血清DMEM中并均匀混合,同时将10µl Lipo⁃fectamine 2 000加入另一份250µl无血清DMEM中,轻轻均匀混合后放置于室温下5 min。将质粒和Lipofectamine 2 000溶液均匀混合,并放置于室温下20 min。随后,将混合物转移到6孔板中,轻轻均匀混合后置于37°C下。经过6 h转染后,更换细胞培养液,并向每孔添加2 mL培养基。转染48 h后收集细胞用于后续实验。
1.3 CCK8实验
将培养的细胞系接种于5×103细胞/孔浓度的96孔板中。将96孔板放入培养箱中,在37℃、5%CO2培养一定时间,使细胞贴壁并生长。待细胞培养至所需时间后,向每孔中加入10µl CCK8试剂。轻轻混匀,避免产生气泡,然后继续放入培养箱中孵育2.5 h。用酶标仪在特定波长(450 nm)下测定各孔的吸光度值。
1.4酶联免疫吸附试验(ELISA)实验
通过ELISA检测IFN-γ、TNF-α、白细胞介素6(interleukin,IL-6)水平。所有试剂、标准稀释液、对照品和测试样品均恢复至室温进行准备。采用了定量夹心酶免疫测定技术。使用微孔板读数仪(In⁃finite F50,Tecan,奥地利)在450~570 nm波长下通过光学密度对反应进行定量测定。
1.5 Transwell实验
将细胞悬液转移至离心管中,并用无血清培养基重新悬浮细胞。调整细胞浓度至2×105/mL。在下室加入600µl含20%血清的培养基。在上室加入200µl细胞悬液(无血清)。将处理好的Tran⁃swell小室放入细胞培养箱中进行培养,培养结束后,清洗小室内的培养液。将小室的下表面浸泡在4%多聚甲醛溶液中,固定10 min。进行二次清洗后,使用10%结晶紫对细胞进行染色,时间约为5-10 min。用棉签将Transwell小室膜上层细胞(未穿透的细胞)擦拭干净。在载玻片上滴一小滴中性树胶。在显微镜下观察并记录小室下表面的细胞数量。在5个视野中取平均值作为实验结果。
1.6 qRT-PCR实验
使Trizol试剂提取总RNA。配制20µl的逆转录反应体系,处理获得cDNA。在CFXConnect Real-Time系统(qTOWER2.2,德国Analytik Jean公司)中进行qRT-PCR分析。目标基因相对表达采用2−ΔΔCt方法进行分析。β-actin作为内参基因。β-actin:正向引物:5’-AAGAAGGTGGTGAA-GCA-GGC-3’,反向引物:5’-TCCACCACCCTGTT-GCTGTA-3’;AHSG:正向引物:5’-TCCTTGGGGATACAAA-CACACC-3’,反向引物:5’-TACCACGGAAAAC-TTGCCATC-3’;TLE1:正向引物:5’-TCACCCTTCGGGA-CTTCAG-3’,反向引物:5’-GAGCACTAGACAGC-GCAAGAA-3’;PD-L1:正向引物:5’-TGGCATTTG-CTGAA-CGCATTT-3’,反向引物:5’-TGCAGCCA-GGTCT-AATTGTTTT-3’。
1.7统计方法
采用SPSS 29.0统计学软件处理数据,数据采用两因素重复测量方差分析进行处理。Tukey检验用于事后分析,以明确差异的具体位置。其他组别的数据则通过单因素方差分析进行解析。P<0.05为差异有统计学意义。
2结果
2.1肺腺癌细胞系中AHSG和TLE1表达分析
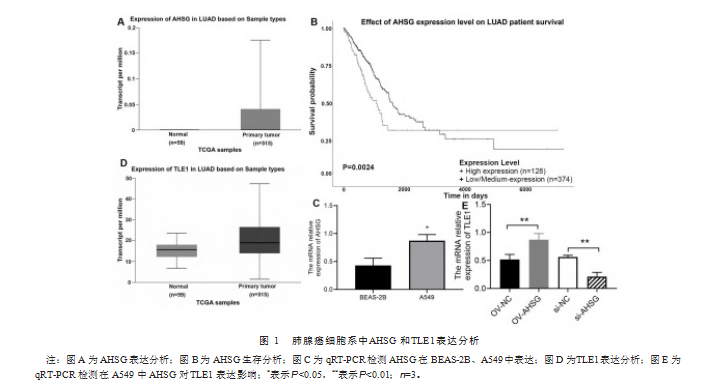
从癌症基因组图谱(the cancer genome atlas,TCGA)数据库(https://ualcan.path.uab.edu/)下载LUAD中AHSG、TLE1的表达谱。发现AHSG、TLE1在LUAD患者(515例)中较正常对照健康体检者(59例)表达量高(图1A、图1D)。此外,AHSG高表达的128例患者呈现出早期生存率较低的趋势(图1B)。与此同时利用qRT-PCR检测了AHSG在LUAD癌细胞系(A549)和正常人支气管上皮细胞系(BEAS-2B)中的表达,同样显示AHSG在A549中呈现高表达趋势(图1C)。此外,在A549细胞中高表达的AHSG能够正向调控同样在LUAD中高表达的TLE1(图1E)。提示LUAD中AHSG可能与TLE1相互作用影响肺腺癌预后。
2.2 AHSG/TLE1对肺腺癌细胞免疫微环境及免疫逃逸影响
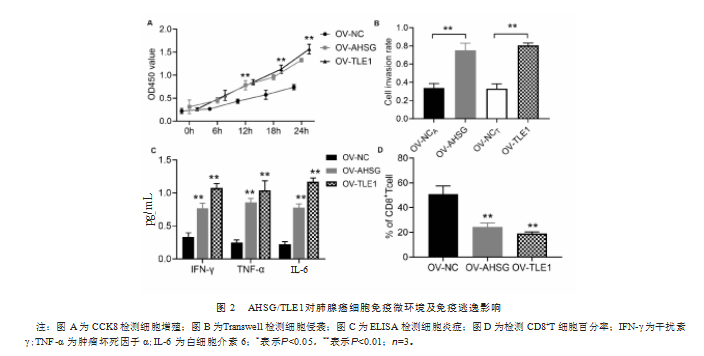
利用CCK8、Transwell、ELISA及T细胞毒性实验检测HSG/TLE1对肺腺癌细胞免疫微环境及免疫逃逸影响。结果显示,高表达的AHSG/TLE1显著促进了A549细胞的增殖(图2A)、侵袭(图2B)以及免疫因子(IFN-γ、TNF-α、IL-6)的分泌(图2C)。降低了白细胞分化抗原簇8+(cluster of differentiation 8+,CD8+)T细胞百分率(图2D)。提示高表达的AHSG/TLE1减弱了A549细胞免疫微环境,促进其免疫逃逸。
2.3 AHSG/TLE1轴在肺腺癌细胞中可靶向PD-L1并通过PD-L1影响肺腺癌细胞免疫微环境及免疫逃逸
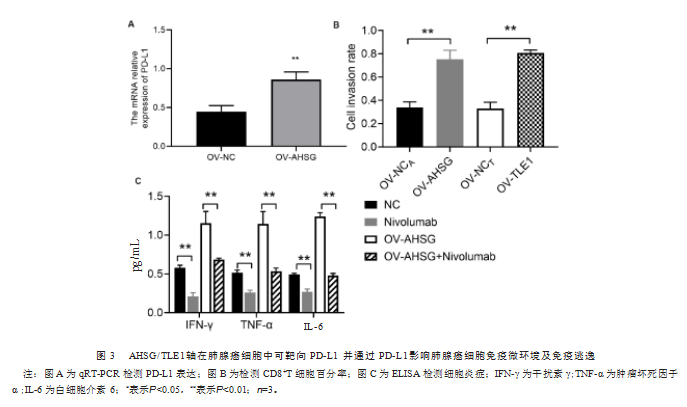
A549细胞中AHSG/TLE1可靶向调控PD-L1,高表达的AHSG具有较高的PD-L1 mRNA表达水平(图3A)。因此,可以合理推测AHSG通过影响LUAD中PD-L1的表达来介导CD8+T细胞功能障碍。在AHSG过表达的A549细胞中,通过敲低PD-L1,成功恢复了CD8+T细胞的杀伤能力,从而验证了这一假设(图3B)。此外,敲低PD-L1还缓解了由AHSG过表达引发的炎症反应(图3C)。
3讨论
根据统计数据,全球每年新诊断的肺癌患者超过200万,使其成为全球癌症相关死亡的主要原因。其中,超过85%的患者被归类为非小细胞肺癌(non-small cell lung carcinoma,NSCLC)。NSCLC患者的生存率并未显著提升,部分原因在于一部分NSCLC患者在中晚期才被诊断出来,而另一部分患者则发展为局部或全身性转移性疾病,导致预后较差,总体5年生存率低于20%[7]。除了手术和常规放化疗外,近年来免疫检查点抑制剂已成为治疗肺癌的新手段。针对程序性细胞死亡蛋白1(pro⁃grammed cell death protein 1,PD-1)和PD-L1的单克隆抗体已广泛应用于非小细胞肺癌的临床治疗,但由于肿瘤异质性和免疫微环境的复杂性,获益于免疫检查点抑制剂治疗的患者不足20%[8],并且还容易出现耐药和复发问题[9]。PD-L1蛋白在肿瘤进展过程中呈现动态变化,阳性染色率较低,免疫治疗受多种因素影响,这要求对PD-L1蛋白表达的调控机制进行深入研究,以提升PD-L1单药治疗的疗效[10]。
团队创新性地提出假说:AHSG和TLE1作为分子诊断指标,能够有效预测肺腺癌患者对PD-L1抑制剂的临床治疗效果。此外,AHSG和TLE1可能存在上下游调控关系,进而介导PD-L1的表达,促进免疫逃逸的发生,从而影响患者的治疗效果。为验证这一研究假说,通过回顾性临床研究,初步证实AHSG和TLE1在肺腺癌中作为病理分子诊断标志物,与PD-L1表达的相关性及其对PD-L1抑制剂临床治疗效果的预测价值。同时,通过建立细胞模型,开展细胞生物学和分子生物学研究,深入探讨AHSG/TLE1轴介导PD-L1促进肺腺癌免疫逃逸的具体机制。
AHSG及TLE1在肺腺癌中高表达并且可以正向调控TLE1。高表达的AHSG/TLE1促进了A549细胞增殖、侵袭及免疫因子(IFN-γ、TNF-α、IL-6)分泌。降低了CD8+T细胞百分率。研究表明,IL-6可通过JAK1途径在肝癌中诱导PD-L1的表达[11];肿瘤微环境中的表皮生长因子通过PI3K/AKT和JAK/STAT1途径促进PD-L1的表达[12],IFN-γ信号转导被认为会触发抗肿瘤活性,并且根据癌症情况具有促肿瘤作用。因此,IFN-γ可以在某些细胞环境中诱导细胞凋亡,而在其他细胞环境中,IFN-γ可以诱导PD-L1的表达,有利于它与活化T细胞上的受体PD-1的结合并抑制其细胞毒性作用[13]。本研究的结果与此一致,免疫微环境的加强减弱了PD-L1活性,从而促进了肺腺癌的免疫逃逸。PD-L1作为程序性细胞死亡受体,在肿瘤免疫系统中扮演着重要角色,使用PD-L1抑制剂可以减轻肿瘤免疫逃逸,进而控制肿瘤发展。而在A549细胞中AHSG/TLE1可正向靶向调控PD-L1的结果提示,高表达的AHSG/TLE1促进了炎症发生,减弱了PD-L1活性,从而促进了肺腺癌的免疫逃逸。纳武利尤单抗可以通过促进针对肿瘤的免疫反应的发展,增加T细胞的细胞毒性,来增强免疫细胞的抗肿瘤活性[14]。在AHSG过表达的A549细胞中,通过使用纳武利尤单抗恢复了CD8+T细胞杀伤能力。提示PD-L1的抑制可以缓解AHSG诱导的免疫逃逸。与以往的研究结果一致,正常情形下免疫系统会对聚集在淋巴结或脾脏的外来抗原产生反应,促发具抗原特异性的细胞毒杀性T细胞(CD8+T细胞增生)。而PD-1与PD-L1结合,可以传导抑制性的信号,减低淋巴结CD8+T细胞的增生,而且PD-1还可以借由调节Bcl-2基因,控制淋巴结中抗原特异性T细胞的聚积。阻断PD-1/PD-L1可以重新激活细胞毒性T细胞对肿瘤的杀伤作用[15]。
因此本研究可得出结论,PD-L1阻断可激活细胞毒性T细胞对肿瘤的杀伤作用,降低免疫逃逸,而过表达AHSG/TLE1可激活PD-L1,进而抑制T细胞对肿瘤的杀伤作用,促进免疫逃逸,而同时过表达AHSG/TLE1和阻断PD-L1,PD-L1的阻断无法彻底解除AHSG/TLE1对PD-L1的激活调控作用,因此可知,AHSG/TLE1可通过调控PD-L1作用于肺腺癌细胞免疫逃逸。这些发现为进一步开发AHSG/TLE1/PD-L1作为治疗肺腺癌的潜在靶点提供了重要的科学依据。
尽管研究揭示了AHSG/TLE1/PD-L1对肺腺癌细胞免疫逃逸的分子机制,但也存在一些局限性。本研究仅在体外细胞模型中进行了实验,缺乏体内动物模型的验证。AHSG/TLE1/PD-L1这一途径在体内是否同样有效尚需进一步研究。其次,虽然AHSG/TLE1通过PD-L1发挥了保护作用,但其具体的分子机制仍需更深入的研究,以明确其作用靶点和信号传导途径。本研究中使用的细胞系A549虽然广泛应用于肺腺癌研究,但仍不能完全代表体内肺腺癌发生的真实情况,未来的研究还需要在原代细胞或更接近生理状态的模型中进一步验证。
[参考文献]
[1]张赛群,张汇玲,陈宜利,等.EPHA10促进肺腺癌H1975奥希替尼耐药细胞增殖、耐药和迁移的实验研究[J].临床肺科杂志,2024,29(11):1706-1711.
[2]刘晓庆,王春楼,张晓玲,等.miR-34a阻断Wnt/β-catenin信号通路下调PD-L1表达抑制肺腺癌细胞的生长和转移[J].现代肿瘤医学,2024,32(16):2959-2968.
[3]ATTALLA S,TAIFOUR T,BUI T,et al.Insights from transgenic mouse models of PyMT-induced breast can⁃cer:Recapitulating human breast cancer progression in vivo[J].Oncogene,2021,40(3):475-491.
[4]XIE G,ZHANG Y,MA J,et al.Exosomal AHSG in ovar⁃ian cancer ascites inhibits malignant progression of ovar⁃ian cancer by p53/FAK/Src signaling[J].Transl Cancer Res,2024,13(10):5365-5380.
[5]ILLES Z,JØRGENSEN MM,BÆK R,et al.New enhanc⁃ing MRI lesions associate with IL-17,neutrophil de⁃granulation and integrin microparticles:Multi-omics combined with frequent MRI in multiple sclerosis[J].Bio⁃medicines,2023,11(12):3170.
[6]YAMASANDHI PG,DHARMALINGAM M,BALEKUD-URU A.Fetuin-A in newly detected type 2 diabetes mel⁃litus as a marker of non-alcoholic fatty liver disease[J].Indian J Gastroenterol,2021,40(6):556-562.
[7]SIEGEL RL,MILLER KD,FUCHS HE,et al.Cancer sta⁃tistics[J].CA Cancer J Clin,2021,71(1):7-33.
[8]KOVÁCS SA,GYŐRFFY B.Transcriptomic datasets of cancer patients treated with immune-checkpoint inhibi⁃tors:A systematic review[J].J Transl Med,2022,20(1):249.
[9]CARLISLE JW,RAMALINGAM SS.An update on the immune landscape in lung and head and neck cancers[J].CA Cancer J Clin,2020,70(6):505-517.
[10]REN D,HUA Y,YU B,et al.Predictive biomarkers and mechanisms underlying resistance to PD1/PD-L1 blockade cancer immunotherapy[J].Mol Cancer,2020,19(1):31.
[11]CHAN LC,LI CW,XIA W,et al.IL-6/JAK1 pathway drives PD-L1 Y112 phosphorylation to promote cancer immune evasion[J].J Clin Invest,2019,129(8):3324-3338.
[12]FU S,LI J,YOU J,et al.Baicalin attenuates PD-1/PD-L1 axis-induced immunosuppression in piglets chal⁃lenged with Glaesserella parasuis by inhibiting the PI3K/Akt/mTOR and RAS/MEK/ERK signalling path⁃ways[J].Vet Res,2024,55(1):127.
[13]GAO Y,YANG J,CAI Y,et al.IFN-γ-mediated inhi⁃bition of lung cancer correlates with PD-L1 expression and is regulated by PI3K-AKT signaling[J].Int J Can⁃cer,2018,143(4):931-943.
[14]WANG Z,WU X.Study and analysis of antitumor resis⁃tance mechanism of PD1/PD-L1 immune checkpoint blocker[J].Cancer Med,2020,9(21):8086-8121.
[15]HUANG Q,WU X,WANG Z,et al.The primordial dif⁃ferentiation of tumor-specific memory CD8+T cells as bona fide responders to PD-1/PD-L1 blockade in drain⁃ing lymph nodes[J].Cell,2022,185(22):4049-4066.e25.










