新辅助化疗对非小细胞肺癌患者肿瘤标志物与细胞凋亡相关因子的影响论文
2025-11-20 09:39:26 来源: 作者:xuling
摘要:对非小细胞肺癌患者予新辅助化疗,可提高患者治疗效果,能降低肿瘤标志物水平,促使癌细胞凋亡。
[摘要]目的探讨新辅助化疗对非小细胞肺癌患者肿瘤标志物与细胞凋亡相关因子的影响。方法方便选取2021年1月—2023年12月内蒙古包钢医院诊治的150例非小细胞肺癌者为研究对象。根据不同治疗方式分组。对照组(n=75)予手术治疗,观察组(n=75)在术前予新辅助化疗。比较两组临床疗效、肿瘤标志物、细胞凋亡相关因子。结果观察组总有效率为80.00%(60/75),高于对照组的62.67%(47/75),差异有统计学意义(χ2=5.510,P<0.05)。治疗后,观察组肿瘤标志水平均低于对照组,差异均有统计学意义(P均<0.05)。治疗后,观察组细胞凋亡相关因子均优于对照组,差异均有统计学意义(P均<0.05)。结论对非小细胞肺癌患者予新辅助化疗,可提高患者治疗效果,能降低肿瘤标志物水平,促使癌细胞凋亡。
[关键词]非小细胞肺癌;新辅助化疗;肿瘤标志物;细胞凋亡相关因子
非小细胞肺癌是肺癌的主要病理类型,约占全部肺癌病例的80%以上[1]。目前,外科手术仍是非小细胞肺癌患者的首选治疗方式,但由于该病早期临床症状不典型,多数患者确诊时已进展至中晚期,导致单纯手术治疗效果欠佳。值得注意的是,即便是早期确诊并接受手术治疗的患者,术后仍面临较高的复发风险[2-3]。新辅助化疗作为一种术前全身性治疗手段,可通过缩小原发灶体积、降低肿瘤分期来提高手术切除率,同时有助于减少术后复发转移风险[4]。基于此,本研究探讨了新辅助化疗对非小细胞肺癌患者的治疗价值,现报道如下。
1资料与方法
1.1一般资料
方便选取2021年1月—2023年12月内蒙古包钢医院诊治的150例非小细胞肺癌者为研究对象。根据不同治疗方式分组。对照组(n=75)予手术治疗,观察组(n=75)在术前予新辅助化疗。对照组年龄28~71岁,平均(48.69±4.56)岁;病灶位置:左侧45例、右侧30例;病理分型:鳞癌24例、腺癌51例;病理分期:Ⅱa期16例、Ⅱb期19例、Ⅲ期40例。观察组中年龄27~72岁,平均(48.92±4.75)岁;病灶位置:左侧43例、右侧32例;病理分型:鳞癌23例、腺癌52例;病理分期:Ⅱa期15例、Ⅱb期18例、Ⅲ期42例。两组患者一般资料对比,差异均无统计学意义(P均>0.05),具有可比性。本研究经内蒙古包钢医院伦理委员会审核批准[2024(067)号]。
1.2纳入与排除标准
纳入标准:确诊为非小细胞肺癌[5];择期行手术治疗;预计生存周期>6个月;认知正常;临床资料完整;患者及家属对本研究均知情同意。
排除标准:参与其他临床试验者;化疗药物过敏者;其余原发性癌症者;伴有肝肾严重损伤者;患有凝血、免疫等系统疾病者;患有精神疾病者;中途退出研究者。
1.3治疗方法
对照组手术治疗,患者取侧卧位,患侧朝上,术野消毒铺巾,全身麻醉后于腋中线第7或第8肋间作观察孔,置入胸腔镜镜头,探查胸腔,分离胸膜粘连,明确肿瘤位置、侵犯范围及淋巴结状态;再根据肿瘤位置选择腋前线第4或第5肋间作操作孔,置入手术器械后依次游离并结扎肺动静脉分支、游离肺叶支气管,完整切除受累肺叶,术中需确保切缘阴性,必要时送快速冰冻病理,电凝止血后采用生理盐水冲洗胸腔,确认无活动性出血及漏气,最后放置胸腔引流管并逐层缝合肌肉、皮下组织及皮肤。
观察组术前予新辅助化疗,采用多西他赛(国药准字H20193016;规格:1 mL∶20 mg)75 mg/m2溶于0.9%氯化钠溶液250 mL静滴,5 d为1个疗程;用药30 min后采用顺铂(国药准字H20023236;规格:20 mg)25 mg/m2静滴,每个疗程1~3 d。4个疗程结束后30 d开展手术治疗,步骤同对照组。
1.4观察指标
两组临床疗效比较。均在治疗后6个月参照实体瘤疗效判定标准[6]。病灶全部消失即完全缓解;病灶体积缩小≥50%为部分缓解;肿块体积缩小20%~<50%即稳定;肿块体积缩小<20%或增加或有肿块为进展。总有效率=完全缓解率+部分缓解率。
两组肿瘤标志物比较。在治疗前后进行采血,采用化学发光法检测癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)以及细胞角质蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)。
两组细胞凋亡相关因子比较。治疗前后采血,予酶法检测凋亡因子B淋巴细胞瘤基因-2(apop⁃totic factor B lymphocytoma gene-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、可溶性凋亡相关因子(soluble apoptosis-related factors,sFas)、可溶性Fas配体(soluble fas ligand,sFasL)。
1.5统计方法
采用SPSS 26.0统计学软件处理数据,肿瘤标志物及细胞凋亡相关因子均为计量资料数据,经Shapiro-Wilk检验符合正态分布,以(±s)表示,组间比较行两独立样本t检验,组内比较行配对样本t检验;临床疗效为计数资料,以例数(n)和率(%)表示,组间比较行χ2检验。P<0.05为差异有统计学意义。
2结果
2.1两组患者临床疗效比较
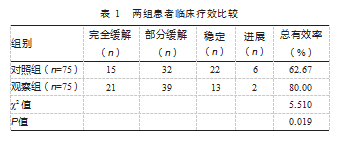
观察组总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2两组患者肿瘤标志物比较
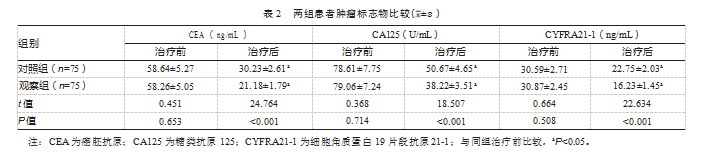
治疗前,两组肿瘤标记物水平比较,差异均无统计学意义(P均>0.05);治疗后,两组肿瘤标志物水平均降低,且观察组肿瘤标志水平均低于对照组,差异均有统计学意义(P均<0.05)。见表2。
2.3两组患者细胞凋亡相关因子比较
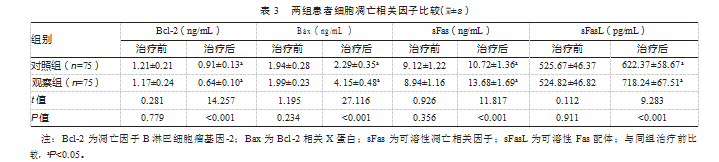
治疗前,两组细胞凋亡相关因子比较,差异均无统计学意义(P均>0.05);治疗后,两组Bcl-2均降低,观察组更低;Bax、sFas、sFasL两组均升高,观察组更高,差异均有统计学意义(P均<0.05)。见表3。
3讨论
非小细胞肺癌的病因不明确,研究发现可能与吸烟、遗传和基因突变、职业致癌因素、饮食和营养等有关[7]。本病恶性程度较高,且早期患者症状不明显,多数患者确诊时已经错过手术最佳时机,患者预后生存质量较差,加之患者术后标准化疗等治疗效果不理想,容易引起不良反应与耐药性,肿瘤转移、复发等风险均较高[8]。新辅助化疗为术前运用化疗方式,旨在缩小肿瘤体积,清除或减少微转移灶,从而使手术更加有效或可行[9]。本研究中,观察组术前予新辅助化疗后,总有效率较对照组高(P<0.05),说明该方案能有效提高患者治疗效果,主要考虑为对于局部晚期非小细胞肺癌,术前化疗可缩小病灶体积,增加切除成功率;同时新辅助化疗还可使肿瘤分期下降,从而降低患者术后复发风险,提升生存率[10]。白山等[11]研究中,试验组患者术前联合新辅助化疗的总有效率明显高于单独手术的对照组(P<0.05),佐证了本研究结论。
血清肿瘤标志物是一些在肿瘤细胞中异常表达或产生的物质,它们可以在血液中检测到,并用于辅助诊断、监测治疗效果和评估预后。CEA、CA125、CYFRA21-1均是本病的重要肿瘤标志物,对患者病情、疗效、预后等评估均有重要意义[12]。本研究中,治疗后观察组上述标记物水平均低于对照组(P均<0.05),说明新辅助化疗能显著降低患者肿瘤标志物水平。原因考虑为,新辅助化疗可减轻病灶负荷,包括原发肿瘤和潜在的微小转移灶,因此可以导致血清肿瘤标志物水平下降;同时术前化疗还可导致癌细胞死亡,减少肿瘤标志物的释放。此外,新辅助化疗可改变肿瘤微环境,影响肿瘤细胞的代谢,从而降低肿瘤标志物的产生。李国强等[13]的研究中,观察组采用新辅助化疗后肿瘤标志物水平均较对照组低(P均<0.05),与本研究一致。
细胞凋亡为细胞程序性死亡的形式之一,在癌症中细胞凋亡的失衡可导致肿瘤的生长和扩散。本研究中,治疗后观察组细胞凋亡因子水平均优于对照组(P均<0.05),则可见新辅助化疗促进肿瘤细胞的凋亡。考虑原因为,新辅助化疗可增加促凋亡蛋白(如Bax)的表达来促进肿瘤细胞的凋亡;同时新辅助化疗可减少肿瘤细胞数目,降低抗凋亡蛋白的表达,使得促凋亡蛋白的作用更加明显,从而为手术切除创造更有利的条件,并可提高治疗效果[14]。林洪盛等[15]的研究中,试验组术前予新辅助化疗后,患者细胞凋亡相关因子水平均优于对照组(P均<0.05),佐证了本研究的结论。
综上所述,新辅助化疗在非小细胞肺癌应用中效果确切,能降低肿瘤标志物水平,加快癌细胞凋亡,值得借鉴。
[参考文献]
[1]李益行,赵恒,刘博豪,等.帕博利珠单抗联合新辅助化疗治疗非小细胞肺癌的近期疗效和安全性[J].中国胸心血管外科临床杂志,2023,30(3):369-374.
[2]陈民彪,黎亮,廖绪强,等.贝伐珠单抗联合培美曲塞加卡铂新辅助化疗对老年非小细胞肺癌患者免疫和认知功能的影响[J].大医生,2022,7(11):26-29.
[3]李正龙,冉兴强,赵永生,等.新辅助免疫治疗联合化疗对局部晚期非小细胞肺癌的安全性及疗效[J].现代医学,2023,51(10):1458-1464.
[4]刘哲,程亮亮,于显凤.术前GP新辅助化疗对局部晚期非小细胞肺癌手术患者预后的影响[J].解放军医药杂志,2019,31(6):25-28.
[5]仲佳.《CSCO非小细胞肺癌诊疗指南2021》更新要点解读[J].实用肿瘤杂志,2022,37(1):8-15.
[6]邹金标,辛娣,曲宝迪,等.术前新辅助化疗联合完全胸腔镜手术治疗晚期非小细胞肺癌临床疗效评价[J].中国药业,2020,29(S2):27-28.
[7]孙凤环,杨洁,葛韬,等.新辅助抗PD-1免疫治疗联合化疗后手术治疗ⅢA期非小细胞肺癌临床分析[J].中华胸心血管外科杂志,2021,37(9):516-520.
[8]李海天,刘晴,李斌,等.新辅助PD-1/PD-L1抑制剂联合化疗治疗可切除非小细胞肺癌有效性和安全性单组率的系统评价与Meta分析[J].中国胸心血管外科临床杂志,2024,31(8):1198-1205.
[9]康晓征,闫万璞,陈克能,等.厄洛替尼与标准一线化疗作为新辅助治疗ⅢA-N2期EGFR突变阳性非小细胞肺癌患者的疗效比较[J].循证医学,2019,19(1):30-33.
[10]张旭宇,李冬雷,马少林.新辅助化疗治疗晚期非小细胞肺癌的临床研究[J/CD].中西医结合心血管病电子杂志,2020,8(35):61,77.
[11]白山,王永强,耿勇,等.术前新辅助化疗联合外科手术治疗非小细胞肺癌的临床效果[J].临床医学研究与实践,2020,5(29):23-25.
[12]何显阳,刘方文,黄云英,等.多西他赛联合顺铂新辅助化疗对非小细胞肺癌治疗中相关肿瘤标记物的影响[J].医学信息,2021,34(23):165-167.
[13]李国强,席孝忠,陈洋.吉西他滨和顺铂新辅化疗联合手术治疗非小细胞肺癌的临床观察[J].实用癌症杂志,2023,38(9):1533-1535.
[14]刘雨桃,高禹舜,毛友生,等.程序性细胞死亡蛋白1单抗联合化疗在Ⅱ期和Ⅲ期非小细胞肺癌术前新辅助治疗中的疗效和安全性[J].中华肿瘤杂志,2020,42(6):480-485.
[15]林洪盛,刘利敏,鲁秋香,等.新辅助化疗对非小细胞肺癌患者肿瘤标志物与细胞凋亡相关因子的影响[J].中国医学创新,2023,20(3):45-49.










