术中冰冻及快速免疫组化检测应用于乳腺癌前哨淋巴结转移诊断中的准确性评价论文
2025-11-15 14:28:06 来源: 作者:xuling
摘要:术中冰冻检测在乳腺癌前哨淋巴结转移的诊断上,其效能相比快速免疫组化检测有所不足。快速免疫组化检测在乳腺癌前哨淋巴结转移诊断方面展现出较高的敏感度、准确度,可作为有效的辅助诊断工具。
[摘要]目的分析术中冰冻及快速免疫组化检测对乳腺癌前哨淋巴结转移的诊断价值。方法方便选取2022年6月—2024年6月粤北人民医院收治的150例乳腺癌疑似前哨淋巴结转移患者为研究对象,均接受术中冰冻及快速免疫组化检测,并将术后的石蜡切片诊断作为本研究的诊断金标准,分析术中冰冻及快速免疫组化检测的诊断效能。结果快速免疫组化检测的敏感度为98.62%(143/145),准确度为98.00%(147/150),高于术中冰冻的87.59%(127/145)、86.00%(129/150),差异均有统计学意义(χ2=13.748,14.674;P均<0.05)。快速免疫组化检测的特异度虽高于术中冰冻结果,但差异无统计学意义(P>0.05)。结论术中冰冻检测在乳腺癌前哨淋巴结转移的诊断上,其效能相比快速免疫组化检测有所不足。快速免疫组化检测在乳腺癌前哨淋巴结转移诊断方面展现出较高的敏感度、准确度,可作为有效的辅助诊断工具。
[关键词]术中冰冻;快速免疫组化检测;乳腺癌前哨淋巴结转移
乳腺癌是女性中常见的一种恶性肿瘤,其发病率在全球范围内呈现出持续上升的趋势。乳腺癌的转移通常首先发生在前哨淋巴结,因此,前哨淋巴结的状态对于评估乳腺癌的治疗效果和预测患者的预后情况具有至关重要的意义[1-2]。准确地评估乳腺癌前哨淋巴结转移的状态对于制定治疗方案和预测疾病进程来说是不可或缺的[3-4]。在以往,临床主要依赖于术后石蜡切片病理检查来诊断乳腺癌前哨淋巴结转移,然而,这种方法存在诊断周期较长、患者需要等待较长时间的缺点。为了缩短诊断时间并提高诊断效率,术中冰冻切片和快速免疫组化检测技术应用于乳腺癌前哨淋巴结转移的诊断过程中[5-6]。这两种技术能够在手术进行中迅速提供病理结果,从而帮助医生及时调整治疗策略和制定更为精确的治疗计划。但是术中冰冻和快速免疫组化检测在诊断乳腺癌前哨淋巴结转移方面的准确性和可靠性仍然存在一定的争议和讨论[7]。本文对此方面展开了进一步研究,现报道如下。
1资料与方法
1.1一般资料
方便选取2022年6月—2024年6月粤北人民医院收治的150例乳腺癌疑似前哨淋巴结转移患者为研究对象。患者年龄31~92岁,平均(60.45±5.13)岁。术后常规石蜡诊断前哨淋巴结情况,其中有1枚转移的有128例,有2枚转移的有11例,有3枚转移的有6例。本研究经粤北人民医院伦理委员会批准通过(KY-2022-142)。患者及家属均知情同意本研究。
1.2纳入与排除标准
纳入标准:符合规范乳腺MRI检查适应证、检查技术和诊断要求[8];均为女性,有正常的理解和交流能力;术前无放疗史。排除标准:其他器官或全身有恶性病变者;患有严重的血液病者;患有严重基础疾病或系统性传染病者;临床数据缺失者。
1.3检测方法
患者均接受术中冰冻及快速免疫组化检测。
术中冰冻切片HE染色:在赛默飞NX50冷冻切片机上对样本中的前哨淋巴结进行制片,制得3张厚度为5µm的切片。其中2张切片在95%酒精中固定30 s,使用苏木精-伊红(hematoxylin-eosin staining,HE)染色剂进行标准的HE染色,在显微镜下观察细胞和组织的形态结构,进行病理诊断。
快速免疫组化染色:利用贵州美鑫达医疗技术有限企业生产的细胞角蛋白抗体试剂,对冰冻切片执行染色程序。操作流程如下:先将试剂置于室温,确保其温度适宜,再充分摇匀,预备后续使用。后对切片进行固定,再用磷酸盐缓冲液冲洗,去除多余的固定液。放入美鑫达(Q-STAINX)自动免疫组化染色机进行,10 min后完成快速免疫组织化学染色,便能在显微镜下观察细胞角蛋白CK-pan的表达情况。
术后石蜡切片HE染色及免疫组织化学(immu⁃nohistochemistry,IHC)染色:对剩余的以及手术后取得的组织样本执行处理流程。这些流程涉及将组织样本用甲醛溶液进行固定,后用酒精和二甲苯进行脱水,再将组织样本嵌入石蜡中。嵌入后的组织块会被切成5µm厚度的切片。对切片先进行HE染色观察细胞和组织结构;在执行IHC染色时,使用中杉金桥企业提供的试剂盒,选用迈新生物企业提供的anti-CK抗体,以特异性地识别细胞角蛋白(cytokeratin,CK),精确地定位和分析CK在组织切片中的表达情况。
1.4观察指标
将术后的石蜡切片诊断作为本研究的诊断金标准,以此分析术中冰冻及快速免疫组化检测的诊断效能。由两位经验丰富的病理医生,依据临床资料,对病理切片进行深入的检查,并给出诊断结论。
阳性判断标准:术中冰冻检测:通过观察HE染色切片中细胞和组织的形态结构,若出现符合乳腺癌转移特征的细胞形态变化,如细胞核增大、深染、核浆比例失调等,则判定为乳腺癌前哨淋巴结转移阳性。快速免疫组化检测:若在转移淋巴结细胞的胞质中观察到棕黄色颗粒,则判定为阳性;反之,若未发现棕黄色颗粒,则视为阴性。采用磷酸盐缓冲液代替一抗作为阴性对照,排除非特异性染色的可能。术后常规石蜡诊断:结合HE染色观察到的细胞和组织结构变化,以及IHC染色中在转移淋巴结细胞胞质中观察到的棕黄色颗粒,若两者均符合阳性特征,则判定为乳腺癌前哨淋巴结转移阳性。
1.5统计方法
采用SPSS 20.0统计学软件处理数据,检测结果、诊断效能为计数资料以例数(n)和率(%)表示,组间比较行χ2检验。P<0.05为差异有统计学意义。
2结果
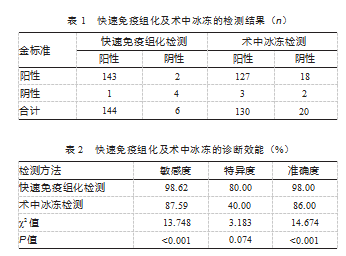
快速免疫组化检测的敏感度和准确度高于术中冰冻检测,差异均有统计学意义(P均<0.05)。快速免疫组化检测的特异度虽高于术中冰冻结果,但差异无统计学意义(P>0.05)。见表1、表2。
3讨论
在临床医学领域,冰冻切片技术被广泛运用,它能快速提供外科手术中的病理诊断,对医生作出手术决策极为有益。但是该技术在应用时面临局限,尤其是取材限制和切片厚度问题,导致误诊率和假阴性率较高。特别是在处理乳腺组织时,误诊问题尤为显著[9-10]。对于乳腺癌手术,前哨淋巴结的准确诊断至关重要,因为它影响手术计划和治疗效果。然而,冰冻切片技术的诊断准确率不足,这无疑提升了患者二次手术的可能性。为了提升诊断准确性,减少假阴性,研究人员和医生正在寻求新方法[11-12]。鉴于冰冻切片样本新鲜且未受损,免疫组化染色成为一种尝试。此法不仅节省时间,还能提高诊断效率和准确性,为患者带来更安全有效的治疗方案。
由于其独特优势,快速冰冻切片染色技术在临床领域具有显著的推广潜力。该技术的核心优势在于它能迅速处理未经处理的组织样本,且在固定阶段所需时间极短[13-14]。采用快速免疫组织化学染色和术中冰冻切片法诊断的敏感度分别为98.62%(143/145)和87.59%(127/145)。这提示,采用快速免疫组织化学方法可以更准确地检出肿瘤周围淋巴结转移,较术中冰冻检查具有更小的漏诊率。采用快速免疫组织化学法和冷冻切片法的特异度分别为80.00%(4/5)和40.00%(2/5)。可见,对于无明显肿瘤浸润淋巴结转移的患者,其诊断特异度较高,而术中冰冻标本易产生假阳性。其中,快速组织化学染色和冰冻切片法的准确度分别为98.00%(147/150)和86.00%(129/150)。与手术病理检查相比,采用快速免疫组织化学方法能更准确地作出全面的诊断。应用免疫组织化学技术对乳腺癌患者的淋巴结转移的早期诊断价值明显高于术中的穿刺活检的诊断价值。该技术在鉴别阳性病例和阴性病例、提高总体确诊率方面都有显著优势,有望成为更为准确的术中辅助判断手段,对于指导乳腺癌患者的诊治有着十分重大的现实意义。
术中冰冻检测作为一种传统的病理诊断手段,在乳腺癌前哨淋巴结转移的诊断中,确实能够发挥一定的作用,尤其是在快速获取初步诊断结果方面,具有一定的优势[15-18]。然而,随着医疗技术的不断进步,快速免疫组化检测以其更高的敏感度和准确度,逐渐展现出其在乳腺癌前哨淋巴结转移诊断中的巨大潜力。这种检测方法能够更为精确地识别淋巴结的状态。快速免疫组化检测诊断乳腺癌前哨淋的特异度高于快速免疫组化检测,但数据对比,差异无统计学意义(P>0.05)。数据表明,快速免疫组化检测在诊断乳腺癌前哨淋巴结转移时具有较高的特异度。这代表着快速免疫组化检测不仅能够准确识别出真正的阳性病例(即真正存在转移的前哨淋巴结),还能有效排除阴性病例(即未发生转移的前哨淋巴结),从而减少了误诊和漏诊的情况。另外,快速免疫组化检测的高特异度也反映了其在鉴别淋巴结状态方面的精确性,为临床决策提供了更为可靠的依据,结果进一步强化了快速免疫组化检测在乳腺癌前哨淋巴结转移诊断中的可靠性和实用性。
综上所述,术中冰冻检测在乳腺癌前哨淋巴结转移的诊断上,其效能相比快速免疫组化检测有所不足。快速免疫组化检测在乳腺癌前哨淋巴结转移诊断方面展现出较高的敏感度、特异度和准确度,能提供更丰富的病理信息,具有更高的实用价值,可作为有效的辅助诊断工具。
[参考文献]
[1]LIU M,WANG W,WANG Y.The diagnostic perfor⁃mance of the one-step nucleic acid amplification assay for the detection of sentinel lymph node metastases in cy⁃tokeratin 19-positive breast cancer:A PRISMA-compliant meta-analysis[J].Frontiers in Medicine,2024,11:1391621.
[2]王文琴,刘倩,陈万峰.乳腺癌患者前哨淋巴结超声学表现及超声引导下穿刺活检对其转移的诊断效能[J].转化医学杂志,2024,13(10):1593-1596.
[3]钟晓玲,余小琴.超声影像及免疫组化对乳腺癌新辅助化疗患者腋窝淋巴结状态的临床价值分析[J].影像研究与医学应用,2024,8(24):129-131,134.
[4]ZHENG J,XU F,LI G,et al.The value of chromosome instability detected by low−pass whole−genome sequenc⁃ing in preoperative prediction of sentinel lymph node me⁃tastasis in breast cancer[J].Frontiers in Oncology,2024,14:1434526.
[5]刘丽冰,贺荣芝,李春森,等.乳腺伴极性反转的高细胞癌1例[J].诊断病理学杂志,2025,32(1):100-102.
[6]张慧,李斌可,盛仲楠,等.实时弹性超声检查与乳腺癌免疫组化的相关性及联合预测预后的价值分析[J].医学影像学杂志,2024,34(10):161-164.
[7]吴义娟,吴仪萍,俞训彬,等.乳腺癌HER2状态、临床病理特征及预后分析[J].中国现代医药杂志,2024,26(10):19-25.
[8]刘佩芳,鲍润贤,王琦.规范乳腺MRI检查适应证、检查技术和诊断[C]//中华医学会中华放射学杂志编委会,中华医学会放射学分会胸组,山东省医学影像学研究所.第二届全国乳腺影像诊断与技术应用研讨会暨学习班论文汇编.天津:天津医科大学肿瘤医院放射科,2007:19-24.
[9]安林林,马芳,沈莉莉,等.乳腺癌超声征象与免疫组化指标表达关系的研究进展[J].中国临床研究,2024,37(10):1489-1493.
[10]姚秀娟,许建秋,周泉,等.PD-L1在三阴性乳腺癌中的表达及临床病理意义[J].浙江医学,2024,46(19):2089-2092,2098.
[11]张淑娟,穆尼热·穆合塔尔.cyclinE、p53、CD44s、CD44v6与早期乳腺癌的相关性及预后预测分析[J].中华养生保健,2024,42(19):51-54.
[12]朱峥艳,杨会杰.RB1及INSM1在乳腺实性乳头状癌中的表达及意义[J].河南医学研究,2024,33(18):3342-3345.
[13]张晓红,张晓丽,韦志永,等.免疫组化MYB和Notch1在乳腺腺样囊性癌中的应用[J].临床与实验病理学杂志,2024,40(9):942-947.
[14]黄艳,王玉环,丁丽红,等.TFE3重排肾细胞癌16例临床病理特征及预后分析[J].诊断病理学杂志,2024,31(8):732-736.
[15]洪艳玲.两种鸡尾酒双染法评估乳腺癌HER2表达的应用对比[J].诊断病理学杂志,2024,31(8):811-813.
[16]郑超,丁雨钦,王培恩,等.乳腺癌新辅助化疗前后分子分型和免疫组化变化与疗效的相关性研究[J].浙江创伤外科,2024,29(8):1511-1514.
[17]孙慧玲,王蕊,张祥,等.DCE-MRI和免疫组化特征对乳腺癌患者新辅助化疗反应早期预测价值[J].四川医学,2024,45(8):837-842.
[18]刘琳.多模态MRI对乳腺癌前哨淋巴结转移患者的评估价值探析[J].影像研究与医学应用,2024,8(21):64-66,69.










