血管剪切应力对冠状动脉粥样硬化斑块形成 、 分布及稳定性的影响论文
2025-10-30 17:18:09 来源: 作者:xuling
摘要:WSS对斑块的定位有显著影响,特别是在分叉部位,复杂的血流模式可能抑制低WSS相关的病理性变化。这些发现不仅验证了先前的研究结果,还为进一步探索WSS在动脉粥样硬化中的作用提供了新的思路和方向。
[摘要]目的探究血管剪切应力对冠状动脉粥样硬化斑块形成、分布及稳定性的影响。方法选取2024年4—12月于齐齐哈尔医学院附属第一医院中心实验室饲养的50只高脂饮食诱导的冠状动脉粥样硬化模型SD大鼠,随机分为两组:低壁面剪切应力(wallshear stress,WSS)组(n=25)接受分流支架植入联合肼苯哒嗪腹腔注射以建立低WSS模型;高WSS组(n=25)行冠状动脉狭窄环置入并持续泵注硝酸甘油以构建高WSS模型。比较不同WSS对冠状动脉血管的影响、不同WSS与病变位置和分叉的关系、不同WSS的面积变化。结果在高WSS组中,管腔面积显著缩小,而斑块面积、斑块负荷、纤维面积和纤维脂肪面积均有显著增加。低WSS主要出现在病变的远端区域,而高WSS则主要集中在病变的中心区域,且在分叉部位的多数节段并未观察到低WSS现象。经过一个月的喂养后,高WSS组的斑块面积、纤维组织面积以及纤维脂肪组织面积显著退化,同时致密钙化面积显著增加。结论高WSS促进了冠状动脉斑块的生长和纤维化,可能增强斑块的稳定性。WSS对斑块的定位有显著影响,特别是在分叉部位,复杂的血流模式可能抑制低WSS相关的病理性变化。这些发现不仅验证了先前的研究结果,还为进一步探索WSS在动脉粥样硬化中的作用提供了新的思路和方向。
[关键词]血管剪切应力;冠状动脉粥样硬化;斑块;分布;稳定性
动脉粥样硬化(atherosclerosis,AS)是严重威胁人类身体健康的疾病,其特征在于血管壁内脂质沉积、炎症反应、纤维组织增生,最终可能导致心肌梗死、中风等严重后果[1-3]。近年来,血流动力学因素,如壁面剪切应力(wall shear stress,WSS),在AS的发生、发展及病变稳定性中起到了关键作用[4]。WSS是指血液流动对血管内皮细胞施加的机械力,它能够影响内皮功能、平滑肌细胞行为、炎症介质表达及脂质代谢等多种生物学过程[5-7]。因此,理解不同水平的WSS如何调控AS斑块的形成、分布及其稳定性,对于揭示AS发病机制、预测病变进展及指导临床治疗具有重要意义。本研究旨在探讨不同WSS条件对大鼠冠状动脉粥样硬化斑块特性的影响,并分析WSS与斑块位置及分叉关系,以期为AS的预防和治疗提供新的视角。现报道如下。
1材料与方法
1.1实验动物
选取2024年4—12月于齐齐哈尔医学院附属第一医院中心实验室饲养的50只高脂饮食诱导的冠状动脉粥样硬化模型SD大鼠,随机分为两组:实验组(n=25)接受分流支架植入联合肼苯哒嗪腹腔注射以建立低WSS模型;对照组(n=25)行冠状动脉狭窄环置入并持续泵注硝酸甘油以构建高WSS模型。实验动物的喂养和护理遵循中国实验动物保护与伦理委员会的规定,并符合国家卫生研究院《实验动物伦理指南》,本文已经齐齐哈尔医学院附属第一医院实验动物伦理委员会批准通过(【2024】3号)。
1.2动物模型
对50只大鼠进行高脂饮食喂养(高脂饲料配方:2%胆固醇、10%猪油、0.2%丙基硫氧嘧啶、0.5%胆酸钠、87.3%基础饲料),并在腹腔内注射垂体后叶素(国药准字H51022069;规格:6 U/mL),剂量为0.1 U/kg,在10 s内完成注射,1次/d。采用尾压法监测大鼠血压,具体操作为将传感器套在大鼠尾部,通过充气、放气对尾动脉进行加压和释压,同时监测血流信号,以获取血压值,每日早、中、晚各测量一次,连续测量3 d。若平均收缩压>115 mmHg,即可判定造模成功。
将25只大鼠的腹主动脉植入分流支架(直径1.5 mm),并联合腹腔注射肼苯哒嗪(国药准字H20052428;规格:20 mg/mL),剂量为1 mg/(kg·d),以降低血流速度,目标WSS<10 dyn/cm2,归为低WSS组;剩余25只大鼠通过颈动脉外置可调式狭窄环(内径缩减30%),并结合尾静脉泵入硝酸甘油(国药准字H15020179;规格:5 mg/mL),剂量为0.5μg/(kg·min),以增加血流速度,目标WSS≥25 dyn/cm2,归为高WSS组。
1.3 WSS检测
使用血流探针(1或2 RB,Transonic Systems)连接至传输时间血管周围血流仪(T420,Transonic Sys⁃tems),测量冠脉内的血流量。通过数据采集系统(PowerLab/8sp system,ADInstruments,Castle Hill,NSW,Australia)记录血流速度。剪切应力采用Poi⁃seuille公式进行估算:τ=4ηQ/(πRi3),其中τ为WSS,η为血液黏度,Q为血液流速,Ri为内部半径。既往研究表明,Poiseuille公式适用于直径>0.1 mm的血管内流动。WSS是一个连续且动态的变量,为了本研究的目的,并结合之前的细胞培养、实验及人类数据,低WSS被定义为<10 dynes/cm2,高WSS被定义为≥25 dynes/cm2[8]。
1.4观察指标
进行大鼠冠状动脉血管内超声(intravascular ultrasound,IVUS)检查测量斑块相关指标,包括斑块面积、管腔面积、斑块负荷等,比较不同WSS对冠状动脉血管的影响、不同WSS与病变位置和分叉的关系、喂养1个月后不同WSS的面积变化。
1.5斑块面积测量
首先需对大鼠施行全身麻醉,并建立生命体征监测,包括心电图(electrocardiogram,ECG)、血压及血氧饱和度监控,以确保手术过程中的动物安全。整个过程中,所有操作均遵循严格的伦理指导原则,以最小化实验动物的痛苦和不适。
在无菌条件下,于股动脉或颈动脉处做一微小切口,利用显微外科技术引入导丝并建立血管通路。沿导丝推进IVUS导管至冠状动脉入口,该导管配备有高频率微型化换能器探头(直径通常为0.9~1.4 mm),能够适应大鼠的细小血管结构。通过操控IVUS系统,发射并接收超声波信号,实时获取冠状动脉内部结构的高分辨率断层图像,并将数据记录下来以供后续分析。成像结束后,撤回IVUS导管与导丝,采用压迫止血或可吸收缝线闭合切口,确保血管完整性。术后,将动物置于复苏环境中,直至其从麻醉状态完全恢复,同时密切监测其生理参数,防止并发症的发生。
斑块面积测量方法:通过IVUS图像,识别血管壁的内外膜边界,并将血管壁分为管腔和斑块两部分,手动测量斑块区域的面积。
管腔面积测量方法:通过IVUS图像识别管腔边界并直接测量管腔的横截面面积。
斑块负荷测量方法:测量斑块面积和管腔面积,而后通过下述公式进行计算:斑块负荷=斑块面积/(斑块面积+管腔面积)×100%。
1.6统计方法
采用SPSS 23.0统计学软件处理数据,经Shapiro-Wilk检验符合正态分布的计量资料数据,以(±s)表示,两组间比较行两独立样本t检验,多组间比较采用方差分析。若方差不齐,则改用秩和检验。P<0.05为差异有统计学意义。
2结果
2.1不同WSS对冠状动脉血管的影响
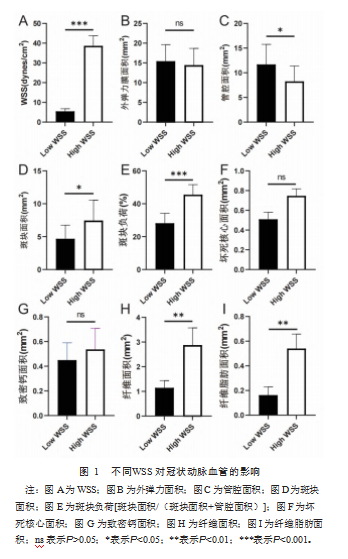
低WSS和高WSS组大鼠的WSS比较,差异有统计学意义(t=10.890,P<0.001),见图1A。高WSS组的管腔面积小于低WSS组,斑块面积、斑块负荷、纤维面积和纤维脂肪面积多于低WSS组,差异均有统计学意义(t=4.113,3.972,9.718,4.818;P=0.015,0.017,<0.001,0.009),见图1C、图1D、图1E、图1H、图1I。两组外弹力面积、坏死核心面积和致密钙面积比较,差异均无统计学意义(t=0.288,1.160,1.283;P=0.788,0.311,0.269),见图1B、见图1F、见图1G。
2.2不同WSS与病变位置和分叉的关系
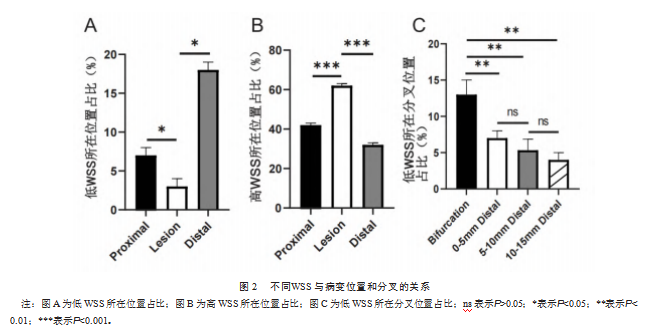
低WSS中病变远端占比(18%)高于病变近端(7%)或病变内(3%),差异有统计学意义(F=22.720,P<0.001),见图2A。高WSS中病变内占比(62%)高于病变近端(42%)或远端(32%),见图2B,即病变远端80%节段无低WSS,病变内38%节段无高WSS,差异有统计学意义(F=181.000,P<0.001)。此外,尽管低WSS节段的百分比从分叉内到分叉远端逐渐降低(分叉点占比13%,0~5 mm远端占比7%,5~10 mm远端占比5%,10~15 mm远端占比4%),但分叉内的大多数节段(86%)未表现出低WSS,差异有统计学意义(F=700.000,P<0.001),见图2C。
2.3不同WSS面积变化的不同
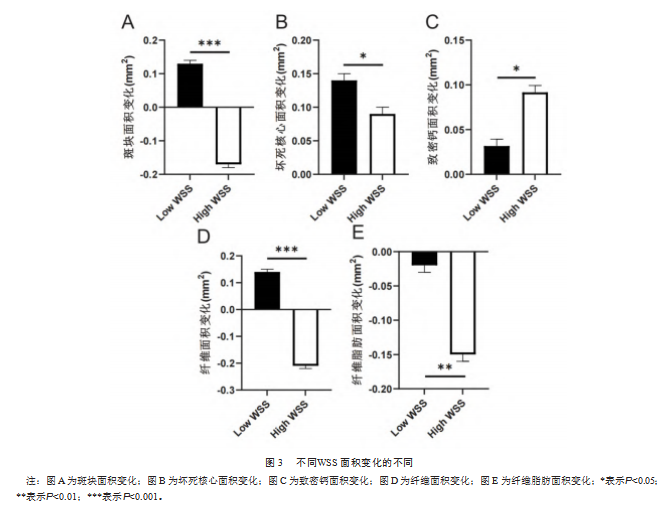
高WSS组斑块面积变化为0.13 mm2、纤维面积变化为0.13 mm2、纤维脂肪面积变化为0.02 mm2,均比低WSS组的-0.17、-0.21、-0.14 mm2退化更多,差异均有统计学意义(t=36.740,42.870,6.124;P均<0.05),见图3A、图3D、图3E。低WSS组的坏死核心面积变化程度为0.15 mm2,高于高WSS组0.08 mm2,差异有统计学意义(t=3.311,P=0.034),见图3B。高WSS组致密钙面积为0.091 mm2,比低WSS组0.030 mm2进展更多,差异有统计学意义(t=4.112,P=0.015),见图3C。
3讨论
本研究表明,在高WSS条件下,冠状动脉斑块表现出显著的形态学改变,包括管腔面积减小、斑块负荷增加以及纤维和纤维脂肪成分的增多,这些变化提示高WSS可能促进斑块的生长并影响其组成。值得注意的是,尽管高WSS促进了斑块纤维化,但并未观察到坏死核心或致密钙化区域的变化,这表明高WSS可能通过增强纤维帽的厚度来提高斑块的稳定性,从而降低破裂风险[9-10]。然而,过度的纤维化也可能限制了血管的弹性,增加了未来发生并发症的可能性[11]。
进一步分析发现,低WSS更多地出现在病变远端,而高WSS则倾向于集中在病变内部。这一现象与既往关于WSS空间分布对AS易感性影响的研究结果相吻合[12-13],即低WSS区域更易受到损伤和斑块形成的影响。此外,分叉部位的大多数节段未表现出低WSS,这可能是因为分叉处复杂的血流模式导致了局部WSS的升高,进而抑制了低WSS相关的病理性变化。上述结果强调了WSS在调控AS病变定位中的重要作用,并暗示了特定解剖结构如血管分叉可能是AS防治的重点关注区域。
经过1个月的喂养,本研究观察到高WSS组中斑块面积、纤维面积和纤维脂肪面积有明显的退化趋势,同时致密钙化面积有所增加。此现象表明,长期暴露于高WSS环境下,斑块可能会经历从软斑块向硬斑块的转化,这种转变可能增强了斑块的稳定性,但也可能伴随着血管硬度的增加和其他潜在的风险[14-16]。未来的研究应进一步探索高WSS诱导的斑块成分改变的具体机制,以及这些改变对整体心血管健康的影响。
尽管本研究提供了有关WSS对冠状动脉粥样硬化斑块特性影响的重要见解,但仍存在一些局限性。例如,实验动物模型的选择和饲养条件可能无法完全模拟人类AS的复杂性;另外,由于技术限制,仅能测量平均WSS值,而未能捕捉到瞬时波动或周期性变化所带来的效应。因此,未来的研究所需结合多模态成像技术和生物力学建模,深入解析WSS动态变化与AS进程之间的关系,为个性化医疗提供更加精准的理论支持。
综上所述,本研究揭示了WSS作为AS斑块形成、分布及稳定性的重要调节因子的作用,为理解该疾病的病理生理机制提供了新的证据。同时,也为开发基于血流动力学原理的新型诊断工具和治疗方法奠定了基础。
[参考文献]
[1]FAN J,WATAMNE T.Atherosclerosis:Known and un⁃known[J].Pathology International,2022,72(3):151-160.
[2]梁天,李飞,刘超.内皮细胞功能障碍与动脉粥样硬化的研究进展[J].中华老年心脑血管病杂志,2024,26(12):1504-1507.
[3]冯萌萌,卢洁.磁共振成像在颈动脉粥样硬化与脑小血管病相关性中的研究进展[J].中华老年心脑血管病杂志,2024,26(12):1515-1517.
[4]李淑妍,陶新宇,曲晨.血管壁面剪切应力对动脉粥样硬化和动脉瘤的影响[J].中国动脉硬化杂志,2024,32(5):451-455.
[5]潘霁超,蔡彦,李*勇.壁面剪切应力与微环境演化在斑块异质性形成中的作用研究[J].医用生物力学,2024,39(S1):361.
[6]OLIVE JG,AVILES J,CÓRDOVA MM,等.基于4D血流心脏MR成像自动评估主动脉旋转血流和壁面剪切应力的机器学习[J].国际医学放射学杂志,2022,45(6):747-748.
[7]滕碧云.基于曲率和壁面剪切应力分析腹主动脉瘤破裂危险因素的研究[D].重庆:重庆医科大学,2022.
[8]CHATZIZISIYS,BAKERAB,SUKHOVAGK,et al.Aug⁃mented expression and activity of extracellular matrix-degrading enzymes in regions of low endothelial shear stress colocalize with coronary atheromata with thin fi⁃brous caps in pigs[J].Circulation,2011,123(6):621-630.
[9]胡敏,康彧,蒋剑,等.超声血流向量成像技术探讨颈动脉球部壁面剪切应力的影响因素[J].声学技术,2022,41(4):546-550.
[10]廖云,韦琳,卢忠武,等.急性缺血性脑卒中患者磁共振血管壁成像表现及与颈动脉粥样硬化斑块特征的相关性研究[J].影像研究与医学应用,2024,8(21):47-49,53.
[11]MIAO XY,SHA TT,ZHANG W,等.通过超声分子成像与二维剪切波弹性成像观察大鼠肝窦毛细血管化以评估肝纤维化[J].国际医学放射学杂志,2022,45(5):610.
[12]ZHOUM,YUY,CHENR,et al.Wall shear stress and its role in atherosclerosis[J].Frontiers in Cardiovascular Medicine,2023,10:1083547.
[13]HARTMANEMJ,DENG,KOK AM,et al.Wall shear stress-related plaque growth of lipid-rich plaques in human coronary arteries:An near-infrared spectroscopy and optical coherence tomography study[J].Cardiovascu⁃lar Research,2023,119(4):1021-1029.
[14]DENG,HARTMANEMJ,TORTAE,et al.Predicting lipid-rich plaque progression in coronary arteries using multimodal imaging and wall shear stress signatures[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2024,44(4):976-986.
[15]KHANMO,NISHIT,IURAS,et al.Colocalization of coronary plaque with wall shear stress in myocardial bridge patients[J].Cardiovascular Engineering and Tech⁃nology,2022,13(5):797-807.
[16]谢昊泰,张岩,龚艳君.基于冠状动脉CT造影的生物机械应力在斑块评估及不良心血管事件预测中的应用[J].医用生物力学,2023,38(3):627-634.










