高良姜素联合奥美拉唑对乙醇诱导小鼠急性胃溃疡的保护作用论文
2025-10-25 14:50:25 来源: 作者:xuling
摘要:各用药组均有效果,但联合组效果显著优于单用药,通过降低溃疡指数,增加氧化能力,降低炎症因子和氧化自由基代谢,通过抑制NF-κB,提高HSP70蛋白的表达水平,有效地阻断了MAPK p38/NF-κB p65信号通路,从而对乙醇诱导的小鼠胃溃疡产生保护性作用。
[摘要]目的研究高良姜素联合奥美拉唑对乙醇诱导小鼠胃溃疡的保护作用。方法随机选取50只小鼠,并按随机数字表法分为5组,每组10只,分别为:正常组(0.9%生理盐水)、模型组(0.9%生理盐水)、奥美拉唑组(20 mg/kg)、高良姜素组(50 mg/kg)及联合组(高良姜素50 mg/kg+奥美拉唑20 mg/kg)。除正常组给予生理盐水外,其余4组按照体质量灌胃无水乙醇来建立急性胃溃疡模型,观察各组小鼠胃组织形态学和胃组织病理学变化、溃疡指数评分、溃疡抑制率的变化;检测血清中超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)和胃组织中过氧化氢酶(catalase,CAT)、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)的含量变化;通过免疫荧光方法检测胃组织中NF-κB、HSP70的蛋白表达水平;蛋白印迹法检测小鼠胃组织中MAPK/NF-κB信号通路蛋白表达。结果模型组溃疡指数为15.20±4.92,奥美拉唑组溃疡指数为5.10±1.66,高良姜素组溃疡指数为5.70±1.77,联合组溃疡指数为4.10±1.52,与模型组相比,奥美拉唑组、高良姜素组和联合组胃溃疡指数显著降低,差异有统计学意义(F=32.87,P<0.05)。奥美拉唑组抑制率为66.45%,高良姜素组抑制率为62.50%,联合组抑制率为73.03%,其中联合组溃疡抑制率最高。与模型组相比较,奥美拉唑组、高良姜素组和联合组小鼠血清中MDA、MPO浓度显著降低,而血清中SOD和胃组织中CAT水平显著升高,TNF-α、IL-6、IL-1β浓度显著降低,NF-κB p65、MAPK P38表达水平显著降低,且联合组更加明显,差异均有统计学意义(P均<0.05)。结论各用药组均有效果,但联合组效果显著优于单用药,通过降低溃疡指数,增加氧化能力,降低炎症因子和氧化自由基代谢,通过抑制NF-κB,提高HSP70蛋白的表达水平,有效地阻断了MAPK p38/NF-κB p65信号通路,从而对乙醇诱导的小鼠胃溃疡产生保护性作用。
[关键词]高良姜素;奥美拉唑;乙醇性胃溃疡;MAPK p38/NF-кB p65信号通路
胃溃疡是上消化道最常见的胃肠道疾病,是发生在胃幽门和贲门之间,因不同原因造成胃黏膜破坏而引起的一种常见消化性溃疡疾病。胃溃疡是一种全球性的常见病,全球估计约有10%左右的人在其一生中患过此病[1]。酒精已被证明是引发胃溃疡的主要原因之一[2],常见临床症状有胃部疼痛、消化不良、体质量减轻等,若病情发展迅猛,还可出现出血、穿孔、呕血等并发症,该病不仅易复发,严重者会因并发症而死亡,甚至还有癌变的风险[3]。西医中常用的治疗药物包括质子泵抑制剂、抗菌药物等,但这些常用的药物具有复发率高、药物不良反应、细菌耐药等缺点。而传统中医药具有千年的历史,并且有多项研究表明许多植物提取物对胃具有保护作用[4]。中药高良姜是姜科植物高良姜的干燥根茎,气香,味辛性热,具有散寒止呕、温胃止痛的功效,现代药理研究表明高良姜具有抗炎、抗肿瘤、镇痛、抗菌等药理作用[5-9]。中医药具有疗效高、不良反应小、接受程度高等优势,就目前的研究现状来看,单用西药疗效有限,中西联合治疗是一种新的发展方向,高良姜素为中药高良姜活性成分之一,高良姜素联合奥美拉唑为治疗胃溃疡提供新思路。
1材料与方法
1.1试剂与仪器
高良姜素(西安汇林生物科技有限公司,批号:1590-980601,规格:1 g,含量>98%);奥美拉唑肠溶胶囊(国家准字号H20045944;规格:20 mg);HE染色试剂(广州硕谱生物科技有限公司);髓过氧化物酶(myeloperoxidase,MPO)、超氧化物歧化酶(super⁃oxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)白细胞介素6(interleukin 6,IL-6)和白细胞介素1β(interleukin 1β,IL-1β)使用酶联免疫吸附试验试剂盒(上海酶联生物科技有限公司);过氧化氢酶(catalase,CAT)、蛋白定量测定试剂盒(南京建成生物工程研究所);无水乙醇(辽宁泉瑞试剂有限公司);生理盐水;精密电子分析天平(Mettler To⁃ledo,XS-104);低温离心机(Thermo);组织匀浆器(江苏翌哲教学仪器有限公司);数字显式电热恒温水浴锅(上海跃进医疗器械厂,XMTD-204);酶标仪(Thermo,MULTISKAN MK3);包埋机(Thermo Fisher Scientific),切片机(Thermo Fisher Scientific,RM2145)以及显微镜。
1.2实验动物
ICR小鼠,SPF级,雄性小鼠,体质量20~25 g,共50只,购自辽宁长生生物技术股份有限公司,实验动物许可证号:SCXK(辽)2020-0001,分笼饲养,享有充足的食物与水源供应并确保舒适生活环境,先适应性喂养3 d,再进行实验,室温(22±2)℃,湿度(50±5)%,昼夜交替12 h。本研究已通过牡丹江医科大学实验动物福利与伦理委员会批准(20220418-1)。
1.3实验分组、药物干预及模型的建立
运用随机数字表法将小鼠分成5组,每组10只,分别为正常组、模型组、奥美拉唑组、高良姜素组、联合组(高良姜素联合奥美拉唑)。奥美拉唑组小鼠以奥美拉唑溶液灌胃20 mg/kg,高良姜素组小鼠以高良姜素溶液灌胃50 mg/kg,联合组小鼠以奥美拉唑20 mg/kg加高良姜素50 mg/kg联合灌胃,模型组和正常组均给予等体积的0.9%生理盐水溶液,持续7 d,1次/d。第7天用药之前,对小鼠实施禁食不禁水的状态维持12 h,然后在第7天给予药物1 h后,除正常组以外,其它各组小鼠灌胃无水乙醇(0.2 mL/20 g),建急性胃溃疡模型,建模1 h后,麻醉处死小鼠并采集所需标本保存备用。
1.4实验方法
1.4.1各组小鼠的胃组织形态观察打开各组小鼠的腹腔,把整个胃部取出,沿胃大弯方向剖开其胃腔,使用生理盐水清洗至无残留物后,对各组小鼠胃组织进行观察。
1.4.2各组小鼠的溃疡指数和溃疡抑制率的情况比较根据Guth标准[10]计算溃疡指数,按溃疡或糜烂面积计分:每3个点状溃疡计1分;条状出血:以直尺测量溃疡面的最大长径和垂直于最大长径的最大宽径,二者的乘积即为溃疡指数。宽为1 mm者每1 mm长计为1分,2 mm宽者每1 mm长为2分;3 mm宽者每1 mm长为3分。全胃累计得分,即为该小鼠的溃疡指数。溃疡抑制率=(模型组溃疡指数-治疗组溃疡指数)/模型组溃疡指数×100%。
1.4.3各组小鼠胃组织病理学分析取部分胃组织,用4%甲醛溶液固定胃组织保存。然后用石蜡包埋,在切片机的帮助下切片。使用HE染色试剂进行染色,并在光学显微镜下进行观察,记录胃组织病理学变化。
1.4.4检测各组小鼠血清中MDA、SOD、MPO和胃组织CAT生化指标情况摘除眼球取血,静置15 min后,离心制备成血清置于4℃备用;取一定量的胃组织,称重记录。将胃组织剪碎并倒入匀浆器中,使用匀浆器将组织充分研碎,整个过程均在冰上进行。将制备好的组织匀浆用离心机离心,离心后取上清液,置于4℃用于各项指标的测定。
1.4.5胃组织中的TNF-α、IL-6、IL-1β炎症因子的水平的影响取一定量的胃组织,称重记录。将胃组织剪碎并倒入匀浆器中,使用匀浆器将组织充分研碎,整个过程均在冰上进行。将制备好的组织匀浆用离心机以3 000 r/min,离心半径10 cm,离心10 min,取上清液,置于4℃用于各项指标的测定。
1.4.6免疫荧光测定胃组织中NF-κB、HSP70胃黏膜组织病理切片经脱蜡、水化后,根据说明书操作进行免疫荧光学染色,拍照保存。
1.4.7 Western blot检测胃组织中NF-κB p65、MAPK p38的表达情况取适量的胃组织,加入适量裂解液,用组织碾磨仪进行匀浆,直至充分裂解。用离心机12 000 g,离心半径为11.6 cm,离心10 min,上清液转移至新的EP管中。蛋白质浓度的测量,使用SDS-PAGE方法制作凝胶,样本的转移到电泳槽中,转膜,按照说明书执行第一阶段和第二阶段的抗体反应,然后染色或者显像的过程,最后拍摄并且存储结果。利用Quantity One、Gel pro analyzer、Image J等工具来对每个条纹进行数量化评估。
1.5统计方法
应用SPSS 27.0和GraphPad Prism 10.0分析软件,计量资料经Shapiro-Wilk检验符合正态分布,以(±s)表示,行t检验;多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2结果
2.1 5组小鼠胃组织形态学观察
正常组可以看到胃壁完整,呈肉粉色;模型组胃壁发红,有明显出血;奥美拉唑组、高良姜素组和联合组与模型组相比,出血减轻,胃壁发红减轻;联合组溃疡程度最轻。见图1。
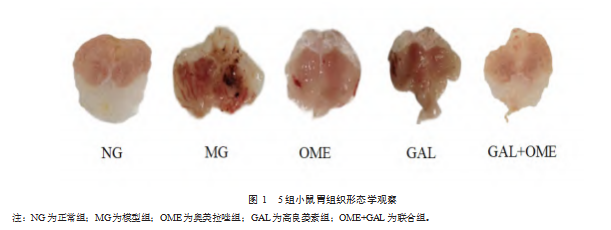
2.2 5组小鼠胃组织溃疡指数和溃疡抑制率的情况
与正常组相比较,乙醇诱导的模型组小鼠溃疡指数显著升高,差异有统计学意义(P<0.05)。与模型组相比,奥美拉唑组、高良姜素组和联合组胃溃疡指数显著降低,差异有统计学意义(P<0.05)。见表1。根据公式计算可得出,奥美拉唑组抑制率为66.45%,高良姜素组抑制率为62.50%,联合组抑制率为73.03%,其中联合组溃疡抑制率最高。
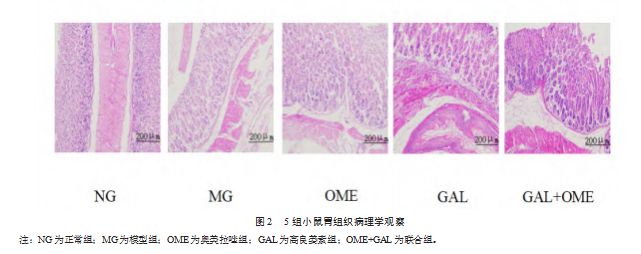
2.3 5组小鼠胃组织病理学观察
图2为胃组织的HE染色(×100倍),正常组小鼠胃组织黏膜层结构完好无损,其表层上皮黏液细胞状态正常。与之形成鲜明对比的是,模型组小鼠胃黏膜上皮腺体减少的情况十分明显,部分区域胃黏膜上皮细胞出现脱离的情况,胃底腺结构紊乱。与模型组相比较,奥美拉唑组、高良姜素组和联合组均有不同程度的减轻,可见大部分区域结构清晰,偶见上皮细胞出现脱离,但可见不同程度的腺体减少,其中联合组效果最佳。
2.4 5组小鼠血清和胃组织的生化指标情况
对比于正常组,模型组小鼠血清中MDA和MPO的含量显著上升,同时血清中SOD和胃组织中CAT水平却有明显下降趋势,差异均有统计学意义(P均<0.05)。与模型组相比较,奥美拉唑组、高良姜素组和联合组小鼠血清中MDA、MPO浓度显著降低,而血清中SOD和胃组织中CAT水平显著升高,且联合组更加明显,差异均有统计学意义(P均<0.05)。见表2。
2.5 5组小鼠胃组织中TNF-α、IL-6、IL-1β炎症因子水平
与正常组相比,模型组小鼠胃组织中TNF-α、IL-6、IL-1β含量显著上升,差异均有统计学意义(P均<0.05)。与模型组相比较,奥美拉唑组、高良姜素组和联合组小鼠胃组织中TNF-α、IL-6、IL-1β浓度显著降低,且联合组更加明显,差异均有统计学意义(P均<0.05)。见表3。
2.6 5组小鼠胃组织的NF-κB、HSP70的免疫荧光表达水平
与正常组相比,模型组小鼠胃组织中NF-κB、HSP70的表达均显著升高。胃组织中NF-κB表达情况,与模型组相比,奥美拉唑组、高良姜素组和联合组均显著降低,其中联合组作用效果最为显著,差异均有统计学意义(P均<0.05)。胃组织中HSP70表达情况,与模型组相比较,奥美拉唑组、高良姜素组和联合组都有明显的上升趋势,而在这三者之中,联合组的效果更为突出,差异均有统计学意义(P均<0.05)。见图3。
2.7 5组小鼠胃组织MAPK/NF-кB信号通路指标比较
与正常组相比,模型组胃组织中MAPK p38和NF-кB p65蛋白水平显著升高,差异均有统计学意义(P均<0.05)。与模型组相比,奥美拉唑组、高良姜素组和联合组胃组织中MAPK p38、NF-kB p65蛋白水平显著降低,其中联合组更加明显,差异均有统计学意义(P均<0.05)。见图4。
3讨论
胃溃疡是最常见的胃肠疾病。其中,乙醇诱导的胃溃疡是由于摄入大量酒精所引起的急性胃黏膜损伤,也是较为常见的胃溃疡之一[11]。通过胃溃疡指数、胃溃疡抑制率、胃组织形态学和HE染色的观察都能够直观地反映出各组小鼠胃黏膜的损伤程度,及各组用药物后效果评价[12]。此外,炎症反应、氧化应激和中性粒细胞浸润在胃溃疡的病理生理学中起着关键作用。作为一种重要的脂质过氧化产物,MDA对细胞产生毒性,可以反映机体内脂质过氧化程度,测定其含量可以反映胃黏膜氧化损伤程度。而SOD属于抗氧化酶系统,具有清除氧自由基并保护细胞免受损伤的功能,体现胃黏膜的抗氧化水平[13]。CAT是一种能催化过氧化氢分解为水和氧气的酶,是过氧化物酶体的标志酶。MPO是中性粒细胞依赖性炎症的生物标志物,它的水平可以体现出抗炎活性[14]。本实验结果显示,模型组小鼠生化指标SOD和CAT显著降低,MPO和MDA的水平显著升高。而用药组均能够显著升高SOD和CAT的水平,降低MDA和MPO活力,其中联合组效果更佳,从而起到抗炎和抗胃溃疡的作用。此外,炎症与胃溃疡损伤过程之间的关系已被广泛认可。机体发生炎症反应后,引发巨噬细胞产生大量促炎细胞因子,如TNF-α、IL-1β、IL-6等促炎性细胞因子,在炎症反应中可以降低溃疡周围的微循环,从而延缓胃溃疡的愈合[15-16]。本实验结果显示,用药组均明显降低了TNF-α、IL-1β、IL-6含量,其中联合组效果最佳,表现出显著抑制乙醇诱导的炎症反应。NF-кB在感染、免疫反应中起广泛的作用[17-18]。MAPK链是真核生物信号传递网络中的重要途径之一,在基因表达调控和细胞质功能活动中发挥关键作用[19]。MAPK/NF-κB是介导炎症反应的重要信号通路,是调节许多免疫和炎症过程的重要转录因子。有研究表明,MAPK/NF-кB通路参与了乙醇诱导胃溃疡的发生发展过程[20]。因此,本实验通过检测小鼠胃组织MAPK p38/NF-κB p65信号通路蛋白表达,发现各用药组均能够显著抑制胃组织MAPK p38/NF-κB p65信号通路激活,其中联合组效果最佳。热休克蛋白(heat shock protein,HSP)是一类在机体应激时能起到保护作用的蛋白质,有助于保护细胞免受氧化应激损伤,它在胃组织的修复中尤为重要。其中HSP70对胃组织起到最重要保护作用。同时,HSP70与NF-κB也会相互竞争和对抗,HSP70能够使NF-κB活化受到抑制,有效加强了胃组织的自我修复能力并明显改善了炎性反应对机体的损伤[21-25]。结果表明,降低NF-κB p65的蛋白表达,提高HSP70的蛋白表达,可抑制炎症反应,从而对胃组织起到保护作用。
综上所述,本研究发现各用药组均能够有效地降低胃溃疡指数,值得注意的是,联合组效果显著优于单用药,显著降低了MDA、MPO、IL-6、TNF-α、IL-1β的含量,提高了SOD、CAT的水平,抑制NF-κB p65的蛋白表达,提高HSP70的蛋白表达,抑制胃组织MAPK p38/NF-κB p65信号通路激活,增强抗氧化能力,降低炎症因子反应,最终有助于缓解酒精性胃溃疡的发展,进而对酒精性胃溃疡的起到预防和保护作用。
[参考文献]
[1]MOHAMMAD B,SEIFOLLAH B.Ameliorating and pro⁃tective effects mesalazine on ethanol-induced gastric ul⁃cers in experimental rats[J].European Journal of Pharma⁃cology,2020,888(prepublish):173573.
[2]FARHEEN SF,SAIQA I,O ML,et al.Metabolic profil⁃ing of heliotropium crispum aerial parts using hplc and ftir and in vivo evaluation of its anti-ulcer activity using an ethanol induced acute gastric ulcer model[J].Metabo⁃lites,2022,12(8):750-750.
[3]ZHI YX,GENGEN S,YAO YF,et al.Protective effect of polysaccharides from Radix Hedysari on gastric ulcers in⁃duced by acetic acid in rats[J].Food&Function,2019,10(7):3965-3976.
[4]IKRAM K,LOTFI B.Effectiveness of opuntia ficus indica l.inermis seed oil in the protection and the healing of ex⁃perimentally induced gastric mucosa ulcer[J].Oxidative Medicine and Cellular Longevity,2019,2019:1568720.
[5]GEORGE G,SHYNI GL,ABRAHAM B,et al.Down⁃regulation of TLR4/MyD88/p38MAPK and JAK/STAT pathway in RAW 264.7 cells by Alpinia galanga reveals its beneficial effects in inflammation[J].J Ethnopharma⁃col,2021,275:114132.
[6]HALA E,T EM,HEBA H,et al.UPLC-PDA-MS/MS profiling and healing activity of polyphenol-rich fraction of alhagi maurorum against oral ulcer in rats[J].Plants,2022,11(3):455-455.
[7]HARIKA A,ÇISIL PÇ,SULEYMAN I.Synthesis of silver nanoparticles using alpinia officinarum rhizome extract in⁃duces apoptosis through down-regulating bcL-2 in hu⁃man cancer cells[J].Biologia Futura,2022,73(3):327-334.
[8]SOORANI F,ASADI F,KOLANGI F,et al.Quantifica⁃tion of flavonoids in alpinia officinarum hance.via HPLC and evaluationof its cytotoxicity on human prostate carci⁃noma(LNCaP)and breast carcinoma(MCF-7)cells[J].Anti-Cancer Agents in Medicinal Chemistry,2022,22(4):721-730.
[9]汤利,陆晓燕,谢和益,等.高良姜挥发油的提取和抗菌效果研究[J].广东化工,2021,48(13):49-50,4.
[10]沈玖君,邓利玲,帅天罡,等.魔芋粉对小鼠急性酒精性胃黏膜损伤和慢性酒精性肠损伤的影响[J].食品科学,2018,39(9):163-169.
[11]冯敏,胡晶,温洁馨,等.人参皂苷Rg1对APP/PS小鼠脑组织内Aβ沉积及行为学的影响[J].基因组学与应用生物学,2020,39(5):2361-2366.
[12]刘煜洪.广藿香醇胃液代谢物β-广藿香烯抗胃溃疡及溃疡性结肠炎的研究[D].广州:广州中医药大学,2018.
[13]杨进,张珅,姚昌恒,等.益胃汤加味对乙醇致大鼠胃溃疡的保护作用[J].药物评价研究,2024,47(9):2099-2106.
[14]完地高,安拉太,黄先菊,等.藏药日官孜玛通过NF-κB信号通路对小鼠乙醇性胃溃疡的胃保护作用[J].高原科学研究,2024,8(1):92-101.
[15]周慧英,邓红雨,康瑞萍,等.孜然枯茗醛对实验性胃溃疡大鼠胃黏膜的保护作用[J].中国药理学通报,2023,39(5):946-952.
[16]WEI Q,LIANG S,YANG Y,et al.Gastroprotective ef⁃fect of alpinia zerumbet(pers.)burttet smith on ethanol-induced gastric ulcers in vivo and vitro[J].Medicinal Plant,2023,14(5):65-71.
[17]ALEX DO,MOTUNRAYO OO,ADEWALE TB,et al.Protective potential of ethylacetate extract of abrus precatorius(linn)seeds against HCl/EtOH-induced gas⁃tric ulcer via pro-inflammatory regulation:In vivo and in silico study[J].Phytomedicine Plus,2021,1(4):100145.
[18]BADR AM,EL-ORABI NF,ALI RA.The implication of the crosstalk of Nrf2 with NOXs,and HMGB1 in ethanol-induced gastric ulcer:Potential protective ef⁃fect is afforded by raspberry ketone[J].PloS One,2019,14(8):e0220548.
[19]ALI NB,ABDELHAMID IBRAHIM SS,ALSHERBINY MA,et al.Gastroprotective potential of red onion(allium cepa L.)peel in ethanol-induced gastric injury in rats:Involvement of Nrf2/HO-1 and HMGB-1/NF-κB trajectories[J].Journal of Ethnopharmacology,2024,319(P1):117115.
[20]王淑敏,曹菁,穆双双,等.长柄侧耳发酵物对乙醇诱导小鼠胃溃疡的保护作用研究[J].吉林中医药,2018,38(6):689-692.
[21]喻斌,曾孟晖,徐寅,等.肝胃百合汤对慢性应激与幽门螺杆菌双重损伤因素模型小鼠胃黏膜组织HSP70、NF-κB蛋白表达的影响[J].湖南中医药大学学报,2019,39(9):1073-1078.
[22]KAMARAN A.Anti-ulcer effect of Ranunculus mille⁃foliatus on absolut-e alcohol-induced stomach ulcer⁃ation[J].Saudi Journal of Biological Sciences,2023,30(8):103711.
[23]CETIN N,MENEVSE E,CEYLAN C,et al.Histopatho⁃logical and biochemica-l evaluation of the protective ef⁃ficacy of Prunus spinosa L.extract in a rat model of indomethacin-induced gastric ulcer[J].Iranian Journal of Basic Medical Sciences,2024,27(11):1464-1474.
[24]韩雪冬,谭壮忱,贾立周.基于MEK/ERK信号通路探究上调HSP70对胃溃疡大鼠氧化损伤的作用机制[J].中国老年学杂志,2024,44(12):2979-2981.
[25]BALAKY JTS.Anti H.pylori,anti-secretory and gastro⁃protective effects of thymus vulgaris on ethanol-induced gastric ulcer in sprague dawley rats[J].PloS One,2024,19(1):e0287569.










