肝动脉灌注化疗与替雷利珠单抗联合应用在晚期肝癌治疗中的疗效论文
2025-10-25 14:39:48 来源: 作者:xuling
摘要:HAIC与替雷利珠单抗联合应用在晚期肝癌治疗中能够显著改善肝功能,降低肿瘤标志物水平,提高治疗有效率,且不良反应发生率未明显增加。
[摘要]目的探讨肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)与替雷利珠单抗联合应用在晚期肝癌治疗中的疗效。方法方便选取2023年1月—2024年8月在成武县人民医院就诊的60例晚期肝癌患者为研究对象,以不同治疗方法分组,每组30例。对照组采用HAIC治疗,研究组在对照组基础上联合替雷利珠单抗治疗。对比两组肝功能指标、肿瘤标志物水平、治疗有效率以及不良反应发生率。结果治疗后,研究组的肝功能水平优于对照组,同时,研究组的肿瘤标志物水平低于对比组,差异均有统计学意义(P均<0.05)。研究组的治疗有效率为60.00%(18/30),高于对比组的30.00%(9/30),差异有统计学意义(χ2=5.455,P<0.05)。研究组的不良反应发生率略高于对照组,差异无统计学意义(P>0.05)。结论HAIC与替雷利珠单抗联合应用在晚期肝癌治疗中能够显著改善肝功能,降低肿瘤标志物水平,提高治疗有效率,且不良反应发生率未明显增加。
[关键词]肝动脉灌注化疗;替雷利珠单抗;晚期肝癌;疗效;不良反应
晚期肝癌是指肝癌已经发展到较为严重的阶段,癌细胞可能已经扩散到肝脏以外的其他部位,或者肿瘤体积巨大,压迫周围组织和器官。晚期肝癌患者常伴随腹痛、恶心、呕吐、食欲减退、体质下降、疲劳、黄疸等症状,生活质量受到严重影响,且预后较差[1]。因此,探索有效的晚期肝癌治疗方法具有重要意义。近年来,随着医疗技术的不断发展,晚期肝癌的治疗手段也在不断进步。传统的治疗方法如手术切除、放疗和化疗等,在晚期肝癌中的应用受到一定限制。而肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)作为一种局部治疗手段,通过肝动脉插管实现化疗药物的直接灌注,这一方法能够显著提升肿瘤组织局部的药物浓度,同时有效减少化疗药物在身体其他器官的分布,从而在发挥强大抗肿瘤作用的同时,降低不良反应[2]。另一方面,替雷利珠单抗作为一种程序性死亡受体1(programmed death-1,PD-1)抑制剂,其机制在于阻断PD-1蛋白与其配体的结合,进而增强免疫系统对癌细胞的识别与攻击能力,这一特性使得替雷利珠单抗在晚期肝癌的治疗中展现出了一定的疗效[3-4]。近年来,HAIC与替雷利珠单抗的联合应用逐渐成为晚期肝癌治疗的研究热点。本研究旨在通过对比不同治疗方法下晚期肝癌患者的疗效,探讨HAIC与替雷利珠单抗联合应用在晚期肝癌治疗中的疗效,为晚期肝癌患者提供更有效的治疗策略。
1资料与方法
1.1一般资料
方便选取2023年1月—2024年8月在成武县人民医院就诊的60例晚期肝癌患者为研究对象,以不同治疗方法分组,每组30例。对照组采用HAIC治疗,研究组在对照组基础上联合替雷利珠单抗治疗。研究组中男17例,女13例;年龄43~77岁,平均(61.39±5.58)岁;病程9~17个月,平均(13.69±2.31)个月;Ⅲ期14例,Ⅳ期16例;Child-Pugh[5]A级12例,B级18例。对照组中男18例,女12例;年龄42~76岁,平均(61.12±5.69)岁;病程9~16个月,平均(13.41±2.45)个月;Ⅲ期17例,Ⅳ期13例;Child-Pugh A级15例,B级15例。两组患者一般资料对比,差异均无统计学意义(P均>0.05),具有可比性。本研究经成武县人民医院伦理审核批准(Cw4451)。
1.2纳入与排除标准
纳入标准:年龄40~80岁;经影像学及病理学检查确诊为晚期肝癌[6];癌症分期为Ⅲ期或Ⅳ期;肝功能分级为Child-Pugh A级或B级;预计生存期>3个月;至少有一条可测的肿瘤供血动脉且直径>2 cm;对本研究知情并签署知情同意书。
排除标准:伴有严重的心、肺、肾等重要器官功能不全者;凝血功能障碍,无法耐受HAIC者;合并有其他恶性肿瘤或严重感染者;孕妇或哺乳期妇女;对替雷利珠单抗或其他研究相关药物过敏者;近3个月内接受过其他抗肿瘤治疗或参与过其他临床研究者。
1.3治疗方法
在术前准备阶段,所有患者均接受电解质紊乱的纠正措施,以及保肝治疗和必要的营养支持等对症治疗。对照组患者采用HAIC方案:在严格的消毒和麻醉程序后,通过经皮股动脉或桡动脉进行穿刺,随后置入短导丝,并引导导管沿血流方向精准插入至腹腔干动脉,进而超选择性进入肝动脉。利用动脉造影技术,明确肿瘤供血动脉的具体位置及肿瘤血管的分布情况。在此基础上,通过导管向患者体内灌注奥沙利铂注射液(国药准字H20031048;规格:20 mL∶40 mg)85~130 mg/m2,动脉灌注2~3 h,注射用亚叶酸钙(国药准字H20060198;规格:50 mg)400 mg/m2,动脉灌注1~2 h,紧接着注入氟尿嘧啶注射液(国药准字H20233517;规格:10 mL∶0.25 g)400 mg/m2动脉团注后再以2 400 mg/m2持续动脉灌注23 h或46 h。每3周重复1次,治疗间隔不宜>4周,共计2次,每次均应重新行动脉造影检查及选择性插管等操作,如果肿瘤血供情况变化,应重新置管于肿瘤的主要供血血管中。研究组则在对照组HAIC治疗的基础上,联合替雷利珠单抗注射液[国药准字S20190045;规格:100 mg(10 mL)/瓶]进行静脉滴注治疗。替雷利珠单抗的给药剂量为200 mg/m2,按照每3周1次的频率进行给药,整个治疗周期共计2次。
1.4观察指标
①肝功能指标:于治疗前及治疗6周后,采集3 mL空腹静脉血,以全自动生化分析仪(深圳市盛信康科技有限公司,粤械注准20182221055,型号规格:SK6100)检测丙氨酸氨基转移酶(alanine amino⁃transferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)水平。
②肿瘤标志物水平。于治疗前及治疗6周后,采集3 mL空腹静脉血,应用酶标仪(湘械注准20222222017,湖南中瑞互信医疗科技有限公司,型号规格CS-Sunrise)测定两组甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic anti⁃gen,CEA)、糖类抗原19-9(carbohydrate antigen,CA19-9)水平。
③治疗总有效率。于所有治疗结束后1周进行评估。完全缓解(complete remission,CR)指的是所有目标病灶完全消失不见的情况;部分缓解(partial remission,PR)是指基线病灶的最长直径总和缩减≥30%;疾病进展(disease progression,PD)则意味着基线病灶的最长直径总和增加≥20%,或者有新病灶出现;而疾病稳定(stable disease,SD)的状态则是处于部分缓解与疾病进展之间的一个状态。客观缓解率(objective remission rate,ORR)=CR率+PR率。
④不良反应发生率:记录并比较两组恶心呕吐、感染、骨髓抑制、转氨酶升高、皮肤瘙痒、疲乏乏力的发生情况。
1.5统计方法
采用SPSS 22.0统计学软件处理数据,肝功能指标、肿瘤标志物水平为计量资料,经Shapiro-Wilk检验符合正态分布,以(±s)表示,组间比较行两独立样本t检验,组内比较行配对样本t检验;治疗总有效率、不良反应发生率为计数资料以例数(n)和率(%)表示,组间比较行χ2检验。P<0.05为差异有统计学意义。
2结果
2.1两组患者肝功能指标比较
治疗后,两组肝功能水平均较治疗前改善,且研究组优于对照组,差异均有统计学意义(P均<0.05)。见表1。
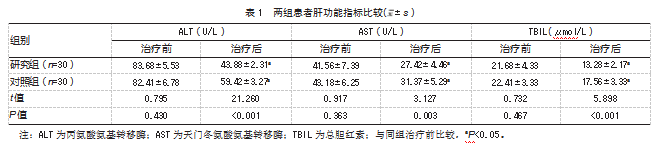
2.2两组患者肿瘤标志物水平比较
治疗后,两组肿瘤标志物水平均较治疗前降低,且研究组低于对照组,差异均有统计学意义(P均<0.05)。见表2。
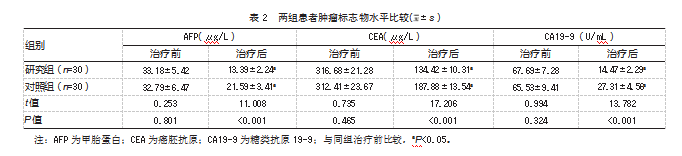
2.3两组患者治疗有效率比较
治疗后,研究组的治疗有效率为60.00%,高于对照组的30.00%,差异有统计学意义(P<0.05)。见表3。
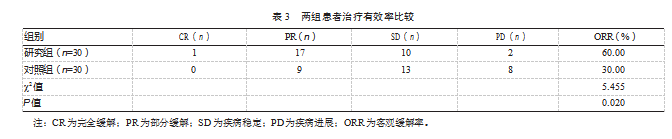
2.4两组患者不良反应发生率比较
治疗后,研究组的不良反应发生率为33.33%,略高于对照组的20.00%,差异无统计学意义(P>0.05)。见表4。
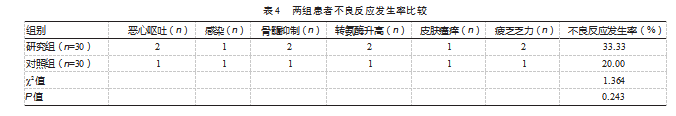
3讨论
晚期肝癌的治疗一直是临床上的难题。鉴于肝癌的发病具有隐匿性,多数患者在确诊时已进展至晚期阶段,因此往往错过了手术根治的最佳时机。近年来,随着医学技术的不断进步,晚期肝癌的治疗手段日益丰富,包括系统治疗、局部治疗及综合治疗等。其中,HAIC作为晚期肝癌的重要局部治疗手段,因其能直接针对肿瘤供血动脉进行药物灌注和栓塞,有效切断肿瘤的血供,从而抑制肿瘤的生长,在临床上得到了广泛应用[7]。而替雷利珠单抗作为一种PD-1抑制剂,通过阻断PD-1与PD-L1的结合,解除免疫抑制,激活机体的抗肿瘤免疫反应,在多种恶性肿瘤的治疗中展现出了良好的疗效[8]。近年来,将HAIC与替雷利珠单抗联合应用于晚期肝癌的治疗,已成为研究的热点。
本研究结果显示,治疗后研究组的肝功能水平优于对照组(P均<0.05),这一结果提示,HAIC与替雷利珠单抗的联合应用对晚期肝癌患者的肝功能具有积极的保护作用。HAIC作为一种局部治疗手段,能够直接将化疗药物输送到肿瘤部位,减少了对正常肝组织的损伤,从而有助于肝功能的恢复[9]。同时,替雷利珠单抗作为PD-1抑制剂,通过增强免疫系统的抗肿瘤活性,可能间接减轻了肿瘤对肝脏的压迫和损害,进一步促进了肝功能的改善[10]。此外,替雷利珠单抗还可能通过调节肝脏微环境,减少炎症反应,有利于肝细胞的修复和再生[11]。治疗后,研究组的肿瘤标志物水平低于对比组(P均<0.05)。肿瘤标志物如AFP、CA19-9等,在肝癌的发生、发展过程中起着重要作用,其水平的降低往往预示着肿瘤负荷的减轻和治疗效果的改善。HAIC通过局部高浓度的化疗药物直接作用于肿瘤组织,有效抑制了肿瘤细胞的生长和扩散,从而降低了肿瘤标志物的水平[12]。替雷利珠单抗则通过激活免疫系统,增强T细胞对肿瘤细胞的识别和杀伤能力,进一步促进了肿瘤标志物的下降[13]。这种联合治疗方案通过双重作用机制,显著提高了对晚期肝癌的治疗效果。治疗后,研究组的治疗有效率高于对比组(P<0.05),这一结果充分证明了HAIC与替雷利珠单抗联合应用在晚期肝癌治疗中的优越性。HAIC通过局部高浓度的化疗药物直接杀灭肿瘤细胞,同时减少了对正常组织的损伤[14]。替雷利珠单抗则通过增强免疫系统的抗肿瘤活性,提高了对残留肿瘤细胞的清除能力[15]。这种局部治疗与免疫治疗的有机结合,实现了对晚期肝癌患者的全面治疗,显著提高了治疗有效率。治疗后,研究组的不良反应发生率33.33%(10/30)略高于对照组20.00%(6/30)(P>0.05),与袁生武等[14]的研究结果“观察组的不良反应发生率28.83%略高于对照组18.69%(P>0.05)”一致。这一结果可能与HAIC和替雷利珠单抗的联合应用有关。HAIC作为一种局部治疗手段,虽然能够减少对正常组织的损伤,但仍可能引起一定的不良反应,如发热、恶心、呕吐等。针对发热,可采取物理降温(如温水擦浴)或药物降温措施,同时密切监测体温变化;对于恶心、呕吐,可给予止吐药物,并指导患者少食多餐,避免油腻食物。替雷利珠单抗作为免疫检查点抑制剂,也可能引起免疫相关不良反应,如皮疹、甲状腺功能异常等[15]。若出现皮疹,可根据严重程度选择外用糖皮质激素或口服抗组胺药物,并注意皮肤保湿;针对甲状腺功能异常,需定期监测甲状腺功能指标,必要时给予甲状腺素替代治疗或抗甲状腺药物治疗。然而,通过实施合理的剂量调整与个体化的治疗方案,大多数不良反应均能够得到有效的控制与管理,从而避免对患者的生活质量产生显著的不良影响。
综上所述,HAIC与替雷利珠单抗联合应用在晚期肝癌治疗中能够显著改善肝功能,降低肿瘤标志物水平,提高治疗有效率,且不良反应发生率未明显增加。
[参考文献]
[1]CHEN S,SHI F,WU Z,et al.Hepatic arterial infusion chemotherapy plus lenvatinib and tislelizumab with or without transhepatic arterial embolization for unresect⁃able hepatocellular carcinoma with portal vein tumor thrombus and high tumor burden:A multicenter retro⁃spective study[J].J Hepatocell Carcinoma,2023,10:1209-1222.
[2]葛超杰.替雷利珠单抗联合阿帕替尼在晚期肝癌中的应用效果[J].中外医学研究,2023,21(28):141-144.
[3]姜静华,胡益挺.替雷利珠单抗联合索拉非尼治疗不可切除肝细胞性肝癌的疗效和安全性[J].中国药师,2024,27(8):1336-1342.
[4]王寅淼.替雷利珠单抗联合仑伐替尼对不可切除肝细胞癌患者的作用效果[J].河南医学研究,2024,33(13):2436-2439.
[5]PENG Y,QI X,GUO X.Child-pugh versus MELD score for the assessment of prognosis in liver cirrhosis:Asystematic review and meta-analysis of observational studies[J].Medicine(Baltimore),2016,95(8):e2877.
[6]国家感染性疾病临床医学研究中心,北京医学会肝病学分会,中国老年学及老年医学学会转化医学分会.晚期原发性肝癌精细化诊疗管理专家共识(2023年版)[J].中华肝脏病杂志,2023,31(9):910-920.
[7]秦志,韩斌,王美娜.仑伐替尼联合替雷利珠单抗治疗肝癌术后肺转移的临床效果[J].临床合理用药,2024,17(18):54-56.
[8]王瑞丽,黄春霞.替雷利珠单抗、仑伐替尼联合肝动脉持续灌注化疗治疗不可切除肝癌患者的效果观察[J].大医生,2025,10(2):55-58.
[9]SUN R,GOU Y,PAN L,et al.Hepatic arterial infusion chemotherapy(HAIC)combined with tislelizumab and lenvatinib for unresectable hepatocellular carcinoma:A retrospective single-arm study[J].Cell Oncol(Dordr),2024,47(6):2265-2276.
[10]王宏博,刘福晨,刘辉,等.经肝动脉化疗栓塞术联合多纳非尼与替雷利珠单抗治疗中晚期肝癌34例[J].临床放射学杂志,2024,43(3):443-449.
[11]熊坚威,李强,唐涛,等.经肝动脉化疗栓塞联合酪氨酸激酶抑制剂及程序性死亡受体-1抗体治疗中晚期不可切除肝细胞癌的临床疗效和安全性分析[J].临床外科杂志,2024,32(2):176-181.
[12]苏展,车金辉,裴锐锋.替雷利珠单抗较索拉非尼作为晚期不可切除肝细胞癌一线治疗的成本-效用分析[J].中国药师,2024,27(1):109-116.
[13]LI KS,LIU Y,ZHANG TZ,et al.Protocol of REACH-01:A single-arm,open label,prospective study of HAIC sequential TAE combined with tislelizumab and surufatinib in unresectable intrahepatic cholangiocarci⁃noma[J].Front Pharmacol,2024,15:1435639.
[14]袁生武,刘凯.替雷利珠单抗联合经肝动脉化疗栓塞治疗晚期肝癌的临床研究[J].临床医学工程,2023,30(12):1705-1706.
[15]蒋仕伍,彭晓燕,陈均源,等.TACE联合替雷利珠单抗治疗中晚期原发性肝癌的临床价值[J].肝脏,2024,29(6):676-680.










