miRNA 及其相关信号通路在青光眼中的研究进展论文
2025-10-25 10:41:53 来源: 作者:xuling
摘要:青光眼是全球第二大致盲眼病,具有不可逆性,严重危害人类健康,其发病机制涉及遗传、环境和生活方式等多种因素。越来越多的证据表明,微小RNA(miRNA)作为一类非编码的内源性小分子RNA,能够靶向调控多种基因的表达,介导相关信号通路途径,参与青光眼致病的过程。
[摘要]青光眼是全球第二大致盲眼病,具有不可逆性,严重危害人类健康,其发病机制涉及遗传、环境和生活方式等多种因素。越来越多的证据表明,微小RNA(miRNA)作为一类非编码的内源性小分子RNA,能够靶向调控多种基因的表达,介导相关信号通路途径,参与青光眼致病的过程。本文归纳总结了青光眼中miRNA参与调控的几个重要信号通路:PI3K/AKT、转化生长因子β(transforming growth factor-β,TGF-β)、促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、信号转导和转录激活因子3(signal trans⁃ducer and activator of transcription 3,STAT3)和Notch信号通路等,深入阐述miRNA介导纤维化、RGCs死亡、ECM重塑、视网膜新生血管形成和小胶质细胞活化等的生物学过程,以期为未来从miRNA角度干预和治疗青光眼提供一定的理论依据。
[关键词]青光眼;微小RNA;信号通路
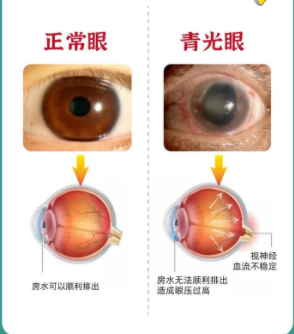
青光眼是一组以视力降低、视乳头凹陷性萎缩、视野缺损为主要特征的综合神经退行性疾病,是世界范围内的三大不可逆致盲眼病之一[1]。截至目前,在40岁以上的中老年人群中,青光眼的患病率可达3.5%,全球约有6 000万青光眼患者,预估到2040年,患病人数将增加至1.12亿[2]。该病潜伏期较长,约50%的患者在早期无法察觉,而一旦出现症状,已有不可逆的视神经损伤,因此早期防治尤为重要。视网膜神经节细胞(retinal ganglion cells,RGCs)及其轴突的进程性缺损是青光眼最主要的病理改变,其详细致病机制尚不清楚。筛板被认为是视神经受损的关键部位,它是一种多孔的胶原筛状结构,由筛板细胞、星形胶质细胞及其产生的必需生长因子和细胞外基质(extracellular matrix,ECM)等组成[3]。当眼内压升高时,筛板内外的压力差增高导致筛板受压、变形和重塑,严重时阻碍视神经纤维内的正反向轴突运输[4]。随着高通量测序技术的不断发展,在青光眼中已鉴定出大量异常表达的微小RNA(miRNA),它们广泛分布在房水、眼泪和血液中,影响着小梁网、视网膜和视神经中青光眼相关基因和信号通路的表达[5]。近年来,越来越多的研究探索miRNA在青光眼中的作用机制,以期寻找更多的潜在生物标志物和治疗靶点,用于青光眼的早期筛查和治疗。本文以miRNA为关注点,从信号通路途径对青光眼发生发展的分子机制进行全面阐述,为未来青光眼的治疗提供一定的理论依据。
1 miRNA的生物学功能
miRNA是一组长度约为19~25个核苷酸的内源性非编码RNA,位于编码基因的外显子或内含子中,具有高度保守性,是转录后基因表达的重要调控因子[6]。有研究表明,人类中超过60%的蛋白质编码基因受到miRNA调控,涉及细胞的增殖、分化和凋亡等过程[7]。大多数miRNA编码基因在RNA聚合酶Ⅱ作用下转录生成初级转录产物pri-miRNA,pri-miRNA进一步被Drosha酶切割为具有发夹结构的前体miRNA,之后在转运蛋白5的作用下,pre-miRNA由细胞核转运至细胞质,最后被Dicer酶切割为成熟的miRNA。成熟miRNA的一条链被降解,另一条链装载到Argonaut蛋白上形成RNA诱导沉默复合体,该复合体通过与目标mRNA完全或不完全互补结合,从而实现切割或翻译抑制的调控功能[8]。在复杂的调控网络中,一个mRNA可以被多个miRNA调控,而一个miRNA也可以调控多个基因靶点。
2 miRNA及其相关信号通路在青光眼中的作用
迄今为止,已有数百种miRNA被鉴定出存在于房水、泪液和周围眼组织中。多种miRNA被证实与视网膜变性、视神经损伤等眼部病变有关[9]。越来越多的研究表明,miRNA异常表达在青光眼的发生发展中起着重要作用,参与青光眼的致病过程。
2.1 miRNA调控PI3K/AKT信号通路介导视神经节细胞和小梁网细胞的凋亡
PI3K/AKT信号通路在细胞的黏附、生长、增殖、存活、迁移、转录和代谢中起着关键作用,与心血管疾病、内分泌疾病、神经性疾病、肿瘤等疾病的发生密切相关[10]。磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)是一种胞内脂质激酶,有Ⅰ、Ⅱ、Ⅲ类。上游信号分子与细胞膜上的酪氨酸激酶和G蛋白偶联受体结合后,激活Ⅰ类PI3K,导致磷脂酰肌醇二磷酸磷酸化产生磷脂酰肌醇三磷酸。磷脂酰肌醇三磷酸是招募蛋白激酶B(protein kinase B,AKT)的重要信使,能够与AKT的N末端PH结构域结合使其活化,进而激活其底物雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR),参与细胞的生长和增殖过程[11]。
已有研究证实,PI3K/AKT信号通路在青光眼中具有保护作用,通路激活后能够有效抑制RGCs的氧化应激、凋亡和自噬,提高RGCs存活率[12]。近年来,miRNA通过靶向PI3K/AKT通路中的信号分子参与视神经损伤的研究越来越被关注。研究报道,在N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)诱导的青光眼大鼠模型中,miR-145-5p显著上调,通过靶向TRIM2的3’非翻译区降低其表达,从而抑制PI3K/AKT信号通路,减弱对RGCs的保护能力,介导RGCs的凋亡[12]。此外,在高眼压青光眼小鼠模型中,miR-149表达增加,通过靶向BTC抑制PI3K/AKT通路使RGCs数量减少;给予miR-149抑制剂后,BTC、PI3K和AKT的表达水平增加,PI3K/AKT通路被激活,抑制RGCs的凋亡[13]。LI R等[14]在NMDA诱导的青光眼大鼠中发现,miR-93-5p在RGCs中表达下调,靶向负性调控PTEN,通过PI3K/AKT/mTOR信号通路参与RGCs的自噬和凋亡。另一项研究也得到类似结论,miR-200c-3p在300μM H2O2氧化应激诱导的高眼压青光眼大鼠模型和人小梁网(human trabecular meshwork,HTM)细胞中表达下调,靶向PTEN介导AKT/mTOR信号通路,调节HTM细胞的增殖和凋亡[15]。
2.2 miRNA调控TGF-β信号通路介导纤维化和ECM重塑
转化生长因子β(transforming growth factor-β,TGF-β)属于细胞因子超家族,由TGF-β1、TGF-β2和TGF-β3亚型组成,在调节细胞增殖、分化、凋亡、ECM生成、免疫炎症和组织修复中发挥重要作用[16]。Smad蛋白是受体调节家族,是TGF-β下游的信号转导分子,在TGF-β信号从细胞表面受体传导至细胞核的过程中起关键作用[17]。研究发现,激活的TGF-β首先与TβR-Ⅱ受体高亲和力结合,在TβR-Ⅲ受体的参与下,TβR-Ⅱ受体构象改变促进配体受体结合,随后TβR-Ⅰ受体被募集到TGF-β/TβR-Ⅱ复合物中形成异四聚体,通过磷酸化Smad2和Smad3启动信号传导,并进一步招募Smad4与其形成异聚体复合物,该复合物易位至细胞核,与各种转录因子相互作用,是经典的TGF-β/Smad信号通路途径[18]。TGF-β还可以激活其他中间体实现信号的转导,如细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、JNK、PI3K/AKT/mTOR及MAPK等信号通路,它们之间既可独立发出信号,又可协同合作。TGF-β信号通路的异常与纤维化、结缔组织病、癌症等疾病的发生密切相关[19]。
TGF-β已被证实是青光眼中纤维化和ECM结构变化的关键因素,TGF-β能够诱导成纤维细胞分化为高度收缩的肌成纤维细胞,使视神经乳头筛板处的ECM重塑,增加小梁网的水流出阻力,引起眼内压升高,进而导致视神经受压和RGCs的死亡[20]。越来越多的证据表明,miRNA可以通过靶向TGF-β信号通路中上游或下游信号分子来促进或抑制纤维化进程。在HTM细胞中发现,miR-1298表达显著降低,靶向EIF4E3的3’非翻译区使其表达增加,进而激活TGFβ/Smad信号通路,促进慢性氧化应激引起的细胞毒性、细胞凋亡和ECM积累;而在给予miR-1298模拟物组中,miR-1298通过抑制TGF-β2/Smad4通路和激活典型Wnt通路显著改善慢性氧化应激引起的细胞毒性和凋亡,保护HTM细胞免受慢性氧化应激损伤[21]。有研究报道,在周期性机械应力刺激的HTM细胞中miR-24表达上调,靶向FURIN使其表达降低,该酶在TGFβ1的加工中起主要作用,miR-24过表达导致活化的TGFβ1合成显著降低,从而调节TM细胞对周期性机械应力的反应[22]。KNOX J等[23]在HTM细胞中发现,TGF-β2对结缔组织生长因子蛋白表达的诱导被miR-18a-5p减弱。结缔组织生长因子是小梁网细胞收缩的重要因子,在青光眼的小梁网中表达增加,并通过驱动RhoA的活化和肌动蛋白应力纤维的形成来增加TM细胞的收缩性。miR-18a-5p通过TGF-β2信号通路抑制结缔组织生长因子相关的小梁网收缩过程,被认为是青光眼的候选治疗剂。此外,有研究发现miR-29家族是小梁网中ECM表达的关键调节因子。用5 ng/mL TGF-β2刺激青光眼患者的Tenon’s囊成纤维细胞,CHIP试验结果显示TGF-β2通过抑制Nrf2与miR-29b启动子的结合来下调miR-29b的表达,从而诱导Tenon’s囊成纤维细胞增殖,表明miR-29b在调节TGF-β2对青光眼流出通路的致病作用中发挥重要作用[24]。
2.3 miRNA调控MAPK信号通路介导细胞凋亡和视网膜新生血管形成
促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是真核生物信号传导网络中的重要途径之一,在细胞增殖、分化、迁移、凋亡和血管生成中尤为重要。MAPK有4个亚族:细胞外信ERK、p38、c-Jun氨基末端激酶应激激活的蛋白激酶(c-jun N-terminal kinase,JNK)和大丝裂素活化蛋白激酶1,分别代表四条经典的MAPK通路[25]。
BEIT-YANNAI E等[26]提出,MAPKs蛋白介导小梁网释放肽,影响房水引流,从而提高眼内压。青光眼患者的视神经中也发现了p38 MAPK和SAPK/JNK的激活[27]。越来越多的研究报道青光眼中miRNA参与调控MAPK的多条信号通路,介导RGCs死亡。YANG J等[28]发现青光眼患者房水中miR-211表达显著升高,miR-211靶向下调FRS2,激活p38信号通路,增加高眼压诱导的RGCs死亡。另一项研究报道,miR-181a在H2O2处理的HTM细胞中表达显著降低,激活JNK信号通路途径并诱导细胞凋亡;给予miR-181a模拟物后,miR-181a阻断JNK信号通路,抑制H2O2诱导的HTM细胞凋亡,从而提高HTM细胞的存活率[29]。PENG H等[30]在青光眼小鼠模型中发现,miR-200a表达减少,靶向负性调控FGF7基因,进而促进MAPK信号通路相关蛋白p38、JNK和ERK表达增加,介导RGCs死亡;利用过表达的miR-200a能够抑制FGF7介导的MAPK信号通路,有效改善青光眼的视神经损伤。miR-141是miR-200家族的重要成员,参与细胞迁移、上皮间质转化、增殖、侵袭和耐药性等多种细胞过程[31]。有研究在NMDA诱导的青光眼小鼠中发现miR-141-3p表达下调,通过靶向DOK5激活MAPK信号通路使RGCs数量减少;给予miR-141-3p模拟物后,DOK5、p38、JNK和ERK表达水平均降低,抑制视网膜新生血管形成和RGCs凋亡,从而实现青光眼的损伤修复[32]。此外,在H2O2氧化应激诱导的RGC-5细胞中发现miR-100表达上调,特异性敲低miR-100能够靶向调控IGF1R基因,通过磷酸化激活AKT、ERK1/2和TrkB蛋白,介导AKT/ERK和TrkB信号通路,降低氧化应激诱导的RGC-5细胞凋亡和促进神经元轴突生长[33]。
2.4 miRNA通过其他信号通路介导小胶质细胞活化和RGCs凋亡
信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是调节细胞因子依赖性炎症和免疫的重要转录因子,参与细胞的增殖、存活、侵袭、血管生成、肿瘤炎症和免疫[34]。有研究报道,青光眼视网膜中胶质细胞和Muller细胞过度表达,这些细胞活化能刺激产生和释放细胞毒性因子,介导RGCs的死亡[35]。研究发现miR-93在急性高眼压大鼠模型的视网膜中表达显著降低,miR-93靶向STAT3的3’非翻译区使其表达增加,诱导视网膜小胶质细胞活化、炎症因子产生和RGCs死亡;在miR-93过表达和给予STAT3抑制剂的试验组中,小胶质细胞的增殖、迁移和炎症细胞因子的释放显著降低,表明miR-93通过STAT3信号通路介导青光眼中视网膜小胶质细胞的神经炎症,从而参与视神经损伤过程[36]。
Notch信号通路在细胞增殖、分化和凋亡中发挥重要作用。LI H等[37]发现缺氧条件下RGC-5细胞中miR-137表达显著减少,Notch 1是miR-137的靶向基因,miR-137过表达导致Notch 1的mRNA和蛋白质表达降低,显著加重了缺氧诱导的细胞凋亡;而抑制miR-137表达能够激活Notch 1信号通路,保护RGCs免受缺氧诱导的细胞凋亡。
3总结和展望
青光眼是世界第二大致盲眼病,诊断主要依赖于眼科检查,但疾病的早期通常是无痛、无症状的,很难被察觉,即使在发达国家,仍然有一半的青光眼患者未被早期诊断。因此,探索青光眼发生发展机制和寻找新的潜在生物标志物的研究一直备受关注。miRNA已成为多学科研究的热点,近年来针对miRNA及其相关信号通路在青光眼中的研究也越来越多。miRNA因其独特的表达模式可以靶向多种转录物,在青光眼的生理病理过程中具有交错复杂的调控网络。总结发现,miRNA通过靶向调控PI3K/AKT、TGF-β、MAPK、STAT3和Notch信号通路,介导青光眼的纤维化、RGCs死亡、ECM重塑、视网膜新生血管形成、小胶质细胞活化等生物学过程。深入研究miRNA及其相关信号通路在青光眼中的调控方式,有助于更好地了解青光眼的致病机制,为青光眼的诊疗提供新的思路和理论依据。
[参考文献]
[1]JONAS JB,AUNG T,BOURNE RR,et al.Glaucoma[J].Lancet,2017,390(10108):2183-2193.
[2]THAM YC,LI X,WONG TY,et al.Global prevalence of glaucoma and projections of glaucoma burden through 2040:A systematic review and meta-analysis[J].Ophthal⁃mology,2014,121(11):2081-2090.
[3]DOWNS JC,GIRKIN CA.Lamina cribrosa in glaucoma[J].Curr Opin Ophthalmol,2017,28(2):113-119.
[4]BURGOYNE CF,DOWNS JC,BELLEZZA AJ,et al.The optic nerve head as a biomechanical structure:A new paradigm for understanding the role of IOP-related stress and strain in the pathophysiology of glaucomatous optic nerve head damage[J].Prog Retin Eye Res,2005,24(1):39-73.
[5]HINDLE AG,THOONEN R,JASIEN JV,et al.Identifi⁃cation of candidate miRNA biomarkers for glaucoma[J].Invest Ophthalmol Vis Sci,2019,60(1):134-146.
[6]RODRIGUEZ A,GRIFFITHS-JONES S,ASHURST JL,et al.Identification of mammalian microRNA host genes and transcription units[J].Genome Res,2004,14(10A):1902-1910.
[7]FRIEDMAN RC,FARH KK,BURGE CB,et al.Most mam⁃malian mRNAs are conserved targets of microRNAs[J].Ge⁃nome Res,2009,19(1):92-105.
[8]SCHWARZ DS,HUTVÁGNER G,DU T,et al.Asymme⁃try in the assembly of the RNAi enzyme complex[J].Cell,2003,115(2):199-208.
[9]BENAVIDES-AGUILAR JA,MORALES-RODRÍGUEZ JI,AMBRIZ-GONZÁLEZ H,et al.The regulatory role of microRNAs in common eye diseases:A brief review[J].Front Genet,2023,14:1152110.
[10]ROY T,BOATENG ST,UDDIN MB,et al.The PI3K-Akt-mTOR and associated signaling pathways as mo⁃lecular drivers of immune-mediated inflammatory skin diseases:Update on therapeutic strategy using natural and synthetic compounds[J].Cells,2023,12(12):1671.
[11]XU Z,HAN X,OU D,et al.Targeting PI3K/AKT/mTOR-mediated autophagy for tumor therapy[J].Appl Microbiol Biotechnol,2020,104(2):575-587.
[12]XU K,LI S,YANG Q,et al.MicroRNA-145-5p target⁃ing of TRIM2 mediates the apoptosis of retinal ganglion cells via the PI3K/AKT signaling pathway in glaucoma[J].J Gene Med,2021,23(11):e3378.
[13]NIE XG,FAN DS,HUANG YX,et al.Downregulation of microRNA-149 in retinal ganglion cells suppresses apoptosis through activation of the PI3K/Akt signaling pathway in mice with glaucoma[J].Am J Physiol Cell Physiol,2018,315(6):C839-C849.
[14]LI R,JIN Y,LI Q,et al.MiR-93-5p targeting PTEN regulates the NMDA-induced autophagy of retinal gan⁃glion cells via AKT/mTOR pathway in glaucoma[J].Biomed Pharmacother,2018,100:1-7.
[15]SHEN Y,ZHU Y,RONG F.miR⁃200c⁃3p regulates the proliferation and apoptosis of human trabecular mesh⁃work cells by targeting PTEN[J].Mol Med Rep,2020,22(2):1605-1612.
[16]MORIKAWA M,DERYNCK R,MIYAZONO K.TGF-βand the TGF-βfamily:Context-dependent roles in cell and tissue physiology[J].Cold Spring Harb Perspect Biol,2016,8(5):a021873.
[17]SAVAGE C,DAS P,FINELLI AL,et al.Caenorhabditis elegans genes sma-2,sma-3,and sma-4 define a con⁃served family of transforming growth factor beta path⁃way components[J].Proc Natl Acad Sci U S A,1996,93(2):790-794.
[18]BUDI EH,DUAN D,DERYNCK R.Transforming growth factor-βreceptors and smads:Regulatory com⁃plexity and functional versatility[J].Trends Cell Biol,2017,27(9):658-672.
[19]SATO M,MURAGAKI Y,SAIKA S,et al.Targeted dis⁃ruption of TGF-beta1/Smad3 signaling protects against renal tubulointerstitial fibrosis induced by unilateral ureteral obstruction[J].J Clin Invest,2003,112(10):1486-1494.
[20]PRENDES MA,HARRIS A,WIROSTKO BM,et al.The role of transforming growth factorβin glaucoma and the therapeutic implications[J].Br J Ophthalmol,2013,97(6):680-686.
[21]RUIBIN W,ZHENG X,CHEN J,et al.Micro RNA-1298 opposes the effects of chronic oxidative stress on human trabecular meshwork cells via targeting on EIF4E3[J].Biomed Pharmacother,2018,100:349-357.
[22]LUNA C,LI G,QIU J,et al.MicroRNA-24 regulates the processing of latent TGFβ1 during cyclic mechani⁃cal stress in human trabecular meshwork cells through direct targeting of FURIN[J].J Cell Physiol,2011,226(5):1407-1414.
[23]KNOX J,BOU-GHARIOS G,HAMILL KJ,et al.MiR-18a-5p targets connective tissue growth factor expres⁃sion and inhibits transforming growth factorβ2-in⁃duced trabecular meshwork cell contractility[J].Genes,2022,13(8):1500.
[24]RAN W,ZHU D,FENG Q.TGF-β2 stimulates Tenon's capsule fibroblast proliferation in patients with glaucoma via suppression of miR-29b expression regu⁃lated by Nrf2[J].Int J Clin Exp Pathol,2015,8(5):4799-4806.
[25]CARGNELLO M,ROUX PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J].Microbiol Mol Biol Rev,2011,75(1):50-83.
[26]BEIT-YANNAI E,SHMULEVICH A.Does the aque⁃ous humor have a role in mitogen-activated protein ki⁃nase(MAPK)intracellular signaling in Glaucoma?[J].Med Hypotheses,2007,68(2):299-302.
[27]MAMMONE T,CHIDLOW G,CASSON RJ,et al.Ex⁃pression and activation of mitogen-activated protein ki⁃nases in the optic nerve head in a rat model of ocular hypertension[J].Mol Cell Neurosci,2018,88:270-291.
[28]YANG J,WANG N,LUO X.Intraocular miR-211 exac⁃erbates pressure-induced cell death in retinal ganglion cells via direct repression of FRS2 signaling[J].Biochem Biophys Res Commun,2018,503(4):2984-2992.
[29]WANG Y,ZHOU H,LIU X,et al.MiR-181a inhibits human trabecular meshwork cell apoptosis induced by H2 O2 through the suppression of NF-κB and JNK path⁃ways[J].Adv Clin Exp Med,2018,27(5):577-582.
[30]PENG H,SUN YB,HAO JL,et al.Neuroprotective ef⁃fects of overexpressed microRNA-200a on activation of glaucoma-related retinal glial cells and apoptosis of gan⁃glion cells via downregulating FGF7-mediated MAPK signaling pathway[J].Cell Signal,2019,54:179-190.
[31]GAO Y,FENG B,HAN S,et al.The roles of mi⁃croRNA-141 in human cancers:From diagnosis to treatment[J].Cell Physiol Biochem,2016,38(2):427-448.
[32]ZHANG LQ,CUI H,YU YB,et al.MicroRNA-141-3p inhibits retinal neovascularization and retinal ganglion cell apoptosis in glaucoma mice through the inactiva⁃tion of Docking protein 5-dependent mitogen-activated protein kinase signaling pathway[J].J Cell Physiol,2019,234(6):8873-8887.
[33]KONG N,LU X,LI B.Downregulation of microRNA-100 protects apoptosis and promotes neuronal growth in retinal ganglion cells[J].BMC Mol Biol,2014,15:25.
[34]YU H,PARDOLL D,JOVE R.STATs in cancer inflam⁃mation and immunity:A leading role for STAT3[J].Nat Rev Cancer,2009,9(11):798-809.
[35]SHINOZAKI Y,KOIZUMI S.Potential roles of astro⁃cytes and Müller cells in the pathogenesis of glaucoma[J].J Pharmacol Sci,2021,145(3):262-267.
[36]WANG Y,CHEN S,WANG J,et al.MicroRNA-93/STAT3 signalling pathway mediates retinal microglial activation and protects retinal ganglion cells in an acute ocular hypertension model[J].Cell Death Dis,2021,2(1):41.
[37]LI H,ZHU Z,LIU J,et al.MicroRNA-137 regulates hypoxia-induced retinal ganglion cell apoptosis through Notch1[J].Int J Mol Med,2018,41(3):1774-1782.










