C1QA 通过调节巨噬细胞极化影响血管平滑肌细胞促进动脉粥样硬化进程论文
2025-10-25 10:32:48 来源: 作者:xuling
摘要:方法构建转染C1QA-inhibitor的巨噬细胞,用氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)处理巨噬细胞诱导建立体外动脉粥样硬化模型,使用RT-qPCR方法确定C1QA在细胞模型中的表达,利用反转录定量聚合酶链式反应及酶联免疫吸附试验法测定转染C1QA-inhibitor后巨噬细胞极化的改变。
[摘要]目的研究补体C1QA链(complement C1q A chain,C1QA)对动脉粥样硬化的调节作用。方法构建转染C1QA-inhibitor的巨噬细胞,用氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)处理巨噬细胞诱导建立体外动脉粥样硬化模型,使用RT-qPCR方法确定C1QA在细胞模型中的表达,利用反转录定量聚合酶链式反应及酶联免疫吸附试验法测定转染C1QA-inhibitor后巨噬细胞极化的改变。CCK-8实验测定共培养后血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖情况,Transwell检测VSMCs细胞的迁移能力。结果C1QA基因在动脉粥样硬化细胞模型中高表达,而C1QA-inhibitor可下调巨噬细胞中C1QA mRNA的表达,并抑制巨噬细胞向M1型极化,下调M1型促炎因子肿瘤坏死因子α、白细胞介素1β和白细胞介素6的表达,促进M2型抗炎因子白细胞介素10、转化生长因子-β的表达。C1QA的下调还降低了VSMCs细胞的增殖及迁移能力。结论C1QA通过调节巨噬细胞极化影响血管平滑肌细胞的增殖,从而影响动脉粥样硬化进展。
[关键词]动脉粥样硬化;巨噬细胞;补体C1QA链;血管平滑肌细胞
动脉粥样硬化(atherosclerosis,AS)所引发的心肌梗死和中风等心血管疾病是全球常见的疾病及主要致死原因,每年死于心脑血管相关疾病的总人数超过1 500万人[1]。在AS的发生与进展中巨噬细胞直接参与了炎症反应,并参与了斑块炎症的全过程,是影响斑块稳定性变化的重要因素之一[2]。在巨噬细胞中,M1型可以分泌炎症因子,加速AS中的斑块形成;M2型可分泌抗炎因子,稳定AS血管中的斑块[3]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)位于血管中膜,当受到炎性因子等的刺激时,VSMCs会发生细胞增殖并迁移至内膜,从而导致血管内膜增生、无法正常代谢,并最终导致血管斑块破裂加速AS的进程[4]。因此,调控巨噬细胞分泌炎性因子进而影响其后续对VSMCs细胞的作用也被视为AS诊断与治疗的重要靶点。
C1q是补体系统识别蛋白,有研究表明,补体C1QA链(complement C1q A chain,C1QA)是补体系统的重要组成部分,与患者的全身炎症反应密切相关[5]。并且,C1QA是骨肉瘤肿瘤微环境的预后因素,与肝炎病毒感染以及阿尔茨海默病的发生和进展有关[6]。然而,C1QA如何通过巨噬细胞调控AS进程目前尚不清楚。
1材料与方法
1.1细胞培养
人单核细胞THP-1和人主动脉细胞VSMCs均购自ATCC细胞库。THP-1和VSMCs细胞分别培养在含有10%胎牛血清(产品目录号:10100147,Gibco公司)的RPMI-1640培养基(产品目录号:11875119,Gibco公司)中。细胞分组:Normal组,利用10 ng/mL佛波酯(phorbol-12-myristate-13-ac⁃etate,PMA)诱导THP-1细胞48 h,使其分化成巨噬细胞;ox-LDL组,在PMA诱导后使用氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导巨噬细胞建立AS细胞模型;NC-inhibitor和C1QA-inhibitor组,在ox-LDL组的基础上用NC-in⁃hibitor和C1QA-inhibitor转染巨噬细胞,所有细胞均置于37℃、5%CO2培养箱中进行培养。
1.2实验方法
1.2.1 Transwell共培养实验将VSMCs细胞(1×104个细胞/孔)接种于Transwell的下室,THP-1(1×104个细胞/孔)细胞接种到上室,将VSMCs和THP-1细胞培养24 h或48 h。吸弃培养基,用4%多聚甲醛室温固定细胞,PBS缓冲液多次清洗固定液,随后用结晶紫进行染色,多次漂洗,除去多余染料后于显微镜下观察细胞迁移数目并记录、计算。
1.2.2 CCK-8细胞增殖实验将细胞按照适宜浓度统一接种于96孔板中,细胞培养8 h后,在孔中加入CCK-8反应溶液(96992-100TESTS-F,Sigma-Aidrich公司),继续于细胞孵箱中培养1 h。随后,在450 nm处测定细胞活力,并使用OD值进行计算细胞增殖数目。
1.2.3反转录定量聚合酶链式反应(reverse tran⁃scription quantitative polymerase chain reaction,RT-qPCR)利用Trizol试剂(产品目录号:15596026,In⁃vitrogen)从细胞样本中提取各样本的总RNA。随后,利用反转录试剂盒(SO131,Thermo Fisher Scien⁃tific)反转获得cDNA。以cDNA为模板,采用ABI Prism 7500系统(Applied Biosystems)和SYBR Green Supermix(产品目录号:1708882,Invitrogen)进行qRT-PCR检测。使用2ΔΔCT计算补体C1QA链、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin 1β,IL-1β)、白细胞介素6(inter⁃leukin 6,IL-6)、白细胞介素10(interleukin 10,IL-10)、转化生长因子-β(transforming growth factor,TGF-β)、磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)基因表达水平。见表1。

1.2.4酶联免疫吸附测定(enzyme-linked immuno⁃sorbent assay,ELISA)CD86(ab242239)和CD206(ab277420)的ELISA试剂盒均购自abcam公司,按照实验说明书进行如下操作:将样品分别加于检测孔内,并立即加入试剂盒相应生物素标记的抗体,混匀后于37℃下孵育1 h。随后,甩去孔内溶液用洗涤剂重复洗涤3次,除去孔内溶液;再向样品孔中加入亲和链霉素-HRP,振荡、混匀、孵育后去除孔内液体,并洗涤3次;向反应孔中加入底物A和底物B,混合均匀后,于37℃避光孵育10 min。随后立即加入终止反应液,并在指定波长下测定各孔对应的OD值。
1.3统计方法
实验数据均使用GraphPad Prism 8软件进行统计与分析。经Shapiro-Wilk检验,计量资料符合正态分布,以(±s)表示,组间两两比较采用SNK-q检验,多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2结果
2.1 C1QA在AS巨噬细胞中的表达情况
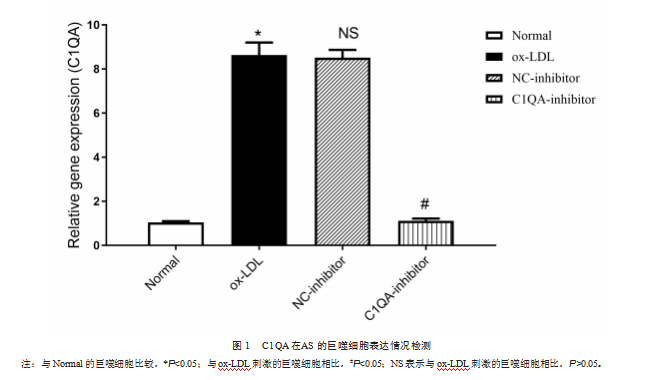
为探究C1QA对AS的调节作用,实验首先利用ox-LDL处理PMA诱导后的THP-1巨噬细胞,用以构建体外AS细胞模型。实验结果发现,相比于未经ox-LDL处理的巨噬细胞,ox-LDL处理后的巨噬细胞会高表达C1QA基因,而C1QA-inhibitor转染巨噬细胞可降低因ox-LDL处理而引起的C1QA高表达(图1)。提示在AS的巨噬细胞中,C1QA基因高表达。
2.2 C1QA对巨噬细胞极化的影响
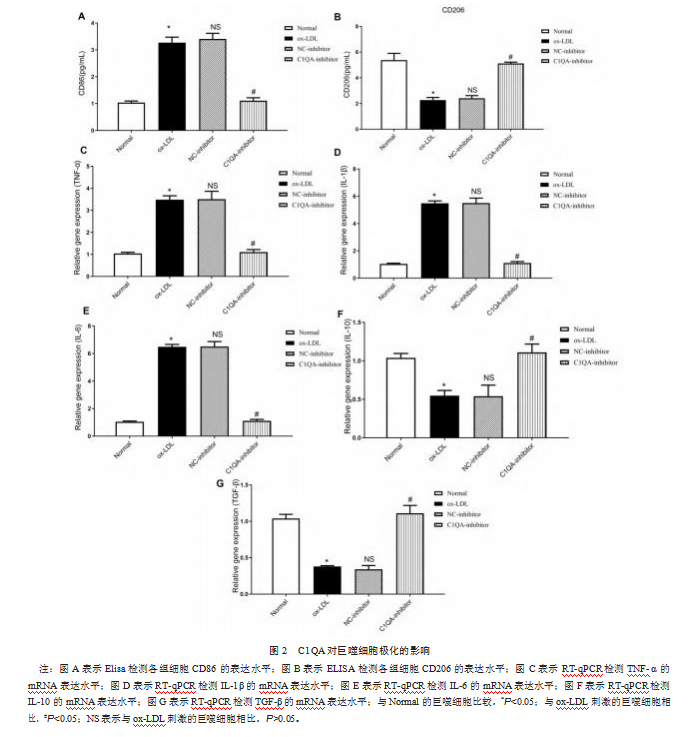
通过ELISA实验发现,ox-LDL处理的巨噬细胞会高表达M1型巨噬细胞标志物CD86,而在巨噬细胞中敲降C1QA可下调CD86的表达,并上调M2型巨噬细胞标志物CD206的表达(图2A、图2B)。同时,本研究对炎性因子的检测也证明,C1QA-inhibitor组抑制巨噬细胞向M1型极化,下调M1型促炎因子TNF-α、IL-1β和IL-6的表达,促进M2型抗炎因子IL-10、TGF-β的表达(图2C、图2D、图2E、图2F、图2G)。以上实验结果表明,敲降C1QA基因可抑制AS中的巨噬细胞向M1型极化,并抑制促炎因子的产生。
2.3巨噬细胞中的C1QA对VSMCs增殖的作用
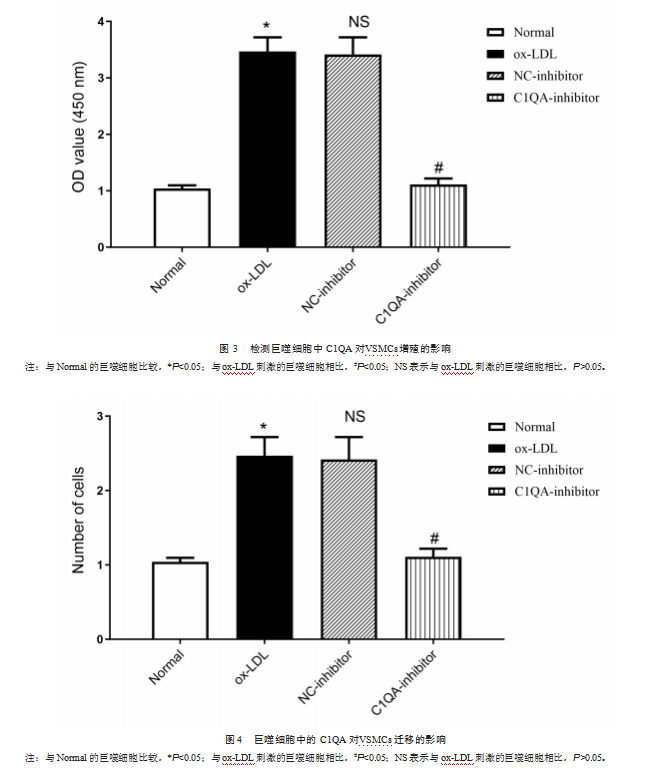
本研究利用Transwell非接触培养体系来研究AS下VSMCs和THP-1细胞之间的相互作用,将C1QA-inhibor巨噬细胞与VSMCs进行Transwell共培养,实验发现ox-LDL处理的THP-l巨噬细胞显著促进VSMCs的增殖,而敲降AS巨噬细胞模型中的C1QA,可抑制VSMCs细胞增殖(图3)。由此可见,在AS中巨噬细胞与VSMCs之间存在相互作用,巨噬细胞中的C1QA可调控VSMCs细胞增殖。
2.4巨噬细胞中的C1QA对VSMCs迁移的影响
Transwell实验发现,当ox-LDL刺激巨噬细胞时可促进VSMCs细胞迁移,而敲降AS巨噬细胞模型中的C1QA,可抑制VSMCs细胞迁移(图4)。由此可见,敲降巨噬细胞的C1QA可抑制共培养的VSMCs细胞的增殖与迁移。
3讨论
目前,心血管疾病是我国居民死亡的首要原因之一,AS是其主要病理生理过程及主要潜在病因。
心血管疾病不仅对个人健康有重大影响,而且还会加重患者家庭的经济负担。心血管疾病患者不但死亡率高,幸存下来的患者还需要接受长期的药物治疗。目前,由于缺乏有效的靶向治疗策略,心血管疾病是世界多地区死亡的主要原因。目前,口服他汀类药物可降低AS风险,但是口服药物治疗存在许多问题,包括生物利用度差、疗效慢和严重的不良反应等[7-8]。因此,寻找新的AS靶向治疗药物,对于AS的治疗来说具有重要意义。
本文探究了C1QA对AS的调节作用,以巨噬细胞为研究出发点,构建转染C1QA-inhibitor的巨噬细胞,并使用ox-LDL处理PMA刺激的THP-1细胞建立体外AS模型,检测发现转染C1QA-inhibitor会抑制巨噬细胞向M1型极化,并抑制共培养的VSMCs细胞增殖与迁移能力。VSMCs细胞的增殖与迁移参与了AS斑块的形成,而VSMCs功能障碍可加速AS进展。本研究表明,ox-LDL处理PMA刺激的THP-1细胞通过提高C1QA基因的表达促进VSMCs的增殖和迁移,而干扰C1QA表达可以抑制AS中M1巨噬细胞的极化,并影响血管微环境中的VSMCs状态,进而影响AS的进程。本研究丰富了AS治疗中巨噬细胞的分子靶标库,为心脑血管治疗提供坚实的实验及理论基础。
众多研究表明,AS是一种进行性慢性炎症性疾病,ox-LDL引起的巨噬细胞泡沫化、VSMCs的增殖和迁移是AS斑块形成的主要病理过程,其发生发展是由多种细胞及细胞因子共同作用的结果,如内皮损伤、炎症浸润和泡沫细胞形成等[9]。内皮细胞损伤和功能障碍是AS的第一步[10]。斑块病变内损伤的内皮细胞分泌促炎因子,从而刺激单核细胞分化为巨噬细胞,巨噬细胞通过其表面清除受体吞噬ox-LDL形成脂质负载泡沫细胞[11-12]。斑块区域的各种生长因子和趋化因子也促进VSMCs的迁移和增殖,这是AS疾病进展的核心[13]。迄今为止,抗炎或降脂药物已被用于降低动脉粥样硬化性心血管疾病的发病率和死亡率[14-15]。然而,该类药物的症状作用有限,并不能延缓AS的进展,由此突出了对新型AS预防和治疗药物的需求。
综上所述,本研究以ox-LDL处理巨噬细胞为AS体外研究模型,将C1QA抑制物导入到巨噬细胞中,通过一系列的分子实验研究C1QA表达量的变化对巨噬细胞极化的影响。测试了巨噬细胞中的C1QA对VSMCs增殖和迁移的影响,发现C1QA的降低可以抑制巨噬细胞的M1型极化、抑制促炎因子的产生并促进VSMCs的增殖与迁移。通过探究抑制巨噬细胞M1型极化的基因,并联合分析了其可能对VSMCs细胞增殖与迁移的影响,深化了C1QA对AS调节作用的认识,同时为现代心脑血管疾病的治疗提供了新的可能性。
[参考文献]
[1]杜恕平,王保爱.动脉粥样硬化性脑梗死临床诊治的研究进展[J].山东医药,2020,60(16):111-114.
[2]王建茹,李晓辉.基于单细胞RNA测序技术筛选颈动脉粥样硬化中巨噬细胞特征基因的研究[J].医学研究生学报,2022,35(10):1014-1021.
[3]陶晓芳,王雅洁,王文斌,等.丝裂原激活蛋白激酶激酶激酶激酶4在动脉粥样硬化易损斑块形成中的调节作用[J].实用医学杂志,2022,38(11):1346-1352.
[4]庄文雯,杨咏琪,李洪亮,等.动脉粥样硬化过程中核因子E2相关因子2对血管平滑肌细胞的调控作用[J].浙江大学学报(医学版),2021,50(3):390-395.
[5]刘莹,汪静仪,王宇,等.补体C1q在胶质母细胞瘤替莫唑胺耐药中的作用及机制研究[J].中国药物滥用防治杂志,2024,30(5):825-830.
[6]林思彤,张凤友,陈肖瑜,等.C1QA在原发性肝细胞癌中的表达及临床意义[J].医学信息,2022,35(19):30-34.
[7]于晓东,杨飞云,刘美霞,等.中西降脂药物治疗动脉粥样硬化研究的现状[J].心血管康复医学杂志,2022,31(3):387-391.
[8]雷朝福,吴小英,胡金菊.他汀类联合非诺贝特治疗混合型高脂血症和致动脉粥样硬化血脂异常的社区应用[J].北方药学,2016,13(11):22-23.
[9]王隐,赵庭瑞,邹瑶,等.早期动脉粥样硬化中炎症细胞的分布情况[J].中国药理学通报,2022,38(7):1043-1052.
[10]田晶,蔡欣池,任晶,等.内皮细胞功能障碍参与动脉粥样硬化发病的研究进展[J].生理科学进展,2021,52(5):357-361.
[11]杨楠,李玉成,海鹏丽,等.巨噬细胞极化及其代谢在动脉粥样硬化中的研究进展[J].中国实验诊断学,2025,29(1):110-116.
[12]刘洋,孙岳,杨安宁,等.铁死亡参与高脂饮食诱导的ApoE-/-小鼠动脉粥样硬化及ox-LDL诱导的泡沫细胞形成过程[J].实用医学杂志,2021,37(5):585-590.
[13]杨桐.FKNN/CX3CCR1在血管平滑肌细胞成骨转化及动脉粥样硬化性钙化中的作用和分子机制研究[D].重庆:陆军军医大学,2020.
[14]张建环.不同剂量阿托伐他汀对老年冠心病患者血管内皮功能及炎性指标影响[J].中国药物与临床,2021,21(13):2286-2287.
[15]耿嘉男.基于人参皂苷Rg3与瑞舒伐他汀不同内皮保护机制的二者联用抗动脉粥样硬化作用研究[D].长春:吉林大学,2020.










