中山市217例单克隆抗体药物不良反应分析论文
2025-10-11 16:05:53 来源: 作者:xuling
摘要:单抗药物所致ADR受患者的性别、年龄、原患疾病及身体状况等影响,多数ADR发生在患者住院治疗期间,累及多个器官或系统,对患者危害大,应引起关注,加强临床用药管理,做好应对措施,以降低ADR发生。
摘要:目的探讨单克隆抗体药物(以下简称单抗药物)所致药物不良反应(adverse drug reaction,ADR)发生的规律及特点,为临床合理用药提供参考。方法以2012年1月1日—2022年12月31日为时间范围,中山市为研究地区,“单抗”为检索词,在国家药品不良反应监测系统中检索,提取单抗药物所致的药物不良反应数据,剔除上报资料中的不完整项和重复项后,得到217例单抗药物所致ADR,并进行分析。结果217例ADR中,男109例,女108例;男女比例为1.01:1;多见于45~64岁年龄段(占37.79%);引发ADR的单抗共涉及22种药物,以利妥昔单抗最多,有76例(占35.02%);ADR多发生于用药1d之内,有126例(占58.06%);ADR主要累及全身性反应(占29.09%)、皮肤及其附件(占25.00%)、消化系统(占10.82%)、呼吸系统(占9.86%)及血液系统(占9.13%),主要临床表现为皮疹、瘙痒、寒战、发热、恶心、呕吐、胸闷、气促等;严重的ADR有103例(占47.47%),新的严重ADR有13例(占5.99%)。单抗药物所致的ADR经对症治疗后,好转以及痊愈的总体有效率为95.85%。结论单抗药物所致ADR受患者的性别、年龄、原患疾病及身体状况等影响,多数ADR发生在患者住院治疗期间,累及多个器官或系统,对患者危害大,应引起关注,加强临床用药管理,做好应对措施,以降低ADR发生。
关键词:单克隆抗体;不良反应;分析
0引言
1975年Kδhler和Milstein建立杂交瘤细胞后,开启了单克隆抗体的研究工作。在过去的四十多年中,越来越多的单克隆抗体药物获批上市,涵盖肿瘤、免疫性疾病、抗病原体感染、代谢性疾病、神经系统性和遗传性疾病等领域[1]。随着人们对疾病研究的不断深入,越来越多的治疗性生物靶点被揭示出来,单克隆抗体药物的应用也越来越广泛。在单克隆抗体药物的临床治疗过程中,患者常常会出现与药物治疗作用无关的不良反应(ADR),而及时处理ADR可以保证患者的用药安全。本研究对中山市217例单抗药物所致ADR进行回顾性分析,通过探讨该类药物ADR发生的规律及特点,为临床合理用药提供参考。
1资料与方法
以2012年1月1日到2022年12月31日为时间范围,以中山市为研究地区,“单抗”为检索词,在国家药品不良反应监测系统中检索,提取由单抗药物所引起的药物不良反应数据,共获得256例。经过剔除上报资料中的不完整项及重复项后,得到217例ADR作为研究对象。
统计患者的性别、年龄、原患疾病、药品名称、ADR上报时间、发生时间、临床表现、报告类型、不良反应严重程度及不良反应结果等信息,并结合药品说明书、《新型抗肿瘤药物临床应用指导原则(2022年版)》、国家医保药品目录,以EXCEL软件对其进行整理归类、绘制表格,并进行统计分析。
2结果
2.1一般资料
在217例ADR中,男109例,占比50.23%;女108例,占比49.77%;男女比例为1.01:1;年龄最小者只有1月12d,最大者达到86岁,ADR的发生主要集中在45~74岁,占67.74%。发生ADR患者的性别与年龄分布见表1。
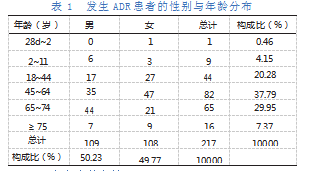
2.2原患疾病分布情况
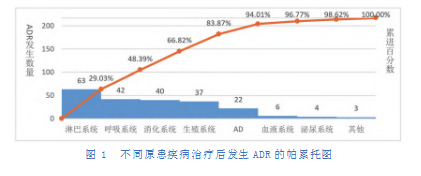
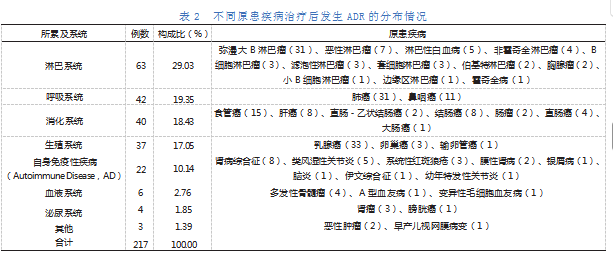
患者因不同的原患疾病使用单抗药物治疗后,发生ADR的数量亦不相同。ADR患者的原患疾病所累及的系统主要为淋巴系统、呼吸系统、消化系统及生殖系统,共占83.87%。而发生ADR数量最多的原患疾病为乳腺癌、肺癌、弥漫大B淋巴瘤及食管癌,分别占15.21%、14.29%、14.29%及6.91%。不同原患疾病治疗后发生ADR的分布情况见表2,帕累托图如图1所示。
2.3引发ADR的单抗药物品种分类
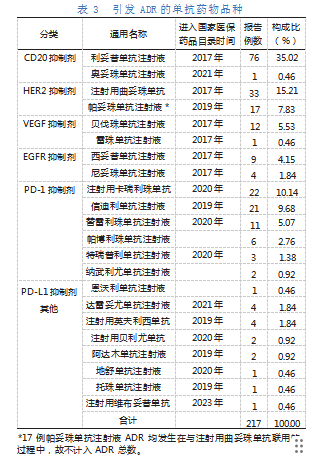
本研究共涉及21种单抗药物。引发ADR的单抗药物主要针对CD20、HER2和PD-1这三个药物靶点。其中,引发ADR最多的三个单抗药物分别为利妥昔单抗注射液、曲妥珠单抗注射液及注射用卡瑞利珠,分别占35.02%、15.21%、10.14%。引发ADR的单抗药物品种见表3。
2.4 ADR上报时间及发生时间
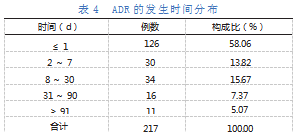
2012—2017年,ADR的上报数量每年均低于10例。2018—2022年,ADR的上报数量出现显著增长,共计187例,占86.18%。ADR上报时间年度分布情况如图2所示。
217例ADR中,发生时间在1d之内的数量最多(126例),占58.06%,表明ADR主要发生在药品输注过程中,医护人员能及时地发现患者身体的变化并作对症处理。ADR的发生时间分布见表4。
2.5 ADR所累及器官或系统及其主要临床表现
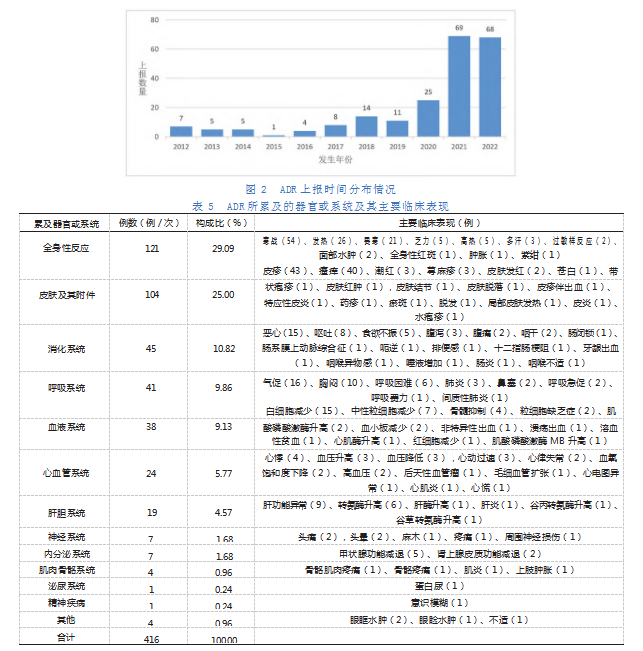
单抗药物所致ADR的临床表现主要体现为全身性反应以及皮肤及其附件、消化系统、呼吸系统及血液系统的损害,共发生349例/次,占83.89%。ADR所累及的器官或系统及其主要临床表现见表5。由于ADR的临床表现可能同时累及多个器官或系统,所以临床表现的总例数多于ADR的总例数。
2.6 ADR的严重程度及不良反应结果
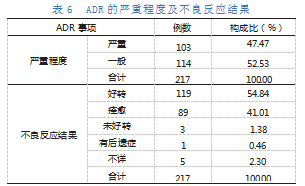
根据我国《药品不良反应报告和监测管理办法》规定,严重药品不良反应指的是用药后出现并造成下列后果之一的反应:死亡或威胁生命;使病人住院或延长住院时间;有永久的或显著的残疾或机能不全;致畸、致癌、致出生缺陷;导致其他重要的医学事件,如果不进行治疗可能出现上述所列情况的。在217例ADR中,严重的不良反应有103例,占47.47%。
ADR发生后,应及时停药并给予必要的对症治疗以避免其向不良结果发展。经停药或对症治疗后,217例ADR中的不良反应结果为好转以及痊愈的共计208例,治疗有效率为95.85%。ADR的严重程度及不良反应结果见表6。
2.7新的药物不良反应
根据我国《药品不良反应报告和监测管理办法》,新的ADR指的是药品说明书中未载明的ADR。在217例ADR中,有24例为新的ADR,占比为11.06%。
其中,严重的ADR为13例,一般的ADR为11例。
3讨论
3.1 ADR与性别、年龄及原患疾病的关系
本研究结果显示,单抗药物主要用于治疗各种类型的肿瘤,其次是用于自身免疫性疾病。于蓉等[2]的研究表明,肿瘤的发病情况存在显著的年龄与性别偏好,卵巢癌、宫颈癌及乳腺癌更常见于中年女性,而食管癌、前列腺癌及肺癌则更常见于老年男性。在治疗各类型肿瘤时,单抗药物所致的ADR也存在相似的年龄和性别偏好。
在2岁至11岁年龄段中,患者的ADR主要发生在治疗自身免疫性疾病的过程中。这可能由于儿童的器官或系统发育不完善,体内免疫系统紊乱致自身免疫性疾病高发,尤其是肾病综合征。此外,根据儿童药动学的特点,儿童在使用利妥昔单抗药物治疗肾病综合征的过程中更容易诱发ADR[3]。在18至64岁年龄段中,女性患者的ADR发生率高于男性,且以乳腺癌为主。除了遗传因素外,现代社会生活方式也会导致女性工作家庭压力大,尤其是45岁以后开始进入围绝经期的女性成了乳腺癌的高发时期[4],这促使用于治疗乳腺癌的曲妥珠单抗和帕妥珠单抗所产生的ADR明显增加。随着年龄的增大,身体各个机能开始减退,代谢水平下降,药物耐受性下降,个体差异大等因素使中老年人的ADR发生率高于年轻人,在65至74岁年龄段中,男性癌症的发病率明显高于女性,ADR发生率亦也高于女性,并且以肺癌、肝癌、食管癌为主。
3.2 ADR与单抗药物
本研究共涉及22种单抗药物,并以CD20、HER2、PD-1为靶点的单抗药物为主。CD20表达于除浆细胞(分泌免疫球蛋白的B细胞)外的发育和分化各阶段的B细胞表面,通过调节跨膜钙离子流动直接对B细胞起调节作用[5]。抗CD20单抗能特异性结合B淋巴细胞上的CD20,通过补体依赖的细胞毒性作用(complement dependent cytotoxicity,CDC)和抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC),最终导致细胞凋亡[6]。本研究涉及的抗CD20单抗包括利妥昔单抗和奥妥珠单抗,其适应证包括非霍奇金淋巴瘤、慢性淋巴细胞白血病、类风湿关节炎、韦格纳肉芽肿和显微镜下多血管炎[7],最常见的ADR有发热、寒战、皮疹、感染、中性粒细胞减少、白细胞减少等。HER2癌基因的致瘤机制:抑制凋亡,促进增殖;增加肿瘤细胞的侵袭力;促进肿瘤血管新生和淋巴管新生。抗HER2的人源化单克隆抗体可以与HER2特异性结合,通过抑制其活化或下游信号传导及激活抗体依赖性细胞介导的细胞毒性(ADCC)效应等来抑制HER2阳性乳腺癌的生长[8]。本研究涉及的抗HER2单抗包括曲妥珠单抗和帕妥珠单抗,其适应证有HER2阳性的乳腺癌和胃癌,最常见ADR有发热、恶心、呕吐、输液反应、腹泻、感染等。PD-1(程序性死亡受体1)是一种重要的免疫抑制分子,它通过向下调节免疫系统对人体细胞的反应以及抑制T细胞炎症活动来调节免疫系统并促进自身耐受。这可以预防自身免疫性疾病,但同时也能防止免疫系统杀死癌细胞。PD-1抑制剂能通过抑制PD-1与PD-L1的相互作用来激活T细胞,从而使T细胞能够识别肿瘤抗原并恢复其抗肿瘤免疫应答的功能[9-10]。本研究涉及的PD-1抑制剂包括注射用卡瑞利珠单抗、信迪利单抗注射液、替雷利珠单抗注射液、帕博利珠单抗注射液、特瑞普利单抗注射液、纳武利尤单抗注射液。其适应证有黑色素瘤、转移性非小细胞肺癌、头颈部鳞状细胞癌、霍奇金淋巴瘤、尿路上皮癌、肝细胞癌、肾细胞癌、转移性结直肠癌、鼻咽癌、胃癌等,最主要的ADR有白细胞减少、贫血、中性粒细胞减少、恶心、血小板减少、呕吐、乏力等。
单抗药物有纯度高、灵敏度高、特异性强、交叉反应少等特点,但其价格昂贵,这降低了患者使用单抗药物治疗疾病的意愿。2017年版的国家医保药品目录首次将曲妥珠单抗等8个单抗药物纳入医保。截至2023年3月,已有37个品种单抗药物进入国家医保药品目录。本研究涉及的22种单抗药物中仅帕博利珠单抗注射液、纳武利尤单抗注射液及恩沃利单抗注射液还没有进入目录。随着药品临床研究的深入,获批的单抗药物适应证以及使用量不断增加,因此ADR上报数量也呈现逐年增多的趋势。
3.3 ADR的发生时间、所累及器官或系统及其主要临床表现
单抗药物所致的ADR主要累及的器官或系统为皮肤及其附件、消化系统、血液系统及呼吸系统,主要临床表现为皮疹、瘙痒、寒战、发热、恶心、呕吐、胸闷、气促等。此类ADR临床表现症状较为明显,且多出现在患者用药一周之内。患者通常能与医护人员进行有效的沟通,及时反馈用药期间出现的各种不适症状。医护人员则通过停药或者给予地塞米松等药物进行对症治疗,以有效地缓解症状,使ADR治疗有效率达到95%以上。
然而,有患者在首次使用卡瑞利珠单抗治疗左上肺癌54d之后入院,检查发现肌酸激酶异常升高(1007U/L),可能是出现免疫治疗相关性心肌炎;亦有患者在使用特瑞普利单抗治疗肺癌89d后检查发现了严重的甲状腺功能异常(血清游离三碘甲状腺原氨酸3.25pmol/L,游离四碘甲状腺原氨酸10.15pmol/L,促甲状腺激素5.8μIU/mL)。此类迟发性的ADR,通常在停药后1月或数月之后才被发现,因此应给予高度重视,以避免患者出现不良后果。
3.4 ADR严重程度及新的严重药物不良反应个案分析
本研究共收集了217例ADR,其中严重ADR有103例,占比47.47%;一般ADR有114例,占比52.53%。这与相关研究结果存在偏差[11-12]。这种差异可能源于以下原因:一方面,一般的ADR对患者身体的影响较小,因此患者并未将其视为药物不良反应,也未及时向医护人员反馈;另一方面,医院管理者及医护人员对ADR的危害及ADR上报的重要性认识不足,导致部分一般ADR被忽视并未上报。
217例ADR中有13例新的严重ADR。例如,有患者在使用卡瑞利珠单抗治疗胸中上段食管鳞状细胞癌的过程中出现严重的血管瘤。在血管瘤内皮细胞增殖和血管生成过程中,人血管内皮生长因子(vascular endothelial growth factor,VEGF)起着极为重要的调控作用,其表达水平与血管瘤自然病程密切相关[13]。而卡瑞利珠单抗可高度特异性、低亲和力地与人血管内皮生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR2)结合[14-15],这可能致其与血管瘤的生成有关。另外,也有患者在使用利妥昔单抗治疗伯基特瘤的过程中,出现肠系膜上动脉综合征、十二指肠梗阻、肠闭锁等情况。加拿大卫生局也通报了与利妥昔单抗相关的肠梗阻及胃肠穿孔[16]。然而,目前尚不明确利妥昔单抗是否与上述药物不良反应存在因果关系[17]。
3.5 ADR的预防措施
为了降低单抗药物ADR的发生率,在临床上应做到以下几点:(1)加强单抗药物的管理。医院应强化对单抗药物的管理,规范进货渠道,保证药品的全程冷链转运,定期进行质量检查,并跟踪其质量。(2)严格按照药品说明书用药。依据丁芸兰等的研究[18],PD-1单抗用药量超过说明书要求,导致患者出现了部分ADR,与按照药品说明书用药要求相比,其发生率有所增加。(3)严格按照无菌药物配置操作流程进行单抗药物的调配或将药品送至静脉用药调配中心进行调配。合规的药物调配能减少病菌、内毒素、热原等物质的进入,有效地减少输液反应发生,从而降低ADR的发生。(4)提高医护人员及患者对ADR危害性及ADR上报重要性的认识,使患者能及时察觉并反馈用药过程中身体出现的各种不适症状,而医护人员也可立刻进行对症处理,减少ADR对患者的影响。(5)在用药过程中及用药结束后1 h内,需密切监测患者的状况,有条件的可配备心脏复苏设备,加强与患者的沟通并及时反馈患者情况,以保证其用药安全。(6)迟发性ADR一般出现在用药后30d甚至数月之后,对于这些ADR应给予高度重视[19]。医院可与药品生产企业或药品临床试验机构一同建立患者用药出院后门诊随访或电话随访制度,以了解药物对患者的长期影响。
综上所述,单抗药物所致ADR受患者的性别、年龄、原患疾病及身体状况等影响,多数ADR发生在患者住院治疗期间,累及多个器官或系统,对患者危害大,应引起关注。为降低ADR发生率及其对患者的影响,需要加强临床用药管理,做好ADR监测以及应对措施。
参考文献
[1]付志浩,徐刚领,黄璟,等.单克隆抗体药物研发进展[J].中国药事,2021,35(11):1253-1268.
[2]于蓉,席新,王华,等.2014年至2018年我国癌症死亡偏好趋势分析[J].食管疾病,2021,3(2):120-126.
[3]王美秋,夏正坤,高春林.利妥昔单抗在儿童原发性肾病综合征中的应用[J].医学研究生学报,2020,33(4):433-437.
[4]汤志英,万芳.乳腺癌发病流行病学影响因素调查及疗效分析[J].中国妇幼保健,2021,36(10):2349-2353
[5]蔡磊.人鼠嵌合B7-2抗体对狼疮样肾病型的免疫干预效应及分子机制研究[D].苏州大学,2015.
[6]李亚军,刘禹婷,周辉,等.利妥昔单抗联合大剂量甲氨蝶呤在原发性中枢神经系统淋巴瘤的应用[J].循证医学,2018,18(2):78-82.
[7]Salles G,Barrett M,FoàR,et al.Rituximab in B-Cell Hematologic Malignancies:A Review of 20 Years of Clinical Experience[J].Advances in therapy,2017,34(10):2232-2273.
[8]郑维锋,卢创新,杨争艳.HER2阳性乳腺癌靶向药物的研究进展[J].中国肿瘤生物治疗杂志,2022,29(6):587-595.
[9]Sharpe A H,Pauken K E.The diverse functions of the PD1 inhibitory pathway[J].Nat rev immunol,2018,18(3):153-167.
[10]Sun C,Mezzadra R,Schumacher TN.Regulation and Function of the PD-L1 Checkpoint[J].Immunity,2018,48(3):434-452.
[11]徐旭,黄新恩.我院单抗类抗肿瘤药致不良反应148例分析[J].中国药房,2016,27(32):4512-4514.
[12]杨澍,史海雯,高秀清,等.单克隆抗体药物致不良反应132例文献分析[J].中国药房,2015,26(23):3223-3225.
[13]李辰,赵怡芳,张文峰,等.血管内皮生长因子在血管瘤增殖及血管生成中的作用[J].中华口腔医学杂志,2004(2):84.
[14]Finlay W J J,Coleman J E,Edwards J S,et al.Anti-PD1'SHR-1210'aberrantly targets pro-angiogenic receptors and this polyspecificity can be ablated by paratope refinement[J].MAbs,2019,
11(1):26-44.
[15]孙星,杨昌永,林侃,等.卡瑞利珠单抗,一种人源化抗PD-1 IgG4亚型单克隆抗体在临床前研究中表现出优异的抗肿瘤活性以及良好的安全性(英文)[J].Journal of Chinese Pharmaceutical Sciences,2021,30(5):393-408.
[16]加拿大通报利妥昔单抗致肠梗阻和穿孔的不良事件[J].中国药物警戒,2007(1):56.
[17]秦寅鹏,陈凡,张弋.利妥昔单抗致肠梗阻不良反应1例[J].中国医院药学杂志,2018,38(22):2384-2385.
[18]丁芸兰,林映仙,周海辉,等.PD-1单抗治疗非小细胞肺癌临床应用与安全性的真实世界研究[J].中国药师,2020,23(5):895-899.
[19]Han M,Diao Y Y,Jiang H L,et al.Molecular mechanism study of che mosensitization of doxor u bic in-resistant human my e loge nous leukemia cells induced by a composite polymer micelle[J].Intj pharm,2011,420(2):404-411.










