生酮饮食治疗SMARCA2基因变异所致婴儿痉挛症1例报告并文献复习论文
2025-09-23 16:04:59 来源: 作者:xuling
摘要:SMARCA2基因变异所致的婴幼儿药物难治性癫痫尽早应用生酮饮食治疗可以改善癫痫发作,进而改善患儿智力、运动发育。
摘要:目的提高对SMARCA2基因变异所致婴儿痉挛症及生酮饮食治疗的认识。方法对确诊为SMARCA2基因变异所致婴儿痉挛症的1例患儿的临床资料和治疗进行分析及文献复习。结果患儿出生后2月起出现癫痫痉挛发作。查体显示,双眼眼距略宽,双耳位置略低,软腭裂隙,双侧腹股沟斜疝,5月仍不能竖头、不能翻身,四肢肌张力低。头核磁共振提示胼胝体压部发育欠佳。脑电图显示间断高度失。基因结果显示SMARCA2基因7号、19号外显子杂合缺失变异。治疗过程中先后口服醋酸泼尼松、托吡酯、氨己烯酸,效果欠佳,给予生酮饮食后,癫痫发作明显减少,智力、运动能力有所改善。结论SMARCA2基因变异所致的婴幼儿药物难治性癫痫尽早应用生酮饮食治疗可以改善癫痫发作,进而改善患儿智力、运动发育。
关键词:生酮饮食;SMARCA2基因;婴儿痉挛症
0引言
婴儿痉挛症(infantile spasms,IS)是一种典型的灾难性癫痫性脑病,大多属于难治性癫痫[1]。目前,IS的发病机制尚不完全清楚。近年来,随着遗传学研究的不断深入,SCN2A、SCN8A、CDKL5、DEPDC5、STXBP1、GABRA、COL4A1/COL4A2、CASK等基因变异逐渐被证实与IS有一定相关性[2]。SMARCA2基因变异所致婴儿痉挛症报道甚少,SMARCA2基因变异导致的神经发育障碍疾病最常见的是Nicolaides-Baraitser综合征(NCBRS),为常染色体显性遗传。其主要临床特征为智力障碍、头发稀疏、远端指间关节肿大、特殊粗糙面容和癫痫发作等[3]。近期有文献报道,SMARCA2基因变异可导致非NCBRS表型,如非特异性的智力障碍或癫痫[4]。本文总结生酮饮食(ketogenic diet,KD)治疗SMARCA2基因变异所致婴儿痉挛症1例,并进行文献复习,以期提高对生酮饮食治疗遗传性癫痫的认识。
1临床资料
1.1研究对象
患儿女,5月1d龄,因间断抽搐3个月于2020年4月入院。生后2个月起出现抽搐发作,表现为点头、双上肢环抱样内收、手臂及手腕抖动、双下肢屈曲,每日发作10余次,每次成串发作,每串5~6下,发作后哭闹。患儿系G1P1,正常顺产,生后诊断为胼胝体发育不良、腭裂、动脉导管未闭。5月仍不能竖头、不能翻身。入院查体:体重为8.2kg,神志清楚,精神略萎靡;前囟平坦,2.0cm×2.0cm;头围为40cm,双眼眼距略宽,双耳位置略低;呼吸平稳,软腭裂隙,双肺呼吸音粗糙,心音有力,节律规整,心率为130次/min,各瓣膜区听诊未闻及明显杂音。腹软,双侧腹股沟可触及包块,2cm×2cm,质软,可还纳。无脑神经瘫痪,不能竖头、不能翻身,四肢肌力为Ⅴ级,肌张力低,双侧膝腱反射可对称引出,双侧巴彬斯基征为阴性,脑膜刺激征为阴性。
1.2辅助检查
血常规、血生化、血氨、血同型半胱氨酸检查:未见明显异常。血乳酸:4.82mmol/L,增高。肺CT、腹部彩超:未见明显异常。浅表器官超声:双侧腹股沟斜疝。心脏彩超:卵圆孔闭合欠佳,余未见异常。头核磁共振:双侧颞极蛛网膜下腔略宽;双侧脑室体部增大;胼胝体压部发育欠佳。4h视频脑电图:背景活动慢化,发作间期各导高-极高波幅不规则慢波上夹杂大量杂乱的棘波、尖波,左右不同步、不对称;间断高度失律。血尿代谢筛查:阴性。染色体核型分析:46,XX。患儿监护人同意签署知情同意书后,采集患儿及其父母的外周血,委托某检验所进行全外显子组测序(WES)及拷贝数变异(CNV)检测,发现患儿SMARCA2基因7号、19号外显子杂合缺失变异(图1)chr9:2056662-2056855、exon7、194bp缺失;chr9:2088490-2088623、exon19、134bp缺失;未发现受检者父母存在上述变异,为新生变异(De Novo),也是常染色体显性遗传。按照ACMG指南评级,具有PVS1+PS2+PM2支持证据,评级为致病性。
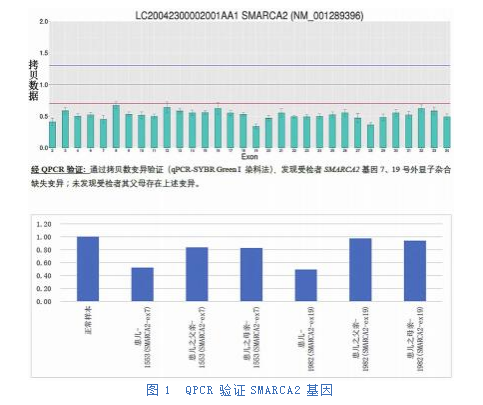
1.3诊断、治疗和随访
患儿诊断:癫痫(痉挛发作),婴儿痉挛症,SMARCA2基因相关神经发育障碍。治疗:患儿入院后静脉滴注维生素B6无效,诊断为婴儿痉挛症后,口服醋酸泼尼松35mg/d和托吡酯进行抗癫痫发作治疗。1周后略有好转,痉挛成串发作5~6次/d,每次3~6下;将醋酸泼尼松加量到50mg/d,1周后发作有所减少,痉挛成串发作3~4次/d,每次2~5下。复查脑电图仍存在间断高度失律,加用氨己烯酸联合托吡酯进行抗癫痫发作治疗。在口服醋酸泼尼松联合托吡酯、氨己烯酸的治疗过程中,发作减少,但每日仍有痉挛发作,醋酸泼尼松在应用8周后减停。患儿7月龄时(2020年6月)仍竖头不稳,不能翻身,不能独坐,四肢肌张力低,痉挛发作成串发作2~3次/d,每次2~3下。患儿利用完善血尿代谢筛查及基因检测排除生酮饮食(ketogenic diet,KD)禁忌证后,开始给予KD治疗。KD采用生酮奶,开始时,脂肪:(碳水化合物+蛋白质)的质量比为2∶1,根据患儿耐受情况逐渐调整至3∶1~4∶1,使血酮维持在3.2~5.0mmol/L,血糖维持在3.5~5.2mmol/L,口服托吡酯、氨己烯酸抗癫痫发作。KD治疗2月后(患儿9月龄时,2020年8月)发作明显减少,痉挛发作1次/d,KD治疗3月后痉挛发作数日1次。继续随访,进行生酮饮食治疗半年后,患儿痉挛发作明显减少,数日偶尔单下发作1次,减停氨己烯酸换用丙戊酸钠联合托吡酯继续进行抗癫痫发作治疗。患儿16月龄时运动发育有所进步,可竖头,在别人的帮助下可翻身,但仍不能独坐。
2讨论
SMARCA2基因位于染色体9p24.3区,包含34个外显子,编码1590位氨基酸的蛋白质,属于染色质重塑因子BRM亚单位[5],BRM属于SWI/SNF(依赖ATP的染色质重塑复合物)超家族[6-7]。SWI/SNF通过ATP水解产生的能量来改变靶基因周围的染色质结构,从而促进其他转录因子的附着,在转录、细胞分化和DNA修复等过程中起着重要作用[8]。SMARCA2基因变异导致其编码的BRM亚单位异常,表现为神经发育障碍相关疾病,最常见的是NCBRS。NCBRS最常见的临床表现:发育迟缓、语言受损;我国约2/3的患儿可发生癫痫且不易控制;典型的面部特征为面部粗糙、三角脸、人中宽且长、下颚逐渐增宽、鼻上翻伴鼻翼增厚、上唇薄而下唇增厚、嘴增宽;其他特殊外貌为体型矮小,小头畸形、指骨间关节和远端趾骨突出,随年龄增长出现皮下脂肪减少、衰老迹象、眉毛稀疏、毛发几乎缺失及手的小关节变硬伴指间关节突出[9-10]。
本例患儿临床特点不完全符合NCBRS的诊断标准,可能是SMARCA2基因变异导致的非NCBRS表型。
文献报道[11-12],SMARCA2基因变异所致的NCBRS和非特异性神经发育障碍性疾病表型中,智力障碍/发育落后的病例数占总病例数的99.3%,特殊面容占95.5%,癫痫发作占63.2%。本例患儿主要表现为腭裂、双眼距增宽、双耳位置低、脐疝、胼胝体发育不良、非特异性的智力运动障碍及癫痫发作。SMARCA2基因变异所致癫痫发作的形式有多种,如局灶性、不典型失神、肌阵挛或肌阵挛失张力、全面强直阵挛、痉挛发作等,该患儿表现为痉挛发作。该种发作类型报道较少,多种抗癫痫药物的控制效果都不理想[13]。
本例患儿提示SMARCA2基因是导致婴儿痉挛症的又一个重要基因,常合并儿童特殊面部特征、智力运动障碍及药物难治性癫痫。经过激素及多种抗癫痫药物治疗后,本例患儿的癫痫仍难以控制,但采用生酮饮食治疗后,获得了一定的控制效果。由此可见,对于SMARCA2基因变异所致的婴幼儿药物难治性癫痫尽早应用生酮饮食治疗可以改善癫痫发作,进而有益于患儿智力运动障碍的改善。
3结论
本例患儿采用生酮饮食联合多种抗癫痫药物治疗SMARCA2基因变异所致婴儿痉挛症有效。婴儿痉挛症为难治性癫痫,且为婴幼儿早发性癫痫脑病,应用生酮饮食联合抗癫痫药物治疗婴儿痉挛症,方法简便易行,家长及患儿易于接受,可提高婴儿痉挛症的缓解率,提高患儿认知水平,提高患儿的生存及生活质量。
参考文献
[1]WILMSHURST J M,IBEKWE R C,O'CALLAGHAN F J K.Epileptic spasms-175 years on:trying to teach an old dog new tricks[J].Seizure,2017,44:81-86.
[2]聂良卉,王帅,杨莉斌,等.婴儿痉挛症遗传学病因及诊疗的研究进展[J].中国医药导报,2023,20(5):33-37.
[3]刘方云,彭盼,吴腾辉,等.SMARCA2基因相关神经发育障碍疾病6例病例系列报告并文献复习[J].中国循证儿科杂志,2023,18(2):137-141.
[4]CAPPUCCIO G,SAYOU C,TANNO P L,et al.De novo SMARCA2 variants clustered outside the helicase domain cause a new recognizable syndrome with intellectual disability and blepharophimosis distinct from Nicolaides-Baraitser syndrome[J].Genet med,2020,22(11):1838-1850.
[5]SOKPOR G,XIE Y,ROSENBUSCH J,et al.Chromatin remodeling BAF(SWI/SNF)complexes in neural development and disorders[J].Front mol neurosci,2017,10:243.
[6]HARGREAVES D C,CRAB TREE G R.ATP-d e p e n d e n t c h r o m a ti n r e m o d e li n g:genetics,genomicsand mechanisms[J].Cell res,2011,21(3):396-420.
[7]VAN HOUDT J K,NOWAKOWSKA B A,SOUSA S B,et al.Heterozygous missense mutations in SMARCA2 cause Nicolaides-Baraitsersyndrome[J].Nat genet,2012,44(4):445-449.
[8]SANTEN G W,KRIEK M,VAN ATTIKUM H.SWI/SNF complex in disorder:sw itc hing f rom malignancies to intellectual disability[J].Epigeneti cs,2012,7(11):1219-1224.
[9]PRETEGIANI E,MARI F,RENIER A,et al.Nicolaides-Baraitser syndrome:defining a phenotype[J].Jneurol,2016,263(8):1659-1660.
[10]胡旭昀,郭若兰,郭俊,等.一例Nicolaides-Baraitser综合征患儿SMARCA2基因的变异分析.中华医学遗传学杂志[J],2019,36(12):1187-1190.
[11]刘晓,杨秋萍,石聪聪,等.一例母系嵌合的Nicolaides-Baraitser综合征患儿的临床特征及基因变异分析[J].中华医学遗传学志,2022,39(12):1366-1399。
[12]马燕燕,于春梅,张开慧,等.一例Nicolaides-Baraitser综合征的临床与遗传学分析[J].中华医学遗传学杂志,2020,37(2):147-149.
[13]杨理明,宁泽淑,唐静文,等.Nicolaides-Baraitser综合征1例报告并文献复习.临床儿科杂志,2019,37(5):373-377.










