中性粒细胞胞外诱捕网与慢性气道疾病的研究进展论文
2025-09-11 16:38:52 来源: 作者:xuling
摘要:中性粒细胞是人体重要的免疫细胞,其可通过释放中性粒细胞胞外诱捕网(NETs)到细胞外空间来防御病原体。
【摘要】中性粒细胞是人体重要的免疫细胞,其可通过释放中性粒细胞胞外诱捕网(NETs)到细胞外空间来防御病原体。NETs是由游离脱氧核糖核酸(cf-DNA)和抗微生物蛋白组成的大型网状结构,其通常起到杀灭病原的作用,然而过量释放的NETs也会导致组织损伤、黏膜纤毛清除受损及炎症反应增强。在常见慢性气道疾病中发现NETs含量明显升高,且NETs与气道疾病的严重程度及不良结局相关。抑制NETs的形成及相关炎症反应可能是一个重要的治疗靶点。文章描述了NETs在常见慢性肺部疾病中的作用,并表明靶向NETs可能是气道疾病的治疗策略。
【关键词】细胞外DNA,中性粒细胞胞外诱捕网,哮喘,慢性阻塞性肺疾病
中性粒细胞是人体对抗病原体的第一防线,也是先天性免疫系统中最主要的细胞。其在人体血液中占所有循环白细胞的50%~70%,在数量上远超其他免疫细胞[1]。在抗菌反应中,中性粒细胞通过脱颗粒、吞噬作用、产生细胞因子及释放中性粒细胞胞外诱捕网(NETs)来杀灭病原体[2]。NETs是近期发现的一种新型中性粒细胞抗菌的机制。NETs是一种网状结构,包括细胞外游离脱氧核糖核酸(cf-DNA)纤维的主干、组蛋白、髓过氧化物酶(MPO)、中性粒细胞弹性蛋白酶(NE)和钙卫蛋白等,它们结合在一起,捕获并杀灭包括细菌、真菌和病毒等多种病原体。然而,NETs也可能造成潜在的损害,过度产生的NETs会导组织损伤、促进炎性因子分泌及促进血小板聚集血栓形成等不良反应[3]。
慢性阻塞性肺疾病(COPD)、哮喘和支气管扩张症是具有代表性的慢性炎症性气道疾病,全球约有5.45亿人受累于这些慢性肺病[4]。虽然每种疾病的病理生理基础不同,但是它们具有共同的致病特征,包括气道炎症、气流阻塞、气道重塑和黏膜纤毛功能障碍。其中,气道慢性中性粒细胞性炎症是此类疾病的治疗难点。针对气道疾病的治疗通常包括吸入皮质类固醇和支气管扩张剂,分别治疗嗜酸性粒细胞性气道疾病和支气管收缩,而目前仍缺乏直接针对中性粒细胞性炎症的治疗。有研究表明,气道内中性粒细胞与哮喘患者皮质类固醇的耐药性及COPD的临床严重程度相关[5-6]。目前NE参与多种慢性肺病的发生发展,但其相关发病机制仍不清楚。本文讨论NETs研究的最新进展,包括NETs的生成机制、组成和功能,以及它们在COPD、哮喘、囊性纤维化及支气管扩张中的作用。
1 NETs的概述
1.1 NETs的形成及机制
NETs早在2004年就被Brinkman所报道,其形成过程通常被称为NETsosis[2]。有研究[7-8]表明NETs的释放依赖还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)的激活及活性氧(ROS)的产生,并将其定义为一种不同于细胞凋亡和坏死的中性粒细胞程序性死亡的机制。当中性粒细胞表面的补体及toll样受体(TLR)被刺激后,可激活Raf-MEK-ERK和p38-MAPK通路,导致NOX的激活和ROS的产生。随后胞浆中大量的肽酰基精氨酸脱亚胺酶4(PAD4)被活化,并导致嗜天青颗粒释放NE及MPO到细胞核。经过组蛋白的瓜氨酸化和染色质解聚[9],核膜及细胞膜在NE、MPO及ROS等物质作用下破裂,与NE、MPO等蛋白混合的染色质从中性粒细胞中释放出来并形成NETs[10],以上以中性粒细胞破裂为特征并依赖NOX的NETs产生方式称为自杀型NETsosis。而近来又有研究发现在金黄色葡萄球菌等细菌的刺激下,不依赖NOX也可迅速产生NETs[11]。在此过程中,尽管形成了NETs结构,但其质膜仍保持完整性,中性粒细胞仍然存活。这与自杀型NETsosis不同,自杀型NETsosis的质膜破裂导致细胞死亡。目前,有研究报告称TLR4和活化的PAD4对NETs的形成是必要的[12-13]。而有其他研究指出,将中性粒细胞和脂多糖(LPS)直接接触,没有TLR4的参与也会导致NETs的形成[14-15]。目前对NETsosis的机制仍然知之甚少,需要进一步研究。
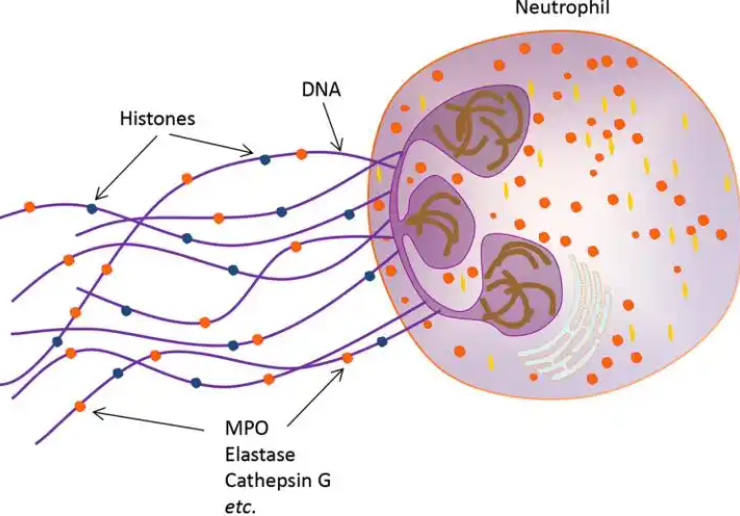
1.2 NETs的结构和特征
NETs的基本结构是以DNA为骨架及镶嵌的各种蛋白所构成的特征性网状结构[2]。经蛋白质组学分析已鉴定出330种NETs成分蛋白,包括许多抗菌颗粒蛋白和组蛋白,如NE、MPO、组织蛋白酶G、蛋白酶3、抗菌肽LL-37和钙卫蛋白等[16-17]。各组成蛋白之间通过氯化多胺和聚酰胺键交联,以确保NETs的形成既有序又可重复[18]。NETs的形成可以由多种物质刺激诱导,包括佛波酯(PMA)、LPS、细菌、真菌和一些环境因素等。而不同的刺激下形成的NETs涉及的蛋白质组成和翻译后修饰也不尽相同[19]。有研究发现PMA和钙离子载体A-23187诱导的NETs相似,而LPS诱导的NETs在蛋白质组成上则存在很大差异[20]。此外,翻译后的修饰在不同的刺激下也有所不同。因此,不同刺激下诱导的NETs可能具有不同的生物学功能。
DNA构成了NETs的骨架,过去认为其仅限于维持NETs结构的完整性。然而,最近的研究结果表明,DNA也可能在促进血栓炎症方面发挥直接作用。除了为血小板、白细胞和凝血因子的募集提供支架外,NETs的cf-DNA还可通过凝血因子XII或XI依赖性凝血途径介导脓毒症患者凝血酶的生成[21]。NETs还可以富集源自线粒体的DNA(mtDNA)。最近的研究结果表明,mtDNA还可以通过结合TLR9直接激活中性粒细胞以释放NETs[22]。因此,除了构成NETs的支架外,DNA还参与NETs所致的炎症反应及组织损伤。
组蛋白占所有NETs相关蛋白的70%[23]。在NETsosis期间,PAD4可将组蛋白的精氨酸残基转化为瓜氨酸,而瓜氨酸化会降低组蛋白稳定性,并促进染色质解聚和DNA排出[9]。PAD4依赖性组蛋白瓜氨酸化常被认为是NETsosis的关键步骤。有研究表明,细胞外组蛋白可通过与质膜磷脂的直接相互作用引起内皮细胞损伤[24]。除了直接损伤外,它们还会促进NETs介导的血栓炎症。例如,组蛋白结合TLR2和TLR4可诱导血小板活化,从而释放凝血酶。此外,组蛋白可通过激活血小板表面的αIIbβ3整合素诱导血小板发生聚集,促进血栓反应[25-26]。总之,细胞外组蛋白在NETs介导的血栓炎症和组织损伤中发挥着重要作用。
经蛋白质组学分析,NE是NETs中最丰富的非组蛋白,也是NETs发挥蛋白水解功能的主要来源[27]。NE是一种公认的肺泡-毛细血管通透性介质,它通过催化内皮细胞钙粘蛋白水解来触发微血管损伤[28]。其他蛋白酶如蛋白酶3和组织蛋白酶G等可通过调节促炎蛋白和抗炎蛋白之间的平衡来增强炎症反应。
总之,NETs结构的完整性为其功能提供了基础。在许多慢性肺部疾病发生发展中,它们与气道组织损伤,炎性因子风暴和黏液痰栓形成有关。
2 NETs和慢性气道疾病
2.1 NETs和COPD
气道中性粒细胞积聚是COPD的特征。与健康人群相比,COPD患者的气道中性粒细胞炎症明显增强。有研究表明,稳定期和加重期COPD患者的气道中NETs含量明显升高,且异常升高的NETs与COPD患者的急性加重频率和死亡率相关[29]。吸烟是COPD最常见的病因,有研究发现,烟草烟雾提取物可通过NOX2来刺激NETs的生成。在小鼠模型中也发现NETs是由香烟烟雾诱导的[30]。一项针对99名COPD受试者的研究发现,COPD患者痰液中NETs含量明显升高,且与加重频率增加和1秒用力呼气量(FEV1)减少相关。研究发现,NE、MPO和白三烯B4等NETs蛋白在COPD患者的气道聚集,且这些蛋白加剧了气道组织损伤及炎症反应[31]。其中NE含量与COPD的疾病严重程度呈正相关。有研究证明NE可通过破坏气道上皮防御蛋白使COPD患者更容易受到细菌感染。与健康对照组相比,COPD患者的NETs成分(如cf-DNA、LL-37和NE)水平以及促炎细胞因子趋化因子CXCL-8和白细胞介素1β升高[32-33]。CXCL-8通过中性粒细胞表面的C-X-C基序趋化因子受体CXCR1和CXCR2诱导NETsosis。有研究发现,当使用COPD痰液去刺激健康人体外周血后,血清NETs含量呈明显升高。而再经选择性CXCR2拮抗剂处理可显著减少NETs形成[34]。因此,NETs的细胞毒性及其降低的抗菌功能与疾病严重程度、气流受限和微生物菌群失调息息相关[35-36]。
2.2 NETs和哮喘
哮喘常以气道嗜酸性粒细胞炎症为特征。然而,最近研究发现部分哮喘患者气道以中性粒细胞炎症为主,称之为中性粒细胞性哮喘,其痰液中检测NETs含量明显升高[37-38]。在哮喘小鼠模型中,使用NE抑制剂可减轻气道炎症反应、降低气道高反应性及气道杯状细胞化[39]。因此,过敏性气道炎症的发展可能也与NE相关。有研究发现,哮喘患者血清中的钙卫蛋白水平升高,与血液中性粒细胞百分比、气道高反应性和肺功能相关[38]。2019年的一项研究调查了399例重度哮喘患者和94例健康对照者,在受试者的诱导痰液中测量cf-DNA,分为低cf-DNA组和高cf-DNA组,分别代表NETs水平高和低的患者。与低cf-DNA组患者相比,高cf-DNA组患者的哮喘控制测试评分更低,使用糖皮质激素的频率更高[33]。
鼻病毒感染是哮喘急性发作的关键诱因。有研究在小鼠模型中发现,鼻病毒感染会触发与NETs形成相关的双链DNA释放,而释放的双链DNA可介导哮喘恶化。他们发现,可以通过阻断NE或通过脱氧核糖核酸酶(DNase)处理降解来减少NETs释放。
最后,给小鼠施用内源性双链DNA,这触发了2型免疫反应,表明NETs的形成直接有助于辅助T细胞介导的2型免疫反应[40]。NETs在哮喘的病理生理过程中扮演着重要角色,但仍有未知的机制等待发掘。
2.3 NETs和囊性纤维化
研究显示,囊性纤维化(CF)患者痰液NETs含量也明显升高,其NETs抗菌蛋白MPO、NE及钙卫蛋白为主,且过多形成的NETs会导致其形成高粘度的凝胶状结构样痰液[41-42]。过去常认为NE可反映CF疾病严重程度,并且CF患者痰液具有更强的蛋白酶活性[43]。MPO则与CF不良的预后及肺功能损伤相关。与肺泡灌洗液相比,CF痰液中发现的cf-DNA水平更高,证明近端气道中性粒细胞炎症反应更加强烈[43]。有研究证明,气道NETs的异常积聚与肺功能下降、肺顺应性降低及炎症反应增强有关[44]。很明显,NETs通过多种机制参与CF的发生发展,包括炎症因子风暴、黏液痰栓形成及气道结构改变等。在最近的CF小鼠模型中发现,抑制MPO可以通过改善氧化率的方式来降低发病率。NE敲除小鼠可显著减少气道中性粒细胞增多、黏液分泌过多、杯状细胞化生和结构性肺损伤。这些研究表明,NETs在囊性纤维化肺病中起着关键作用,其具体病理生理过程仍有待发掘。
2.4 NETs和支气管扩张
支气管扩张症的主要标志之一就是中性粒细胞炎症。Angrill等[45]的研究评估了来自49名稳定支气管扩张患者和9名对照受试者的肺泡灌洗液样本中的NETs蛋白和炎症介质。与对照组相比,支气管扩张症患者的NE、MPO、肿瘤坏死因子α、CXCL-8和白细胞介素6浓度显著更高,并且这种升高的炎症特征与更高的细菌载量相关。NE是支气管扩张症疾病严重程度的生物标志物,痰中NE活性升高与疾病严重程度、加重频率、FEV1降低有关。使用抗生素治疗可降低痰液NETs水平并增强抗蛋白水解酶的能力。例如,大环内酯类药物虽然对铜绿假单胞菌缺乏直接抗菌活性,但被证明可以降低NETs水平并改善患者的临床结果。这表明在NETs的形成及作用过程中仍有未知的免疫调节作用尚未发现。
3小结与展望
中性粒细胞炎症和NETs在哮喘、慢性阻塞性肺病、囊性纤维化和支气管扩张症的病理生理学中起关键作用。尽管NETs确实具有抗菌活性,但其成分可通过提高炎症介质水平并触发中性粒细胞进一步募集到肺部来破坏免疫反应,从而加剧炎症反应。气道或肺组织中过多的NETs会对肺部造成不同程度的损害,导致肺功能受损和疾病进展加速,且这些患者病情的严重程度与气道中NETs的水平呈正相关。目前尚不确定调节中性粒细胞活化或直接靶向抑制NETss是否可以减少此类患者的疾病发生和发展。希望能通过阐明NETs的形成机制及其免疫调节方式,以期实现在未来提供新的潜在治疗靶点。
参考文献
[1]CAMICIA G,POZNER R,DE LARRAÑAGA G.Neutrophil extracellular traps in sepsis[J].Shock,2014,42(4):286-294.
[2]BRINKMANN V,REICHARD U,GOOSMANN C,et al.Neutrophil extracellular traps kill bacteria[J].Science,2004,303:1532-1535.
[3]GRÉGOIRE M,UHEL F,LESOUHAITIER M,et al.Impaired efferocytosis and neutrophil extracellular trap clearance by macrophages in ARDS[J].Eur Respir J,2018,52(2):1702590.
[4]GBD CHRONIC RESPIRATORY DISEASE COLLABORATORS.Prevalence and attributable health burden of chronic respiratory diseases,1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J].Lancet Respir Med,2020,8(6):585-596.
[5]BERRY M,MORGAN A,SHAW D E,et al.Pathological features and inhaled corticosteroid response of eosinophilic and non-eosinophilic asthma[J].Thorax,2007,62:1043-1049.
[6]PARR D G,WHITE A J,BAYLEY D L,et al.Inflammation in sputum relates to progression of disease in subjects with COPD:a prospective descriptive study[J].Respir Res,2006,7:136.
[7]HAKKIM A,FUCHS T A,MARTINEZ N E,et al.Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation[J].Nat Chem Biol,2011,7:75-77.
[8]PAPAYANNOPOULOS V,METZLER K D,HAKKIM A,et al.Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps[J].J Cell Biol,2010,191:677-691.
[9]ROHRBACH A S,SLADE D J,THOMPSON P R,et al.Activation of PAD4 in NETs formation[J].Front Immunol,2012,3:360.
[10]WANG Y,LI M,STADLER S,et al.Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation[J].J Cell Biol,2009,184:205-213.
[11]PILSCZEK F H,SALINA D,POON K K,et al.A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus[J].J Immunol,2010,185:7413-7425.
[12]CLARK S R,MA A C,TAVENER S A,et al.Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood[J].Nat Med,2007,13:463-469.
[13]MARIN-ESTEBAN V,TURBICA I,DUFOUR G,et al.Afa/Dr diffusely adhering Escherichia coli strain C1845 induces neutrophil extracellular traps that kill bacteria and damage human enterocyte-like cells[J].Infect Immun,2012,80:1891-1899.
[14]MCINTURFF A M,CODY M J,ELLIOTT E A,et al.Mammalian target of rapamycin regulates neutrophil extracellular trap formation via induction of hypoxia-inducible factor 1α[J].Blood,2012,120:3118-3125.
[15]NEELI I,DWIVEDI N,KHAN S.Regulation of extracellular chromatin release from neutrophils[J].J Innate Immun,2009,1:194-201.
[16]PETRETTO A,BRUSCHI M,PRATESI F,et al.Neutrophil extracellular traps(NET)induced by different stimuli:a comparative proteomic analysis[J/OL].PLoS One,2019,14(7):e0218946.
[17]YANG X,LI H,MA Q,et al.Neutrophilic asthma is associated with increased airway bacterial burden and disordered community composition[J].Biomed Res Int,2018,2018:9230234.
[18]CSOMÓS K,KRISTÓF E,JAKOB B,et al.Protein cross-linking by chlorinated polyamines and transglutamylation stabilizes neutrophil extracellular traps[J].Cell Death Dis,2016,7(8):e2332.
[19]CHRYSANTHOPOULOU A,MITROULIS I,APOSTOLIDOU E,et al.Neutrophil extracellular traps promote differentiation and function of fibroblasts[J].J Pathol,2014,233:294-307.
[20]ZOU Y,CHEN X,HE B,et al.Neutrophil extracellular traps induced by cigarette smoke contribute to airway inflammation in mice[J].Exp Cell Res,2020,389:111888.
[21]GOULD T J,VU T T,SWYSTUN L L,et al.Neutrophil extracellular traps promote thrombin generation through platelet-dependent and platelet-independent mechanisms[J].Arterioscler Thromb Vasc Biol,2014,34:1977-1984.
[22]LIU L,MAO Y,XU B,et al.Induction of neutrophil extracellular traps during tissue injury:involvement of STING and Toll-like receptor 9 pathways[J].Cell Prolif,2019,52(3):e12579.
[23]URBAN C F,ERMERT D,SCHMID M,et al.Neutrophil extracellular traps contain calprotectin,a cytosolic protein complex involved in host defense against candida albicans[J].PloS Pathog,2009,5:e1000639.
[24]ABRAMS S T,ZHANG N,MANSON J,et al.Circulating histones are mediators of trauma-associated lung injury[J].Am J Respir Crit Care Med,2013,187:160-169.
[25]SEMERARO F,AMMOLLO C T,MORRISSEY J H,et al.Extracellular histones promote thrombin generation through platelet-dependent mechanisms:involvement of platelet TLR2 and TLR4[J].Blood,2011,118:1952-1961.
[26]HUANG H,CHEN H-W,EVANKOVICH J,et al.Histones activate the NLRP3 inflammasome in kupffer cells during sterile inflammatory liver injury[J].J Immunol,2013,191:2665-2679.
[27]PAPAYANNOPOULOS V.Neutrophil extracellular traps in immunity and disease[J].Nat Rev Immunol,2018,18(2):134-147.
[28]O’DONOGHUE A J,JIN Y,KNUDSEN G M,et al.Global substrate profiling of proteases in human neutrophil extracellular traps reveals consensus motif predominantly contributed by elastase[J].PloS One,2013,8(9):e75141.
[29]MOERMANS C,HEINEN V,NGUYEN M,et al.Local and systemic cellular inflammation and cytokine release in chronic obstructive pulmonary disease[J].Cytokine,2011,56:298-304.
[30]ZOU Y,CHEN X,HE B,et al.Neutrophil extracellular traps induced by cigarette smoke contribute to airway inflammation in mice[J].Exp Cell Res,2020,389:111888.
[31]DICKER A J,CRICHTON M L,PUMPHREY E G,et al.Neutrophil extracellular traps are associated with disease severity and microbiota diversity in patients with chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2018,141:117-127.
[32]THULBORN S J,MISTRY V,BRIGHTLING C E,et al.Neutrophil elastase as a biomarker for bacterial infection in COPD[J].Respir Res,2019,20:170.
[33]WRIGHT T K,GIBSON P G,SIMPSON J L,et al.Neutrophil extracellular traps are associated with inflammation in chronic airway disease[J].Respirology,2016,21:467-475.
[34]PEDERSEN F,MARWITZ S,HOLZ O,et al.Neutrophil extracellular trap formation and extracellular DNA in sputum of stable COPD patients[J].Respir Med,2015,109,1360-1362.
[35]GRABCANOVIC-MUSIJA F,OBERMAYER A,STOIBER W,et al.Neutrophil extracellular trap(NET)formation characterises stable and exacerbated COPD and correlates with airflow limitation[J].Respir Res,2015,16:59.
[36]DICKER A J,CRICHTON M L,PUMPHREY E G,et al.Neutrophil extracellular traps are associated with disease severity and microbiota diversity in patients with chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2018,141(1):117-127.
[37]RAY A,KOLLS J K.Neutrophilic inflammation in asthma and association with disease severity[J].Trends Immunol,2017,38(12):942-954.
[38]LEE Y G,HONG J,LEE P H,et al.Serum calprotectin is a potential marker in patients with asthma[J].J Korean Med Sci,2020,35(43):e362.
[39]KOGA H,MIYAHARA N,FUCHIMOTO Y,et al.Inhibition of neutrophil elastase attenuates airway hyperresponsiveness and inflammation in a mouse model of secondary allergen challenge:neutrophil elastase inhibition attenuates allergic airway responses[J].Respir Res,2013,14(1):8.
[40]HAN X A,JIE H Y,WANG J H,et al.Necrostatin-1 ameliorates neutrophilic inflammation in asthma by suppressing MLKL phosphorylation to inhibiting NETs release[J].Front Immunol,2020,11:666.
[41]MANZENREITER R,KIENBERGER F,MARCOS V,et al.Ultrastructural characterization of cystic fibrosis sputum using atomic force and scanning electron microscopy[J].J Cyst Fibros,2012,11:84-92.
[42]FORREST O A,CHOPYK D M,GERNEZ Y,et al.Resistin is elevated in cystic fibrosis sputum and correlates negatively with lung function[J].J Cyst Fibros,2019,18:64-70.
[43]GUERRA M,HALLS V S,SCHATTERNY J,et al.Protease FRET reporters targeting neutrophil extracellular traps[J].J Am Chem Soc,2020,142:20299-20305.
[44]BAZ A A,HAO H,LAN S,et al.Neutrophil extracellular traps in bacterial infections and evasion strategies[J].Front Immunol,2024,15:1357967.
[45]ANGRILL J,AGUSTÍC,DE CELIS R,et al.Bronchial inflammation and colonization in patients with clinically stable bronchiectasis[J].Am J Respir Crit CareMed,2001,164(9):1628-1632.










