慢性阻塞性肺疾病急性加重期营养状态与焦虑抑郁的相关性研究论文
2025-09-05 17:09:09 来源: 作者:xuling
摘要:AECOPD患者营养状况越差,焦虑、抑郁发生率越高,常用的临床营养评估指标中仅BMI有一定的临床价值。
【摘要】目的:探讨慢性阻塞性肺疾病急性加重期(AECOPD)患者体质量指数(BMI)、营养风险筛查2002评分(NRS2002)及血清白蛋白(ALB)水平与焦虑抑郁的相关性。方法:选取2022年3月—2023年10月安徽医科大学第二附属医院收治的80例AECOPD患者作为研究对象,分别测量其身高、体重、肺功能、汉密顿抑郁量表(HAMD)、汉密顿焦虑量表(HAMA)、NRS2002评分及ALB水平,分析BMI、NRS2002以及ALB与焦虑抑郁的相关性。结果:不同AECOPD病情严重程度患者HAMD评分和HAMA评分比较,差异均无统计学意义(P>0.05)。低BMI组HAMD、HAMA评分均高于非低BMI组,差异有统计学意义(P<0.05)。相关性分析表明,焦虑抑郁与BMI相关,与NRS2002评分、ALB水平无关。结论:AECOPD患者营养状况越差,焦虑、抑郁发生率越高,常用的临床营养评估指标中仅BMI有一定的临床价值。
【关键词】慢性阻塞性肺疾病急性加重期,体质量指数,营养风险筛查2002评分,血清白蛋白,焦虑,抑郁
慢性阻塞性肺疾病(COPD)是常见的慢性呼吸系统疾病,常伴有多种肺外表现,如体重下降、营养不良和焦虑抑郁等,给患者及其家庭、社会均带来了沉重的负担。焦虑和抑郁可增加COPD患者急性加重次数,并降低患者的生活质量[1]。而营养不良同样会对患者的肺功能及呼吸肌功能产生负面影响,诱发急性发作[2]。目前,多数研究只关注COPD稳定期患者焦虑抑郁的影响因素,而慢性阻塞性肺疾病急性加重期(AECOPD)患者的营养状态与焦虑抑郁的相关性尚无相关报道。本文主要研究不同营养状况下AECOPD患者的焦虑和抑郁患病情况及其与焦虑、抑郁之间的相关性,以期能够提高AECOPD患者的生活质量,进一步改善预后,现报告如下。
1资料与方法
1.1一般资料
选取2022年3月—2023年10月安徽医科大学第二附属医院收治的80例AECOPD患者作为研究对象,其中男74例,女6例;年龄47~87岁,平均年龄(71.49±7.40)岁。纳入标准:(1)所有患者均符合COPD的临床诊断标准,并在急性加重期间住院治疗;(2)理解研究过程并自愿参与并签署知情同意书;(3)能够完成相关量表测试。排除标准:(1)患有其他已知气流受限疾病;(2)合并严重心脑血管、神经、消化、血液、泌尿以及内分泌系统等疾病;(3)在CODP诊断明确之前诊断出心理障碍,例如焦虑和抑郁疾病史或严重精神疾病史;(4)不能完成量表测试。
1.2方法
1.2.1肺功能测定所有患者经评估可耐受床旁肺功能测定。采用赛客便携式肺功能仪器X1型,由医学专业人员进行操作增加准确性。测定前6 h、12 h内分别禁用短效和长效支气管扩张药物。
(1)肺通气功能:测定第1 s用力呼气容积(FEV1)、第1 s用力呼气容积占预计值的百分比(FEV1%)预计值、用力肺活量(FVC)以及FEV1/FVC;(2)支气管舒张试验:吸入支气管舒张药物(沙丁胺醇400 ug)15~20 min后测定FEV1、FEV1%预计值、FVC及FEV1/FVC。
1.2.2测量研究对象的身高和体重依此计算体质量指数(BMI),由医学专业人员测量,每次开始前仪器均进行校准,取2次连续测量结果的平均值。
BMI分组:根据中国成人BMI分级的参考标准[3],分为低BMI组(BMI<18.5 kg/m2)和非低BMI组(BMI≥18.5 kg/m2)。其中低BMI组共36例,男性患者34例,女性患者2例;非低BMI组共44例,男性患者40例,女性患者4例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2.3营养风险筛查2002(NRS2002)评分
该筛查方法从疾病严重程度、营养状况和年龄方面进行评估。疾病严重程度的评分:1分为髋骨折或患有慢性疾病且合并肝硬化、COPD、长期血透、糖尿病、恶性肿瘤等疾病,2分为腹部大手术、卒中、重症肺炎、血液系统的恶性肿瘤,3分为头部损伤、骨髓抑制、ICU患者(APACHEⅡ>10分)。营养状况降低的评分:0分为正常营养;1分为近3个月内体质量下降>5%,近1周内进食减少>25%;2分为近2个月体质量下降>5%,近1周内进食减少>50%;3分为近1个月内体质量下降>5%,近1周内进食减少>75%,BMI<18.5 kg/m2及一般状况差。年龄≥70岁加1分。总分为营养状态、疾病严重程度、年龄3项评分总和。总分≥3分为高营养风险,总分<3分为低营养风险。
1.2.4测量血清白蛋白(ALB)水平采集患者空腹状态下外周静脉血,采用西门子白蛋白测定试剂盒(溴甲酚绿法),西门子全自动生化分析仪(ADVIA Chemistry XPT)检测血清ALB水平。
1.2.5心理状况测评由专业人员进行测评,采用汉密顿抑郁量表(HAMD)、汉密顿焦虑量表(HAMA),于肺功能测定当天完成。HAMD包括17项评分条目,评分标准:总分0~7分为正常,8~17分为可能抑郁,18~24分为肯定抑郁,≥25分为重度抑郁。HAMA包括14项评分条目,评分标准:总分0~7分为没有焦虑,7~14分为可能有焦虑,15~21分为轻度焦虑,21~29分为中度焦虑,29分以上为重度焦虑。根据焦虑及抑郁评分结果,HAMD评分>7分为有抑郁组,HAMD评分≤7分为无抑郁组;HAMA评分>7分为有焦虑组,HAMA评分≤7分为无焦虑组。
1.3统计学处理
数据采用SPSS 22.0软件进行统计分析。计量资料以均数±标准差(x-±s)表示,组间比较采用t检验,Pearson相关分析检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2结果
2.1 HAMD评分、HAMA评分、BMI值、ALB水平、NRS2002评分及肺功能结果
在本研究所纳入的80例AECOPD患者中,HAMD量表评分为(9.68±4.92)分,其中存在抑郁症状者56例(70%),肯定抑郁者6例(7.5%);HAMA量表评分总分为(11.30±6.66)分,其中存在焦虑症状者54例(67.5%),肯定焦虑者24例(30%),同时合并焦虑、抑郁者44例(55%)。所有患者平均BMI为(20.85±3.93)kg/m2,其中34例(42.50%)纳入低BMI组,46例(57.50%)纳入非低BMI组。高营养风险组(NRS2002评分≥3分)28例(35%),低营养风险组(NRS2002评分<3分)52例(65%)。平均血清白蛋白为(37.51±4.70)g/L,其中低蛋白血症组(<35 g/L)28例(35%),非低蛋白血症组(≥35 g/L)52例(65%)。根据肺功能检测结果分级,本研究中无I级COPD患者,Ⅱ级17例(21.25%),Ⅲ级35例(43.75%),Ⅳ级28例(35%)。
2.2各级AECOPD患者HAMD、HAMA评分比较
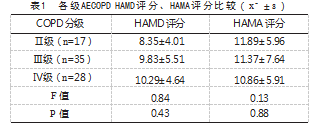
各级AECOPD患者HAMD评分和HAMA评分比较,差异无统计学意义(P>0.05),见表1。
2.3 HAMD、HAMA评分与BMI相关性分析
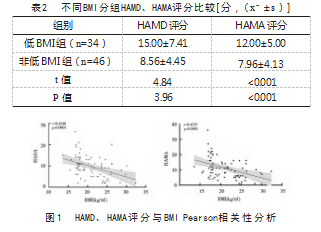
低BMI组中HAMD评分总分为(11.50±5.21)分,非低BMI组总分为(8.18±4.16),低BMI组高于非低BMI组,差异有统计学意义(P<0.001),低BMI组HAMA评分总分为(13.64±7.85)分,非BMI组评分总分为(9.39±4.81)分,低BMI组高于非低BMI组,差异有统计学意义(P<0.001)。见表2。低BMI组中肯定抑郁者有5例(13.5%),肯定焦虑者15例(40.5%);非低BMI组中肯定抑郁者1例(2.3%),肯定有焦虑者9例(20.9%)。该结果显示低BMI组合并焦虑、抑郁情绪障碍的概率更高。Pearson相关分析显示,BMI与HAMD评分(r=-0.42,P<0.001)、HAMA评分(r=-0.42,P<0.001)均存在显著相关性。见图1。
2.4 HAMD、HAMA评分与NRS2002评分相关性分析
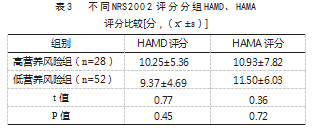
高营养风险组HAMD评分总分为(10.25±5.36)分,低营养风险组总分为(9.37±4.69)分,高营养风险组与低营养风险组差异无统计学意义,高营养风险组中HAMA评分总分为(10.93±7.82)分,低营养风险组总分为(11.50±6.03)分,两组比较,差异无统计学意义(P>0.05)。见表3。
2.5 HAMD、HAMA评分与ALB水平相关性分析
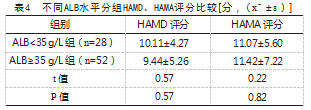
低蛋白血症组HAMD评分总分为(10.11±4.27)分,非低蛋白血症组总分为(9.44±5.26)分,低蛋白血症组与非低蛋白血症组比较,差异无统计学意义(P>0.05);低蛋白血症组HAMA评分总分为(11.07±5.60)分,非低蛋白血症组总分为(11.42±7.22)分,两组比较,差异无统计学意义(P>0.05)。见表4。
3讨论
COPD是以持续气流受限为特征的慢性气道炎症性疾病,焦虑、抑郁以及营养不良是其最常见的肺外效应。AECOPD患者因炎症反应、感染以及缺氧等导致机体处于应激与高分解的状态,出现营养不良,最终造成患者呼吸肌耐力与肌力降低,直接影响患者的呼吸功能[4-5]。有针对性地改善AECOPD患者的营养状况及心理治疗对于提高COPD患者的预后及生活质量是非常重要的。
老年COPD患者营养不良的发生率高达55.6%,发展中国家甚至高达71.5%[6],住院患者发生率更高,且与气道阻塞程度成正比。COPD患者合并焦虑抑郁的风险与肺功能之间的关系目前研究较多,既有COPD患者焦虑抑郁的发生率与COPD的严重程度成正相关的报道[7-8],也有研究显示,FEV1%pred与COPD患者焦虑抑郁无明显相关性[9]。BMI、ALB以及NRS2002评分作为常用的营养状态评价指标在临床上应用广泛,且容易操作。国外已有报道显示COPD患者的抑郁障碍与BMI的升高有显著相关性[10]。由于我国的AECOPD患者多数为有明显临床症状时才就医,而早期无临床症状或症状较轻的COPD I级患者就诊率低,且无需住院治疗,故导致本研究只纳入了COPDⅡ~Ⅳ级的AECOPD患者,且COPDⅢ~Ⅳ级患者偏多。本研究结果显示,AECOPD不同严重程度患者的HAMD评分和HAMA评分无明显差异,低BMI组AECOPD患者焦虑、抑郁的发病率显著高于非低BMI组,BMI与HAMD、HAMA评分成负相关。这意味着AECOPD患者的营养状况越差,其患焦虑、抑郁的可能性越大,且严重程度随之加重。除了BMI,NRS2002评分、ALB水平同样是临床上常用的营养评估指标,ALB水平<35 g/L时,常被认为营养不良。NRS2002是第一个基于循证医学开发的营养风险筛查工具,营养风险与该评分分值呈正相关。目前尚无ALB、NRS2002与AECOPD患者发生焦虑抑郁的相关性报道,但已有研究表明,ALB与抑郁症呈负相关,可能是抑郁症的预警指标[11]。在糖尿病合并肺结核患者中,NRS2002≥3分是抑郁的危险因素[12]。但本研究结果显示,AECOPD患者HAMD、HAMA评分与NRS2002评分、ALB水平均无相关性。这可能与本研究所纳入的病种不同、样本量较少有关。
综上所述,营养不良与AECOPD患者焦虑抑郁发生密切相关,一方面AECOPD患者因氧耗量增加,炎症消耗,内分泌失调等因素导致蛋白质/脂肪过度代谢,另一方面焦虑抑郁等不良情绪可能导致食欲不振和消化功能障碍,导致蛋白质和能量摄入减少。目前临床上常用的营养状态评估的指标中仅BMI与AECOPD患者焦虑抑郁状态具有相关性,而NRS2002评分、ALB水平的意义不大。当然,本研究也存在一些不足:第一,本研究为单中心小样本量的研究,存在一定的局限性。第二,由于某些原因,本研究仅纳入了COPDⅡ~Ⅳ级的患者,导致无法进行更多分组、未能发现肺功能分级对AECOPD合并焦虑抑郁的影响。第三,本次研究纳入患者的性别偏倚较大,女性患者比例仅7.5%。第四,焦虑抑郁的评估尚无客观检测标准,评估过程中主观因素可能会影响患者焦虑抑郁的诊断精准性。
我国COPD患者数量庞大,合并焦虑抑郁问题不容忽视,未来希望有多中心、大样本量、更全面的关于COPD患者焦虑抑郁共病营养状况的研究。以期能提高临床对AECOPD患者的情感障碍和营养状况的关注度,做到早期诊断,早期干预治疗,从而提高AECOPD患者的生活质量,进一步改善预后。
参考文献
[1]郑双双,赵静,陈雪丽.网络平台互动下的正念干预联合家庭肺康复训练对慢性阻塞性肺疾病患者肺功能、生活质量和焦虑抑郁情绪的影响[J].中国当代医药,2023,30(9):63-68.
[2]METE B,PEHLIVAN E,GÜLBAS G,et al.Prevalence of malnutrition in COPD and its relationship with the parameters related to disease severity[J].International Journal of Chronic Obstructive Pulmonary Disease,2018,13:3307-3312.
[3]中华医学会内分泌学分会,中华中医药学会糖尿病分会,中国医师协会外科医师分会肥胖和糖尿病外科医师委员会,等.基于临床的肥胖症多学科诊疗共识(2021年版)[J].中华内分泌代谢杂志,2021,37(11):959-972.
[4]郝春满,李振水,许英霞,等.常见呼吸系统疾病住院患者营养风险筛查分析[J].中国老年学杂志,2016,36(23):6014-6015.
[5]黎巍,陈立新,卜丽.老年呼吸系统疾病住院患者肠内肠外营养药物使用分析[J].临床军医杂志,2018,46(3):343-345.
[6]SEHGAL I S,DHOORIA S,AGARWAL R.Chronic obstructive pulmonary disease and malnutrition in developing countries[J].Current Opinion in Pulmonary Medicine,2017,23(2):139-148.
[7]田娟.老年慢性阻塞性肺疾病患者抑郁焦虑状况及影响因素的调查[J].世界最新医学信息文摘(连续型电子期刊),2020,20(39):190-191,195.
[8]周晓苹,方荣华.全科病房慢性阻塞性肺疾病患者焦虑抑郁状况调查及影响因素分析[J].中华全科医学,2022,20(6):1003-1006.
[9]MAURER J,REBBAPRAGADA V,BORSON S,et al.Anxiety and depression in COPD:current understanding,unanswered questions,and research needs[J].Chest,2008,134(4 Suppl):43s-56s.
[10]CHAVANNES N H,HUIBERS M J H,SCHERMER T R J,et al.Associations of depressive symptoms with gender,body mass index and dyspnea in primary care COPD patients[J].Family Practice,2005,22(6):604-607.
[11]AL-MARWANI S,BATIEHA A,KHADER Y,et al.Association between albumin and depression:a population-based study[J].Bmc Psychiatry,2023,23(1):780.
[12]LI X C,FANG X E,ZHOU L G,et al.Prevalence and factors associated with depression inpatients with Diabetes Mellitus and Pulmonary Tuberculosis(DM-PTB):a hospital-based cross-sectional study[J].International Journal of General Medicine,2023,16:3465-3472.










