基于 RNA-Seq 鉴定肾小管上皮细胞损伤时趋化因子的表达及其分子机制论文
2025-07-31 17:20:33 来源: 作者:xuling
摘要:目的探索在糖异常情况下诱导的肾小管损伤中趋化因子的表达及其分子机制。方法选取2020年1月—2021年6月深圳市龙岗中心医院的慢性肾小球肾炎和糖尿病肾病(diabetic kidney disease,DKD)患者的组织样本,各10例。
[摘要]目的探索在糖异常情况下诱导的肾小管损伤中趋化因子的表达及其分子机制。方法选取2020年1月—2021年6月深圳市龙岗中心医院的慢性肾小球肾炎和糖尿病肾病(diabetic kidney disease,DKD)患者的组织样本,各10例。使用不同浓度葡萄糖诱导人肾小管上皮细胞(human kidney 2,HK-2),建立细胞损伤模型,分别用CCK-8分析和流式细胞术检测不同糖浓度对HK-2细胞活力和细胞凋亡的影响;收集细胞RNA样本进行转录组测序分析,筛选差异表达基因并进行实验验证;定量聚合酶链反应和免疫印迹法检测趋化因子CXCL2、CCL20的表达情况。结果葡萄糖以浓度依赖性的方式降低肾小管上皮细胞活性和促进凋亡。RNA-Seq测序发现,CXCL2和CCL20是不同糖浓度诱导下肾小管细胞表达最为显著的趋化因子。在临床DKD患者活检穿刺标本中,CXCL2和CCL20的mRNA水平均高于慢性肾小球肾炎患者,差异有统计学意义(P均<0.05),蛋白水平也高于慢性肾小球肾炎患者。结论不同浓度葡萄糖诱导肾小管上皮细胞损伤导致趋化因子表达升高可能介导DKD进展。
[关键词]糖尿病肾病;趋化因子;肾小管损伤;细胞凋亡
早期糖尿病肾病(diabetic kidney disease,DKD)病理改变主要表现为肾小球病变为主。然而,越来越多的研究发现,肾小管损伤可能早于或独立于肾小球病变出现。肾小管细胞在糖尿病环境中对高血糖特别敏感,肾小管细胞受到损伤后,会释放一系列细胞因子,进一步推动肾小球、肾小管病变、间质纤维化等DKD进展[1-2]。但肾小管细胞在糖异常时的细胞因子表达情况有待进一步研究。因此,本研究旨在探讨糖异常时肾小管细胞的趋化因子表达情况及其作用,为发现新型生物标志物用以改善临床诊疗提供理论依据。
1材料与方法
1.1临床标本
选取2020年1月—2021年6月深圳市龙岗中心医院的慢性肾小球肾炎(chronic glomerulonephri‐tis,CGN)患者和DKD患者的组织样本,各10例。采用苏木精、伊红染色和CXCL2、CCL20免疫组化染色进行检测。本研究经医学伦理委员会审批,患者均知情同意。
1.2肾小管细胞损伤模型
人肾小管细胞(human kidney 2,HK-2)培养于DMEM/F12完全培养液中,即含10%FBS和1%青霉素和链霉素,在含有5%二氧化碳的37˚C培养箱中培养。随后,用不同浓度的葡萄糖处理HK-2细胞。
1.3 CCK-8分析
取对数生长期细胞进行CCK-8实验,每组3个重复。细胞经胰酶消化后计数,按每孔3 000个细胞和每孔100μl细胞悬液分别接种于96孔板。细胞贴壁后加入CCK-8检测试剂读取450 nm吸光值。
1.4细胞凋亡分析
用胰蛋白酶消化、收集细胞,悬浮于100μl的1×结合缓冲液中,用5μl Annexin V-APC室温染色5 min,再加入10μl的20μg/mL碘化丙啶室温染色5 min。悬浮于磷酸盐缓冲液中,流式细胞仪分析。
1.5 RNA提取及RNA-seq
用Trizol试剂提取总RNA。RNA测序文库由Novogene SeqHealth使用KCTM Stranded mRNA Li‐brary Prep Kit for Illumina制备。分析RNA-seq数据(log2 Fold Change≥1且P值<0.05)获得差异表达基因,绘制火山图。对DEGs进行GO分析和KEGG分析。通过蛋白质互作网络进一步筛选关键基因的相关联系。
1.6定量聚合酶链反应(qPCR)
用Trizol试剂提取各组HK-2细胞或临床新鲜标本的总RNA,使用PrimeScriptTM RT试剂盒将总RNA逆转录合成cDNA。使用2μl cDNA和SYBR®Green Realtime PCR Master Mix Kit(Toyobo)试剂盒进行PCR扩增反应,采用2-ΔΔCt法计算目的基因的相对表达量。引物序列见表1。

1.7免疫印迹检测
用添加蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取总蛋白。用BCA法进行蛋白定量。取30μg蛋白样品进行电泳后转移至PVDF膜上。封闭后在4°C孵育一抗过夜,抗-CXCL2抗体购自Santa cruz,抗-CCL20、抗体均购自Proteintech。在室温下孵育二抗,用化学发光试剂盒进行显影。
1.8免疫组化
石蜡切片脱蜡后经分级乙醇复水,行伊红染色。柠檬酸盐抗原暴露试剂中进行抗原修复,一抗孵育:抗-CXCL2(1∶100)和抗-CCL20(1∶100)在4℃孵育过夜。行DAB染色,然后用苏木精复染后扫描观察。
1.9统计方法
使用Graphpad Prism 7.0软件进行统计分析并绘制相应图表,P<0.05为差异有统计学意义。
2结果
2.1不同浓度葡萄糖对肾小管细胞活性的影响
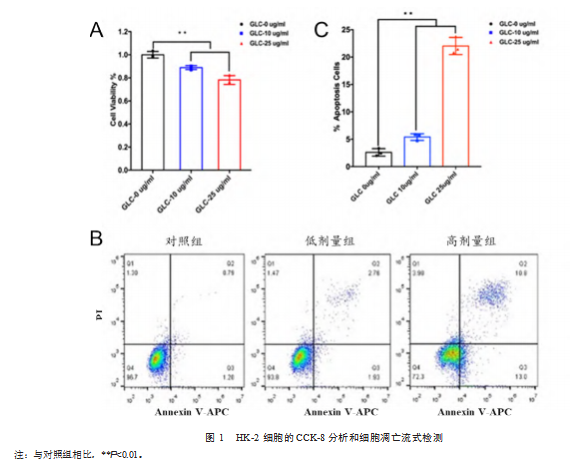
使用不同浓度葡萄糖(对照组、低剂量组和高剂量组)培养HK-2细胞。CCK-8和流式检测结果显示,与对照组相比,长期糖异常致使HK-2细胞的活力明显降低(见图1A)、凋亡细胞比例增加(见图1B、图1C),差异有统计学意义(P均<0.05),说明长期糖异常致肾小管细胞损伤。
2.2基于RNA-Seq预测不同浓度葡萄糖对肾小管细胞的趋化因子表达的影响
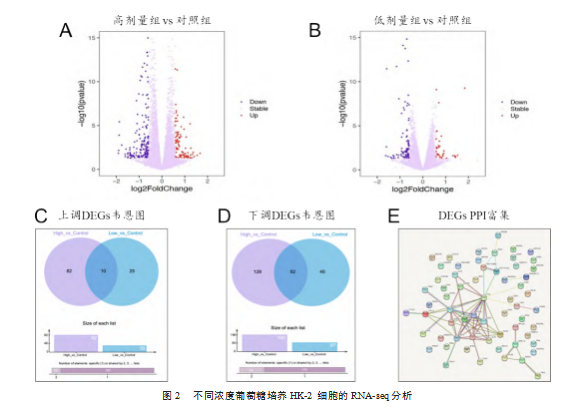
对损伤的HK-2细胞进行RNA测序分析,以log2 Fold Change≥1和P<0.05为标准,筛选具有显著差异表达的基因。火山图显示,与对照组相比,高剂量组有92个基因显著上调和180个基因显著下调,见图2A;低剂量组有35个基因显著上调和97个基因显著下调,见图2B。韦恩图显示,高剂量组和低剂量组一致上调的基因有10个,见图2C;一致下调的基因有52个,见图2D。为深入了解差异表达基因之间的相关性,将两组中一致上调和一致下调的基因进行PPI网络分析,发现趋化因子CXCL2和CCL20在蛋白互作中占据重要地位,见图2E。
2.3趋化因子CXCL2和CCL20在临床标本中的表达情况
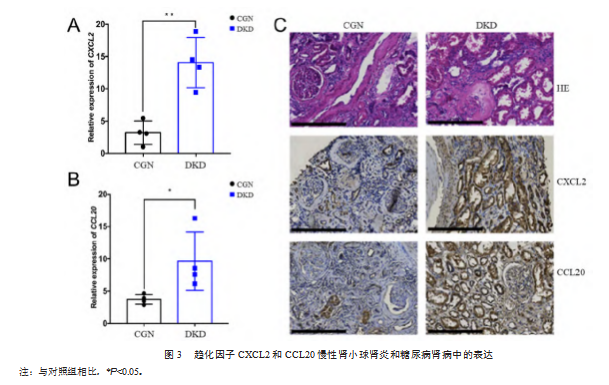
CGN和DKD患者的肾脏活检穿刺标本的总RNA进行qPCR分析,结果显示,与CGN相比,趋化因子CXCL2和CCL20的mRNA水平在DKD患者的临床组织中高表达,差异有统计学意义(P均<0.05),见图3A、图3B。肾小管损伤在CGN和DKD患者中都很明显,且程度相近,见图3C。免疫组化结果显示DKD患者肾脏切片中的趋化因子CXCL2和CCL20的蛋白水平均明显高于CGN患者,见图3C,且在肾小管上皮细胞中高表达。这些结果表明葡萄糖异常可能引起肾小管上皮细胞的CXCL2和CCL20表达增多。
3讨论
近年来,越来越多的研究表明趋化因子及其受体在DKD的发生、发展中扮演着重要角色[3-4]。趋化因子是一类具有趋化作用的细胞因子,循环中的炎症因子可触发炎症反应,而趋化因子及其受体是炎症细胞相互作用和募集的关键因素[5]。CCL2和CCL5是特异性的单核/巨噬细胞趋化因子,在DKD肾组织中表达增加,促进炎症反应[6-7]。CXCL12通过与其受体CXCR4结合发挥生物效应,构成的CXCL12/CXCR4轴在DKD的发生发展中起重要作用。CXCL12在DKD患者血清中的水平与血糖、血脂、胰岛素抵抗、高敏C反应蛋白等指标相关[8-9]。这些趋化因子通过增强慢性炎症过程,促进肾小球系膜细胞、肾小管上皮细胞等的炎症反应[10]。针对趋化因子及其受体的治疗策略正在逐步展开。例如,CCR2拮抗剂RS504393能够改善胰岛素抵抗和DKD,显示出潜在的治疗效果[11]。总之,趋化因子在DKD的发展过程中与炎症的进展密切相关。
本研究首先通过不同浓度葡萄糖培养构建肾小管细胞损伤模型,通过CCK-8和流式细胞术对细胞活力和细胞凋亡进行检测,随后应用RNA-seq技术成功筛选出差异表达的候选细胞因子。趋化因子CXCL2和CCL20在PPI网络中占据重要地位。qPCR和免疫组化结果显示,与慢性肾小球肾炎患者相比,CXCL2和CCL20的mRNA水平和蛋白水平在DKD患者的肾脏组织中明显升高,并显著性地表达于肾小管上皮细胞,这暗示糖异常可能诱导肾小管上皮细胞发生表型改变,进而导致趋化因子分泌增强,从而参与DKD的疾病进展。
[参考文献]
[1]陈莉明.聚焦肾小管损伤在糖尿病肾脏病诊治中的价值[J].中华糖尿病杂志,2021,13(10):921-925.
[2]赵力敏,杨淑芬,陈鹏飞,等.RTN1A通过ERK信号诱导肾小管上皮细胞分泌VEGF和IL-8并促进糖尿病肾病肾纤维化[J].中国病理生理杂志,2018,34(12):2233-2239.
[3]CHANG TT,CHEN JW.The Role of chemokines and chemokine receptors in diabetic nephropathy[J].Interna‐tional Journal of Molecular Sciences,2020,21(9):3172.
[4]LIU H,LIU A,KAMINGA A,et al.Chemokines in gesta‐tional diabetes mellitus[J].Frontiers in Immunology,2022,13:705852.
[5]PAN X,KAMINGA AC,KINRA S,et al.Chemokines in Type 1 Diabetes Mellitus[J].Frontiers in Immunology,2021,12:690082.
[6]DU Q,FU YX,SHU AM,et al.Loganin alleviates macro‐phage infiltration and activation by inhibiting the MCP-1/CCR2 axis in diabetic nephropathy[J].Life Sciences,2021,272:118808.
[7]LEE CP,NITHIYANANTHAM S,HSU HT,et al.ALPK1 regulates streptozotocin‐induced nephropathy through CCL2 and CCL5 expressions[J].Journal of Cellu‐lar and Molecular Medicine,2019,23(11):7699-7708.
[8]SONG A,JIANG A,XIONG W,et al.The role of CXCL12 in kidney diseases:A friend or foe?[J].Kidney Diseases,2021,7(3):167-176.
[9]李永妍,王颖,常江,等.CXCL12/CXCR4在肾脏疾病的表达及作用研究[J].包头医学院学报,2023,39(7):91-96.
[10]胡泽波,马坤岭,张洋,等.炎性反应激活CXC型趋化因子配体16信号通路进而促进糖尿病肾病进展[J].中华肾脏病杂志,2016,12:913-921.
[11]KANG YS,LEE MH,SONG HK,et al.CCR2 antago‐nism improves insulin resistance,lipid metabolism,and diabetic nephropathy in type 2 diabetic mice[J].Kidney International,2010,78(9):883-894.










