宫颈鳞状细胞癌中肿瘤浸润淋巴细胞与瘤芽关系的研究进展论文
2025-07-31 16:46:22 来源: 作者:xuling
摘要:本研究旨在为未来深入探索TILs和瘤芽的作用机制及其在肿瘤治疗中的应用奠定了基础。
[摘要]近年来,宫颈鳞状细胞癌中的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)与瘤芽之间的研究成为肿瘤微环境领域的前沿课题,受到广泛关注。本文细评述了TILs在肿瘤微环境中的作用机制,分析了其与肿瘤细胞的交互作用模式。这些免疫细胞不仅通过直接的细胞毒性作用影响肿瘤细胞,还通过分泌细胞因子调节肿瘤微环境,相应地影响瘤芽的形成与发展。本文归纳了TILs与瘤芽在宫颈鳞状细胞癌进展中的协同效应,探讨了二者共同参与的免疫调控路径。同时,分析了将TILs和瘤芽作为联合靶点的研究前景,指出通过调节这两种病理指标的新型免疫治疗策略的潜力。针对性地调控TILs的浸润及瘤芽的形成,可能成为提高宫颈鳞状细胞癌治疗效果的重要方向。本研究旨在为未来深入探索TILs和瘤芽的作用机制及其在肿瘤治疗中的应用奠定了基础。
[关键词]宫颈鳞状细胞癌;肿瘤浸润淋巴细胞;瘤芽
宫颈鳞状细胞癌是全球女性中常见且危害严重的恶性肿瘤之一,其发病和进展受到多种因素的共同影响。近年来,随着对肿瘤微环境研究的深入,肿瘤浸润淋巴细胞(tumor infiltrating lympho‐
cytes,TILs)和瘤芽作为评估肿瘤生物学行为的重要指标,逐渐引起了广泛关注。现有研究表明,TILs和瘤芽对宫颈鳞状细胞癌的侵袭性和患者预后有着重要指示作用[1]。然而,二者在病理上的具体表现和相互作用机制尚不明确。因此,本研究旨在系统分析TILs与瘤芽在宫颈鳞状细胞癌中的角色,及其协同作用对肿瘤预后的影响,通过对多项相关文献的综合分析,明确了TILs的不同类型(如T细胞、B细胞和自然杀伤细胞)在肿瘤免疫应答中可能扮演的角色,以及它们与瘤芽形成之间的潜在关系[2]。具体来说,对高密度TILs和瘤芽数量在肿瘤发展过程中的变化进行了重点探讨,希望能揭示它们作为预后指标的潜在机制。这项研究的意义在于为临床上采用更精准的肿瘤评估方法及个性化治疗策略提供理论基础和数据支持。研究结果旨在深化对宫颈鳞状细胞癌微环境的理解,丰富现有的肿瘤生物学知识体系,并在肿瘤免疫治疗领域中发挥积极作用。
1早期浸润性鳞状细胞癌的组织病理学特征
早期浸润性鳞状细胞癌是一种介于宫颈鳞状上皮内病变(cervical intraepithelial neoplasia,CIN)和明显浸润性癌之间的过渡性病变,其组织病理学特征对于肿瘤的诊断和治疗具有重要的临床意义。早期浸润性鳞癌与CIN的病理表现具有一些共同特征,但也存在显著的区别[3]。在组织学上,早期浸润性鳞状细胞癌的肿瘤边缘呈现不规则锯齿状突起,这是其典型的形态学特征之一。这种边缘的不规则性往往反映出肿瘤细胞的侵袭性生长,提示潜在的间质浸润。此外,早期浸润性鳞癌中常见异常角化细胞,这些细胞位于肿瘤边缘,细胞质呈现嗜酸性,或表现出明显的角化改变。这种异常角化的现象是肿瘤细胞分化异常的表现,提示细胞功能的改变。伴随肿瘤生长的,还有肿瘤周围结缔组织的增生和炎性细胞浸润,提示机体对肿瘤的反应性改变。然而,尽管上述形态学改变提供了重要的诊断线索,但单凭这些特征性表现并不能充分判断间质浸润的程度,这给早期浸润性癌的病理诊断带来了挑战[4]。
2瘤芽的定义与鉴定
瘤芽是一类重要的病理现象,是指发生于原发灶边缘或侵袭前缘间质内散在的像芽孢一样的呈未分化形态的的单个或几个肿瘤细胞,一般包括1-4个[5]。因其与肿瘤的侵袭和转移能力密切相关,其在实体瘤中的应用也日益受到关注。病理上,瘤芽的鉴别需要在显微镜下仔细观察,其鉴别依据主要是肿瘤的染色特性及细胞形态。瘤芽通常是小而不规则的细胞团,它从肿瘤的主体组织中分离出来,并侵袭到周围的间质[6]。为保证瘤芽的准确识别,病理学学者常通过多层次的技术手段(如H&E染色等)来明确瘤芽的存在及分布,有时常与分化不好的间质细胞混淆,上皮标记CK染色可以清楚地显示肿瘤出芽[7]。肿瘤出芽的划分主要是根据肿瘤的数目及分布来确定。在肿瘤病理学评价中,瘤芽数是定量评价肿瘤侵袭力的重要指标[3]。
3肿瘤浸润淋巴细胞与瘤芽的相互作用
3.1 TILs与肿瘤在肿瘤微环境中的交互作用
3.1.1 TILs如何影响肿瘤的形成和发展TILs是一类重要的肿瘤相关抗原,可通过其对肿瘤细胞的免疫监控及免疫调控作用而发挥作用。TILs由CD8+T、CD4+T、调节性T细胞和自然杀伤细胞等组成。肿瘤微环境是肿瘤发生发展过程中的重要环节,也是肿瘤治疗领域研究的热点[8]。首先,TILs中最主要的效应细胞是CD8+T细胞,其主要功能是与肿瘤细胞表面抗原结合,释放出大量的杀伤因子,如穿孔素、颗粒酶等,从而实现对癌细胞的杀伤。但肿瘤细胞可通过高表达程序性死亡配体1(pro‐grammed cell death ligand 1,PD-L1)等免疫抑制因子逃逸T细胞杀伤。前期研究发现,在肿瘤组织中,某些肿瘤细胞在免疫监控下降时,具有更高的增殖、侵袭能力[9]。相关前期研究发现,TILs可通过其分泌的多种细胞因子,间接调控肿瘤的发生与进展。干扰素γ是一种具有抗癌作用的细胞因子,可通过活化巨噬细胞、树突状细胞(dendritic cells,DC)等细胞发挥抗肿瘤作用。但高剂量干扰素γ(interferon gamma,IFN-γ)会诱发肿瘤细胞产生上皮-间质转化(epithelial-mesenchymal transition,EMT),进而促进肿瘤蜕变。转化生长因子β(trans‐forming growth factor-β,TGF-β)是TILs中普遍存在的一种细胞因子,它除了自身的免疫调控作用外,还可通过诱导EMT增强肿瘤浸润[10-11]。
3.1.2肿瘤出芽如何调控TILs的活性和功能肿瘤细胞并非只是一种被动应答分子,其还可调节TILs在肿瘤微环境中的活性与功能。肿瘤发生可通过调控肿瘤微环境中的信号通路及细胞之间的交互作用,有效降低TILs的杀伤效果,进而促进肿瘤的发展与转移。首先,肿瘤病变可通过上调PD-L1等免疫检查点来抑制TILs的活化。PD-L1可通过与T细胞表面PD-1受体结合,抑制T淋巴细胞的增殖及杀伤,使其不能充分发挥抗肿瘤效应。BENGSCH B等[9]研究表明这一机制使肿瘤细胞能够在肿瘤细胞的免疫抑制状态下生存并传播。其次,肿瘤出芽也可以通过分泌一些免疫抑制因子调节TILs的功能。比如,肿瘤出芽区调节性T细胞可分泌TGF-β,其既可诱导肿瘤发生EMT,又可抑制TILs效应,从而减弱机体对肿瘤的监视作用。此外,肿瘤微环境中的白细胞介素10(interleukin10,IL-10)等炎症因子亦可通过不同方式抑制T细胞的激活及功能,使TILs丧失对肿瘤的控制[11]。
3.2 TILs与瘤芽在宫颈鳞状细胞癌进展中的协同效应
3.2.1 TILs和瘤芽共同影响肿瘤侵袭和转移的机制TILs与瘤芽协同作用于子宫颈鳞癌的侵袭转移。首先,肿瘤细胞常伴有EMT,而EMT则可增强肿瘤细胞的迁移、侵袭能力,是其转移的重要环节。肿瘤浸润性TILs是肿瘤免疫逃逸的重要机制。肿瘤微环境中,肿瘤浸润性T淋巴细胞可通过高表达PD-L1等免疫检查点分子,从而影响TILs功能,进而影响肿瘤浸润。因此可通过抑制肿瘤细胞内的免疫反应,促使肿瘤细胞生长,进而促进其侵袭转移[12]。其次,肿瘤微环境中TILs的功能状况是影响肿瘤芽生发生的关键因素。研究发现,肿瘤微环境中存在大量的TILs,提示机体的免疫应答可能会抑制肿瘤细胞的生成与转移。反之,若TILs功能被抑制或降低,则肿瘤细胞的密度会明显升高。QUAIL DF等[11]研究表明,TILs的功能下降与肿瘤微环境中TGF-β、IL-10等免疫抑制因子的表达及Tregs的增殖密切相关。另外,肿瘤微环境中的其他成份也在其中起着重要作用。肿瘤发生可通过分泌VEGF、CXCL12等多种细胞因子,在肿瘤发生发展过程中起到重要作用。因此,肿瘤细胞在新生血管形成的“免疫屏障”中,可以逃逸机体的免疫监控,从而降低其功能[13]。此外,TILs还能分泌IFN-γ等细胞因子,发挥抗肿瘤效应,但肿瘤微环境中存在大量的免疫抑制性因素[12]。
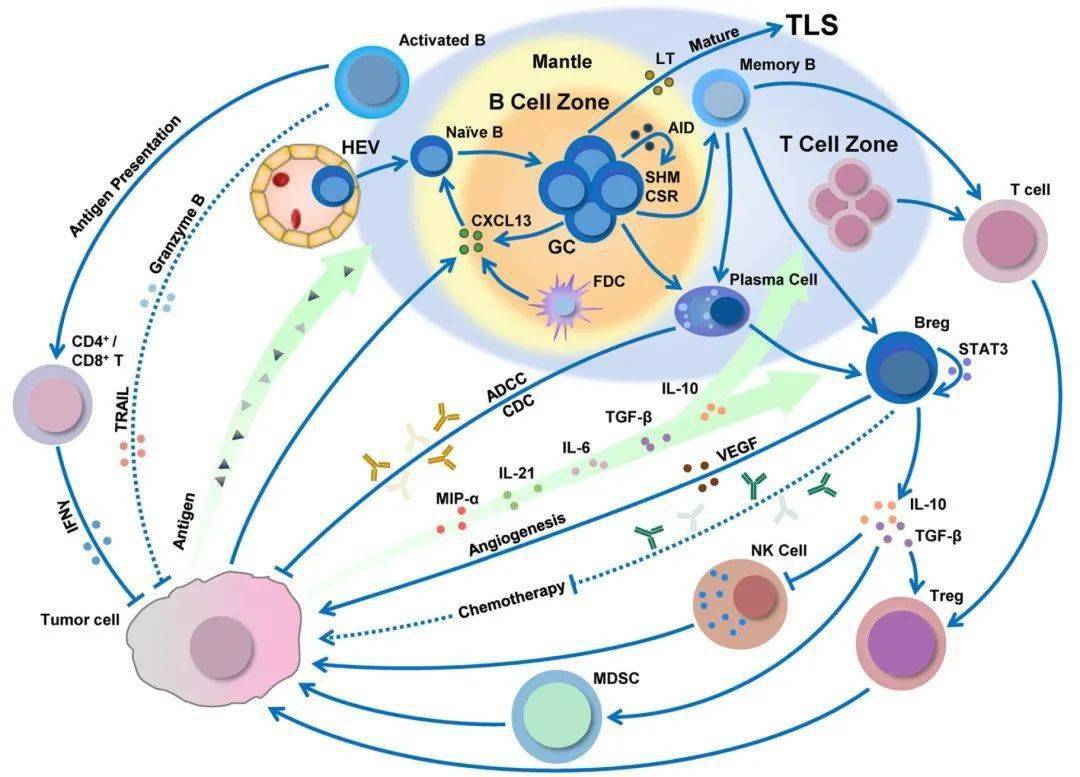
3.2.2 TILs与瘤芽在预测宫颈鳞状细胞癌预后中的综合应用高密度的TILs通常被视为一种良好的预后标志,提示患者可能具有更强的抗肿瘤免疫反应,从而降低肿瘤的侵袭性和转移风险。相反,高密度的瘤芽则常常预示着不良预后,尤其是与高风险的局部浸润和远处转移相关。因此,在临床实践中,TILs和瘤芽的联合评估可以提供更为全面的肿瘤侵袭性和患者预后评估。在食管鳞状细胞癌中,TILs和瘤芽的联合评估有助于对肿瘤的侵袭潜力和转移风险进行更准确的判断。例如,若患者肿瘤组织中检测到高密度的TILs但瘤芽密度较低,这通常意味着较低的侵袭和转移风险,预后相对较好。张继方等[14]研究显示若患者肿瘤组织中同时存在高密度的TILs和瘤芽,这提示肿瘤细胞可能已经通过免疫逃逸机制部分克服了免疫监视,具有较高的侵袭和转移潜力。因此,这一情况往往预示着患者的预后不佳,需要更积极地治疗干预。此外,TILs和瘤芽的综合评估还可用于指导免疫治疗策略的制定。当前,免疫检查点抑制剂(如PD-1/PD-L1抑制剂)已被广泛用于治疗多种类型的癌症,包括宫颈鳞状细胞癌[15]。在瘤芽密度高的情况下,联合应用免疫检查点抑制剂可能有效恢复TILs的功能,增强抗肿瘤免疫反应,从而抑制瘤芽的生长和扩散。
3.3 TILs和瘤芽的潜在靶点和治疗策略
3.3.1 TILs和瘤芽作为联合靶点的研究前景目前关于TILs与肿瘤癌变的协同作用机制研究较多,但仍缺乏明确的生物标记物。基于肿瘤微环境中TILs与肿瘤发生关系紧密,以此为目标的免疫治疗研究不断发展。因此,以TILs为基础,探索TILs与肿瘤免疫反应协同作用的新型肿瘤免疫治疗疗效的预测标志物具有重要意义。肿瘤微环境可通过PD-L1等免疫检查点来抑制TILs的功能,以帕博利珠单抗、纳武单抗等为代表的免疫检查点抑制剂对部分肿瘤具有较好的疗效[15]。有研究验证了帕博利珠单抗在子宫颈鳞癌中的有效性及安全性,但免疫检查点抑制剂对部分患者有效率低,如何识别免疫高应答人群仍亟待解决。肿瘤出芽是肿瘤发生发展的重要因素,研究表明肿瘤出芽可能影响患者抗肿瘤治疗的敏感性。肿瘤出芽被认为发生了EMT转化,宫颈鳞癌患者中,EMT与放化疗不敏感相关[16]。另外研究表明肿瘤出芽与多种效应性TILs浸润水平呈负相关,提示出芽可能通过抑制TILs募集和浸润而促进肿瘤免疫逃逸,为免疫治疗疗效预测提供新思路[17]。
3.3.2新型免疫治疗策略对TILs和瘤芽的调控首先,以嵌合抗原受体T细胞(chimeric antigens receptor-T cell,CAR-T)为代表的T细胞疗法在宫颈癌治疗中的应用日益受到关注。该技术通过将特异性的肿瘤细胞抗原受体转移到T淋巴细胞表面,并在体外扩增,之后重新输入到患者体内,从而提高其靶向性和杀伤性性。该方案可突破PD-1/PD-L1等经典免疫逃避机制,发挥更强的抗肿瘤作用。另外,黄晓岚等[18]研究发现,可以通过敲除CAR-T细胞表面PD-1等免疫检查点,阻断和PD-L1的结合,来提高CAR-T细胞对肿瘤的疗效。其次,发展癌症疫苗也是一项很有意义的工作。肿瘤疫苗是一种以肿瘤相关抗原为靶点的新型肿瘤疫苗,它能有效地增强TILs的数量与功能。因此,针对肿瘤细胞特异性抗原构建个体化的肿瘤疫苗,可望通过诱导特定T细胞应答,进而抑制肿瘤的生长与转移。MASSARELLI E等[19]前期研究发现,部分疫苗如载体疫苗(ADXS11-001,靶向HPV转化细胞)、蛋白多肽疫苗(一种靶向HPV16 E6和E7的长肽疫苗)初步显示了对宫颈癌患者的疗效及安全性。
4结语
综上所述,肿瘤浸润淋巴细胞与瘤芽在宫颈鳞状细胞癌中的关系研究揭示了肿瘤进展过程中免疫微环境的重要作用。TILs作为肿瘤微环境中的关键免疫效应细胞,其数量和活性与肿瘤的侵袭性密切相关,而瘤芽作为肿瘤细胞侵袭转移的前驱,预示着不良的预后。二者之间的复杂交互作用不仅影响肿瘤的生物学行为,还为临床治疗提供了潜在的思路。
[参考文献]
[1]HIRAOKA N.Tumor-infiltrating lymphocytes and hepa‐tocellular carcinoma:Molecular biology[J].Int J Clin On‐col,2010,15(6):544-551.
[2]LUGLI A,ZLOBEC I,BERGER MD,et al.Tumour bud‐ding in solid cancers[J].Nat Rev Clin Oncol,2021,18(2):101-115.
[3]SHINTO E,MOCHIZUKI H,UENO H,et al.A novel classification of tumour budding in colorectal cancer based on the presence of cytoplasmic pseudo-fragments around budding foci[J].Histopathology,2005,47(1):25-31.
[4]NAKAGAWA Y,OHIRA M,KUBO N,et al.Tumor bud‐ding and E-cadherin expression are useful predictors of nodal involvement in T1 esophageal squamous cell carci‐noma[J].Anticancer Research,2013,33(11):5023-5029.
[5]ATTRAMADAL CG,KUMAR S,BOYSEN ME,et al.Tu‐mor budding,EMT and cancer stem cells in T1-2/N0 oral squamous cell carcinomas[J].Anticancer Research,2015,35(11):6111-6120.
[6]卢善明,罗文娟,刘堃,等.肿瘤出芽预测ⅠA2‐ⅠB1期宫颈鳞状细胞癌淋巴结转移的意义[J].实用医学杂志,2022,38(7):868-872.
[7]PARK JY,CHONG GO,PARK JY,et al.Tumor budding in cervical cancer as a prognostic factor and its possible role as an additional intermediate-risk factor[J].Gyneco‐logic Oncology,2020,159(1):157-163.
[8]HINSHAW DC,SHEVDE LA.The tumor microenviron‐ment innately modulates cancer progression[J].Cancer Research,2019,79(18):4557-4566.
[9]BENGSCH B,JOHNSON AL,KURACHI M,et al.Bioen‐ergetic insufficiencies due to metabolic alterations regu‐lated by the inhibitory receptor PD-1 areanearly driver of CD8+T cell exhaustion[J].Immunity,2016,45(2):358-373.
[10]PASTUSHENKO I,BLANPAIN C.EMT transition states during tumor progression and metastasis[J].Trends in Cell Biology,2019,29(3):212-226.
[11]QUAIL DF,JOYCE JA.Microenvironmental regulation of tumor progression and metastasis[J].Nature Medicine,2013,19(11):1423-1437.
[12]ABIKO K,MATSUMURA N,HAMANISHI J,et al.IFN-γfrom lymphocytes induces PD-L1 expression and promotes progression of ovarian cancer[J].British Journal of Cancer,2015,112(9):1501-1509.
[13]HANAHAN D,WEINBERG RA.Hallmarks of cancer:The next generation[J].Cell,2011,144(5):646-674.
[14]张继方,陈芳,唐佳雯,等.肿瘤出芽及肿瘤浸润淋巴细胞对食管鳞状细胞癌淋巴结转移的预测价值研究[J].中国全科医学,2023,26(32):4038-4042.
[15]HE X,XU C.Immune checkpoint signaling and cancer immunotherapy[J].Cell Research,2020,30(8):660-669.
[16]QURESHI R,ARORA H,RIZVI MA.EMT in cervical cancer:Its role in tumour progression and response to therapy[J].Cancer Letters,2015,356(2):321-331.
[17]FUJIYOSHI K,VÄYRYNEN JP,BOROWSKY J,et al.Tumour budding,poorly differentiated clusters,and T-cell response in colorectal cancer[J].EBioMedicine,2020,57:102860.
[18]黄晓岚,吴砂,王薇.过继性T细胞免疫治疗在妇科肿瘤中的应用进展[J].现代妇产科进展,2021,30(2):150-153,155.
[19]MASSARELLI E,WILLIAM W,JOHNSON F,et al.Combining immune checkpoint blockade and tumor-specific vaccine for patients with incurable human papillomavirus 16-related cancer:A phase 2 clinical trial[J].JAMA Oncol,2019,5(1):67-73.










