低血糖再灌注对新生大鼠皮层脑组织氧化应激的影响论文
2025-07-31 15:11:23 来源: 作者:xuling
摘要:新生大鼠枕叶II/III层神经元密度显著高于顶叶及额叶区域,HG和HG/GR组皮层神经元损伤,且枕叶皮层损伤最严重,可能与枕叶皮层神经元密度及氧化应激激活程度更高有关。
[摘要]目的探讨新生大鼠低血糖再灌注对不同大脑皮层组织神经元变性及氧化应激的影响。方法选取2021年1月—2022年12月由南昌大学动物中心提供的新生7 d的SD大鼠30只,采用随机数字表法分4组:正常组、生理盐水对照组(control,Ctrl)、低血糖组(hypoglycemia,HG)、低血糖后葡萄糖再灌注组(hypoglyce‐mia/glucose reperfusion,HG/GR)。尼氏染色法测定大脑枕叶、顶叶及额叶的皮质厚度,并分析II/III层神经细胞分布密度。HE染色法观察大脑皮质神经元的病理学变化。免疫荧光染色检测氧化应激标志物8-羟基脱氧鸟苷(8-hydroxy-2'-deoxyguanosine,8-OHG)的表达水平变化。结果正常新生7 d的SD大鼠中,枕叶皮层厚度小于顶叶和额叶,差异有统计学意义(P均<0.05),而枕叶II/III层神经元密度高于顶叶和额叶,差异有统计学意义(P均<0.05)。与Ctrl组相比,HG组皮层出现较多细胞水肿、空泡化、核裂解的神经元,HG/GR组皮层出现较多核萎缩、核裂解神经元。与Ctrl组比,HG组及HG/GR组枕叶、顶叶、额叶皮层8-OHG的积分光密度(integrated density,ID)均增加,差异有统计学意义(P均<0.05)。枕叶皮层8-OHG表达显著高于顶叶和额叶,差异有统计学意义(P均<0.05)。结论新生大鼠枕叶II/III层神经元密度显著高于顶叶及额叶区域,HG和HG/GR组皮层神经元损伤,且枕叶皮层损伤最严重,可能与枕叶皮层神经元密度及氧化应激激活程度更高有关。
[关键词]氧化应激;低血糖;低血糖再灌注;脑损伤;枕叶易损性
低血糖是新生儿重症监护室(newborn intensive care unit,NICU)最常见的代谢紊乱问题之一[1],可导致严重神经系统损害,包括皮质神经元损伤、脑实质出血,白质损伤等,遗留认知障碍、视力障碍、枕叶癫痫、脑瘫等后遗症,给患儿家庭和社会带来沉重负担。临床研究显示,低血糖性脑损伤好发于枕叶、顶叶等区域,其中枕叶损伤与癫痫、认知及视觉障碍密切相关[2],但其易损机制尚未明确。
SUH SW等[3]首次提出“葡萄糖再灌注脑损伤”概念,认为神经元损伤主要发生在血糖恢复期而非低血糖期。研究显示,成年大鼠在低血糖后高血糖再灌注会加重脑损伤[4],提示氧化应激的关键作用。然而,新生大鼠皮层对低血糖再灌注的氧化应激反应尚不明确。本研究通过建立新生SD大鼠模型,探讨低血糖再灌注诱导的皮层神经元病理改变及氧化应激机制,为临床防治提供理论依据。
1材料与方法
1.1实验动物
选取由南昌大学动物中心提供的清洁级新生7 d的SD大鼠(10~15 g)共30只。按随机数字表法分4组:正常组、理盐水对照组(control,Ctrl)、低血糖组(hypoglycemia,HG)、低血糖后葡萄糖再灌注组(hypoglycemia/glucose reperfusion,HG/GR)。正常组3只,余3组均9只。本研究实验方案经江西省新余市妇幼保健院伦理委员会批准(20242001)。
1.2试剂与器材
血糖仪鱼跃悦准I型(江苏鱼跃);彩色图像扫描仪EPSON 700(日本EPSON);半自动轮转式切片机RM2245(德国Leica);冰冻切片机CM1950(德国莱卡);激光共聚焦显微镜LSM700(德国Zeiss);胰岛素注射液(国药准字H10890001;规格:400 U∶10 mL);葡萄糖注射液(国药准字H20063633;规格:50 mL∶2.5 g);乌拉坦国药集团(中国);HE染色试剂盒(Solarbio,G1121);尼氏染色液(Solarbio,G1430);8-羟基脱氧鸟苷(8-hydroxy-2'-deoxy‐guanosine,8-OHG)(Rabbit)(北京博奥森,bs-1278R)。
1.3实验建模
实验分组及处理:HG组采用新生7 d的SD大鼠,连续3 d(8:00-12:00)皮下注射胰岛素(12 U/kg),血糖<2.2 mmol/L视为建模成功;HG/GR组:前2天同HG组处理,第3天低血糖4 h后腹腔注射25%葡萄糖(6 mL/kg),血糖≥2.6 mmol/L为成功;Ctrl组:注射等量生理盐水;正常组:不做任何处理。血糖监测时间点为注射前、注射后2 h和4h。
1.4标本制备和检测
1.4.1石蜡切片的制备第3天建模完成后,每组各取3只,麻醉后取脑组织,用10%中性福尔马林固定,后取脑组织液态石蜡浸泡包埋,用半自动轮转式切片机切取5μm矢状切片,贴于防*载玻片上,置于65℃烤片机上烤蜡,行HE染色。另取3只正常组新生大鼠切片制备同上,行尼氏染色。
1.4.2尼氏染色石蜡切片常规脱蜡,采用尼氏染色后进行封片,使用图像导航扫描仪进行拍片获取染色数据,于图像导航扫描仪测量枕叶、顶叶及额叶皮层的厚度;计数单位面积枕叶、顶叶、额叶皮层(Ⅱ/Ⅲ层)神经元数目。
1.4.3 HE染色将石蜡切片常规脱蜡,HE染色后行封片,用图像导航扫描仪拍片获取数据,观察枕叶、顶叶、额叶皮层Ⅱ/Ⅲ层、Ⅴ层神经元死亡情况。
1.4.4冰冻切片制备建模成功后,每组取6只,麻醉后获取脑组织样本,4%多聚甲醛固定处理,磷酸盐缓冲液常规清洗后,OCT胶包埋组织,用冰冻切片机连续切30μm脑片,切片保存于磷酸盐缓冲液液中备用,免疫荧光染色备用。
1.4.5 8-OHG免疫荧光染色冰冻切片分别在一抗及二抗工作液中孵育后,采用抗荧光淬灭封片技术处理脑片后,应用激光共聚焦显微镜成像系统检测枕叶、顶叶和额叶皮层的氧化应激水平。使用Im‐age J分析软件的荧光定量功能,测定累积的积分光密度(integrated density,ID)。
1.5观察指标
尼氏染色定量分析枕叶、顶叶、额叶皮层厚度及II/III层神经元密度;HE染色系统观察各组皮层神经元病理改变;免疫荧光组织化学技术定量检测氧化应激标记物8-OHG抗体表达水平,分析低血糖及再灌注条件下皮层神经元氧化应激的变化。
1.6统计方法
采用GraphPad Prism 8统计学软件处理数据,对于经Shapiro-Wilk检验符合正态分布的计量资料(如8-OHG、ID值)采用(±s)表示,两组间比较采用独立样本t检验,两组以上的数据采用单因素方差分析(ANOVA),多重比较使用Dunnett's检验。对于不符合正态分布或(和)方差齐性的计量资料(如皮层厚度及神经元密度)采用[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验,两组以上比较采用Kruskal-Wallis检验,多重比较使用Dunnett’s检验。P<0.05为差异有统计学意义。
2结果
2.1建模结果
在HG组与HG/GR组中,与初始血糖值相比,胰岛素注射后2 h和4 h血糖值均降低,但在4.5 h,即再灌注后0.5 h,HG/GR组血糖与初始血糖值相比无差异,但较HG组升高明显,差异有统计学意义(F=48.886,P均<0.05)。见表1。
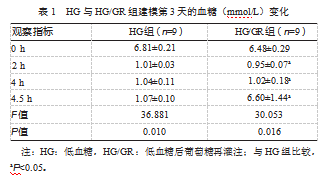
2.2新生大鼠皮层厚度及神经元密度
尼氏染色清晰显示新生大鼠脑矢状面大脑皮层和海马等结构(见图1A),显微镜下大脑皮层细胞从外到内分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ层(见图1B)。枕叶皮层厚度(854.80±44.15)μm显著小于顶叶皮层厚度(1135.00±45.89)μm和额叶皮层厚度(1459.00±61.89)μm,差异有统计学意义(F=13.546、20.574,P均<0.05)(见图1C)。顶叶比额叶皮层厚度更小,差异有统计学意义(F=10.033,P<0.05)。此外,枕叶皮层Ⅱ/Ⅲ层细胞密度(60.75±2.75)个/0.01 mm²高于顶叶(47.25±1.63)个/0.01 mm²和额叶(50.50±3.42)个/0.01 mm²,差异有统计学意义(F=9.258、8.772,P均<0.05)。顶叶与额叶之间的细胞密度比较,差异无统计学意义(F=9.030,P=0.68)(见图1D)。以上结果表明,枕叶神经元密度显著高于顶叶和额叶皮层。
2.3新生大鼠低血糖再灌注模型皮质神经元病理改变
HE染色结果显示:Ctrl组与正常组均未发生明显病理改变,皮层神经元(II-III和V层)结构完整,排列规则(见图2)。HG组皮层神经元出现较多细胞水肿、空泡化、核裂解现象(见图3)。HG/GR组:以神经元萎缩、核裂解为主要特征(见图4)。
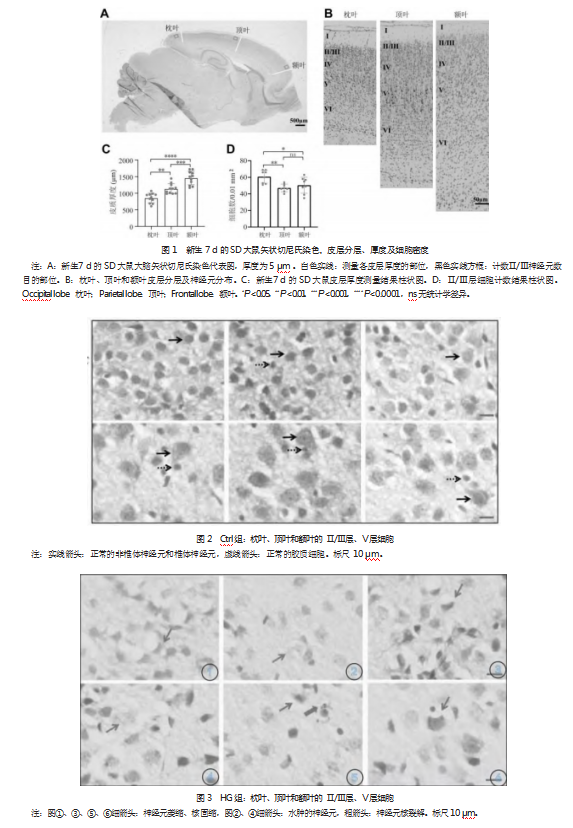
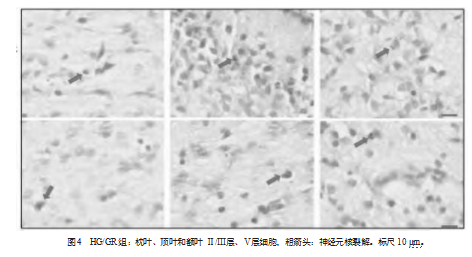
2.4新生大鼠皮层神经元氧化应激情况
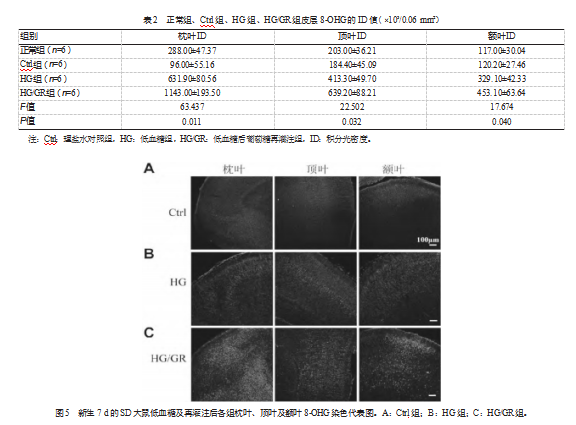
正常组及Ctrl组大鼠脑枕叶、顶叶及额叶之间8-OHG的ID比较,差异有统计学意义(F正常组=10.002,P正常组=0.022;FCtrl组=14.803,PCtrl组=0.030),枕叶、顶叶及额叶8-OHG的ID值在正常组、Ctrl组、HG组、HG/GR组组间比较,差异有统计学意义(F枕叶ID=63.437,P枕叶ID=0.011;F顶叶ID=22.502,P顶叶ID=0.032;F额叶ID=17.674,P额叶ID=0.040),且在各皮层ID值中HG/GR组高于HG组高于Ctrl组,见表2。以上研究数据显示,大脑枕叶、顶叶及额叶低血糖再灌注后皮层氧化应激均最强,其次是低血糖组。
3讨论
葡萄糖对正常细胞代谢至关重要。临床系统回顾和荟萃分析表明,新生儿低血糖可引起神经系统后遗症,增加学龄期神经发育障碍以及阅读和计算能力低下的风险[5-6]。
本研究成功建立新生鼠低血糖(胰岛素12 U/kg)及再灌注(25%葡萄糖)模型。文献表明[7],短期胰岛素暴露(<48 h)无神经毒性作用,且低剂量胰岛素可能通过抗凋亡机制发挥神经保护效应。研究表明,低血糖诱导的神经元死亡涉及多机制级联反应,包括谷氨酸受体激活、线粒体功能异常、还原型烟酰胺腺嘌呤二核苷酸氧化酶的激活及介导的活性氧(reactive oxygen species,ROS)生成等[7-8],但其在新生儿低血糖脑损伤中的时序关系和作用机制仍需深入探究。
本研究结果显示,新生7 d的SD大鼠枕叶II/III层细胞密度高于顶叶和额叶(P均<0.05),可能与其高能量需求相关。文献报道[9-10],低血糖时枕叶葡萄糖代谢率较低,与其易损性特征相符。
皮层神经元HE染色结果显示,新生大鼠HG组皮层神经元出现较多细胞水肿、空泡化和核裂解现象,而HG/GR组则更多表现为神经元萎缩和核裂解,研究结果表明,低血糖及其再灌注过程均可引发不同程度的大脑皮层神经元损伤。既往研究也表明,在急性低血糖及再灌注大鼠模型的脑皮层HE染色中,观察到明显的血管周隙增宽、神经元水肿变性、核裂解等病理改变,部分结果与本研究一致[11]。
通过对不同部位大脑皮层神经元8-OHG表达水平的分析,本研究发现,正常新生大鼠皮层存在轻度氧化应激,但与正常组相比,低血糖和低血糖再灌注组皮层神经元的氧化应激更为强烈。5%葡萄糖干预后低血糖组的氧化应激反应非但未缓解反呈增强趋势,值得注意的是,枕叶皮层在低血糖及其再灌注过程中表现出较额叶和顶叶更显著的氧化应激水平,提示该脑区对氧化损伤具有特殊易感性。进一步分析发现,氧化损伤程度与再灌注后血糖浓度呈正相关。既往研究在成年大鼠模型中也观察到类似现象:低血糖1 h后给予葡萄糖再灌注3 h,高血糖组呈现更严重的脑损伤。大鼠在低血糖1 h后神经元产生的ROS仅略微增加,但如果经历30 min低血糖和30 min再灌注,神经元ROS的产生则会升高[12-13]。因此,本研究与国内外众多研究一致表明,低血糖引起的神经元病理改变可能并非由低血糖本身引起,而是由葡萄糖再灌注所引发的氧化应激损伤所致。
综上所述,本研究通过胰岛素诱导的低血糖模型及低血糖糖后腹腔注射葡萄糖形成上葡萄糖再灌注的方法稳定可靠。实验结果显示,低血糖及其再灌注均可引发脑损伤,其中枕叶皮层氧化应激反应尤为显著,提示氧化损伤可能是导致低血糖和低血糖再灌注脑损伤特别是枕叶易损性的重要病理机制。
[参考文献]
[1]KAWAKAMI R,KATO K,SONE H.The Reply[J].Am J Med,2023,136(5):e104.
[2]谢辉,兰为顺,杨文忠,等.磁共振扩散加权成像定量参数在新生儿低血糖脑损伤中的应用[J].中国临床医学影像杂志,2020,31(3):159-162.
[3]SUN SW,GUM ET,HAMBY AM,et al.Hypoglycemic neuronal death is triggered by glucose reperfusion and activation of neuronal NADPH oxidase[J].J Clin Invest,2007,117(4):910-918.
[4]褚秀丽,赵玉武,米亚静,等.血糖升高水平对大鼠低血糖性脑损伤的影响[J].中华糖尿病杂志,2012,4(3):170-176.
[5]SHAH R,HARDING J,BROWN J,et al.Neonatal gly‐caemia and neurodevelopmental outcomes:A systematic review and meta-analysis[J].Neonatology,2019,115(2):116-126.
[6]庄斌,林新祝.新生儿低血糖脑病研究进展[J].中华新生儿科杂志:中英文,2019,34(5):398-400.
[7]ENNIS K,TRAN PV,SEAQUIST ER,et al.Postnatal age influences hypoglycemia-induced neuronal injury in the rat brain[J].Brain Res,2008,1224:119-126.
[8]GU MH,AMANDA F,YUAN TM.Brain injury in neona‐tal hypoglycemia:A hospital-based cohort study[J].Clin Med Insights Pediatr,2019,13:1179556519867953.
[9]COSTANZA L,DE ANGELIS G,BRIGATI G.Neonatal hypoglycemia and brain vulnerability[J].Front Endocrinol,2021,12:634305.
[10]QIAO LX,WANG J,YAN JH,et al.Follow-up study of neurodevelopment in 2-year-old infants who had suf‐fered from neonatal hypoglycemia[J].BMC Pediatr,2019,19(1):133.
[11]TONG F,ZOU Y,LIANG Y,et al.The water diffusion of brain following hypoglycemia in rats:A study with diffusion weighted imaging and neuropathologic analy‐sis[J].Neuroscience,2019,409:58-68.
[12]于晨,董超然,张照辉,等.8-羟基脱氧鸟嘌呤作为DNA氧化损伤标志物的研究现状[J].中国临床药理学杂志,2017,33(13):1267-1270.
[13]ZHAO T,LIU Q,ZHOU M,et al.Identifying risk effec‐tors involved in neonatal hypoglycemia occurrence[J].Biosci Rep,2020,40(3):BSR20192589.










