肺一氧化碳弥散量与慢阻肺患者预后评估相关性的研究进展论文
2025-06-13 16:16:21 来源: 作者:xuling
摘要:肺一氧化碳弥散量(DLCO)在慢性阻塞性肺疾病(COPD)患者中,只是作为一项评估肺功能的指标,对于COPD患者预后的评价尚未广泛应用于临床实际工作中。
【摘要】肺一氧化碳弥散量(DLCO)在慢性阻塞性肺疾病(COPD)患者中,只是作为一项评估肺功能的指标,对于COPD患者预后的评价尚未广泛应用于临床实际工作中。因此,本文通过对肺一氧化碳弥散能力在慢性气道疾病尤其是COPD的预后评估所起的作用进行总结,希望引起临床工作者的广泛关注,为以后的相关研究及临床工作的开展提供更广泛全面的论点。
【关键词】肺一氧化碳弥散量,呼吸系统疾病,慢性阻塞性肺疾病,预后,运动耐量,合并症,死亡率
肺一氧化碳弥散量(DLCO)又称肺一氧化碳转运因子(TLCO),是指单位时间和压力差内,通过肺泡毛细血管膜进入到毛细血管内一氧化碳的量。肺弥散功能是指某种肺泡气通过肺泡-毛细血管膜从肺泡向毛细血管扩散到血液,并与红细胞中血红蛋白(Hb)结合的能力。临床上多采用DLCO来反映肺的弥散功能。早期慢性阻塞性肺疾病(COPD)病人多呈现出阻塞性的通气功能障碍,由此可对表现出临床症状与气流阻塞程度不相符的患者进行DLCO的测量,以预测此类COPD患者的预后情况。2022年《慢性阻塞性肺疾病全球防治创议》(GOLD)中明确提到DLCO与COPD预后评估之间的关系,目前,关于DLCO在COPD中的地位日益提高,本文将对DLCO与COPD预后评估相关性进行综述总结。
1 DLCO与呼吸系统疾病的相关性
1.1 DLCO与新型冠状病毒肺炎(COVID-19)的相关性
据统计,至2022年10月10日,全球大约有6.18亿例累计病例和653万死亡病例归因于COVID-19[1]。全世界积极应对由病毒变异引发的感染浪潮,但COVID-19带来的长期影响是公共卫生面临的新挑战。在部分COVID-19患者中,症状可持续存在,有数月甚至数年,这些被定义为长期冠状病毒肺炎(COVID)、COVID后综合征或COVID-19急性后遗症(PASC)[2-4]。长期COVID可涉及多个脏器,主要表现在肺部、神经精神、心血管和胃肠道系统。大多数研究报告了感染COVID-19治愈后对健康的各种影响。其中,弥散能力受损是最常见的肺功能异常。最近的一些报告显示,在对COVID-19幸存者进行随访研究中发现,DLCO受损是显著的表现,但出院后COVID-19幸存者DLCO下降的机制目前尚不清楚,可能包括上皮和或内皮细胞功能障碍[5],因此,Sibila等[6]人发现随访COVID-19幸存者出院后6个月的DLCO水平,与DLCO正常组比较,反应上皮细胞损伤的标志物如表面活性蛋白A(SP-A)、表面活性蛋白D(SP-D)及分泌白细胞蛋白酶抑制剂(SLPI)和内皮细胞损伤的标志物,如血管生成素-2和细胞间粘附分子1(sICAM-1)的水平在DLCO减少组中显著升高,尤其是在DLCO%pred<50%的患者中,且二者之间具有统计学意义,这表明COVID-19幸存者存在肺损伤,这也有望证实它们是出院后肺后遗症的潜在预后标记物。同时在对COVID-19幸存者出院后1年的随访过程中,Zhao等[7]人还发现入院时较高水平的尿素氮与DLCO%pred<80%相关,尿素氮水平是DLCO异常的独立危险因素,这与之前的研究结果相一致[8]。因此,尽早发现受损的DLCO,有助于帮助临床医生为COVID-19幸存者定制管理策略以及更好地进行肺康复治疗。
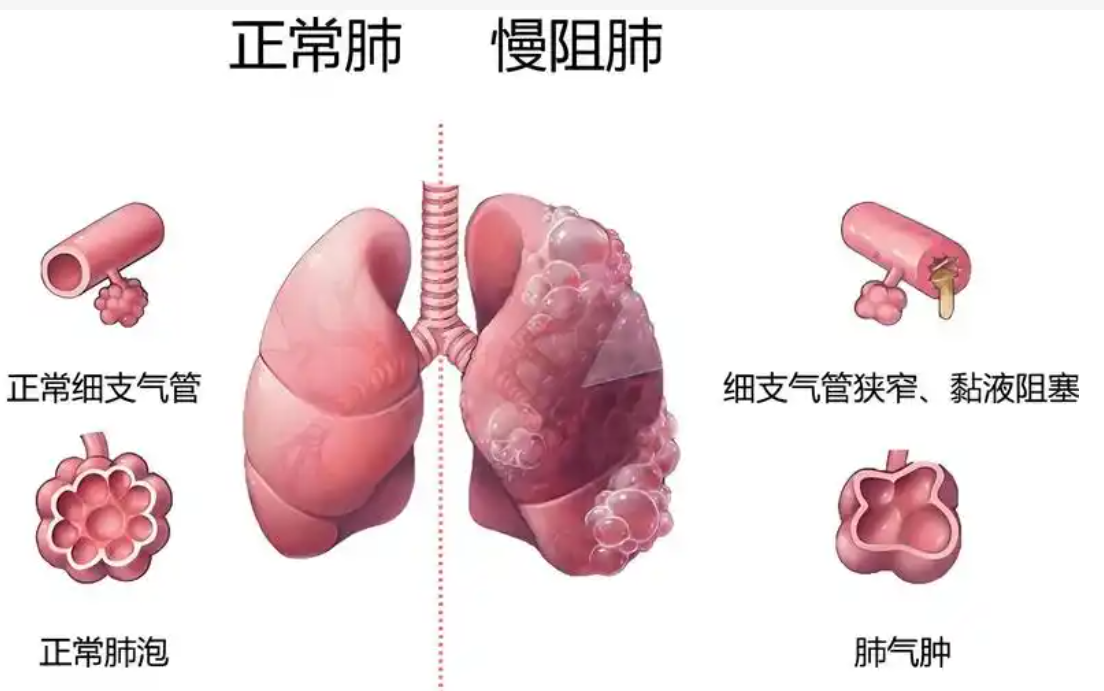
1.2 DLCO与间质性肺疾病(ILD)的相关性
ILD是一个涵盖广泛疾病的总称,其中大多数主要影响肺间质。肺间质空间的一侧为肺泡上皮,另一侧为毛细血管内皮,其中包含淋巴管、偶有成纤维细胞和细胞外基质蛋白,如胶原蛋白。在健康人体内,间质为肺泡提供结构支持,但只有几μm厚,因此有利于有效的气体交换。ILD的特征是间质间隙内的炎症或纤维化,其主要后果是气体交换受损,从而导致呼吸困难,在许多情况下,导致呼吸衰竭和死亡。据估计,有超过200种不同的疾病可引起ILD。这些疾病从超罕见疾病到多系统疾病,包括系统性硬化症(SSc)或类风湿性关节炎(RA),到更常见的疾病,如特发性肺纤维化(IPF)。其中IPF预后较差,诊断后的中位预期寿命为3~5年[9]。因此,利用相关指标预测IPF患者的预后,非常值得应用于临床工作中。Kunio Hamada等[10]人报道,在评估IPF生存时间影响因素的回归分析中,DLCO是唯一具有统计学意义的参数。基于DLCO状态的分组中,根据判别分析,采用40%的预测截断值。Mogulkoc等[11]人报道,IPF等待肺移植时死亡的患者中,平均DLCO%pred为39%。因此,40%作为预测截断值很关键,并且DLCO状态可作为评价IPF患者病情和预后的关键因素。肺动脉高压(PAH)是ILD患者最常见的共病之一,常出现在IPF晚期患者的临床过程中,导致呼吸困难恶化,功能能力下降,需要增加氧气补充,最终生存率降低,且已被证实与显著的发病率和生存率下降有关[12-13]。King等[14]报道,胸片显示肺动脉扩张是PAH的一种征象,提示预后不良。Esam H Alhamad等[15]人在研究作为ILD合并PAH独立生存预测因子出现的生理变量中,DLCO%pred是ILD合并PAH患者死亡率的重要标记。
重要的是,在ILD合并PAH患者中观察到的DLCO降低(<35%pred)和死亡率增加之间的显著相关性与其他肺动脉高压的研究一致,并强调扩散能力作为鉴别ILD和非间质性肺病患者最高死亡风险的有用生理参数的重要性。IPF合并PAH患者的总生存期明显低于伴有PAH的其他类型ILD患者的生存期。不幸的是,大多数ILD合并PAH患者通常被排除在PAH特异性治疗的临床试验之外。因此,未来的研究非常需要解决间质性肺病合并肺动脉高压的破坏性并发症,特别是在那些严重PAH的患者中。
2 COPD的预后评估
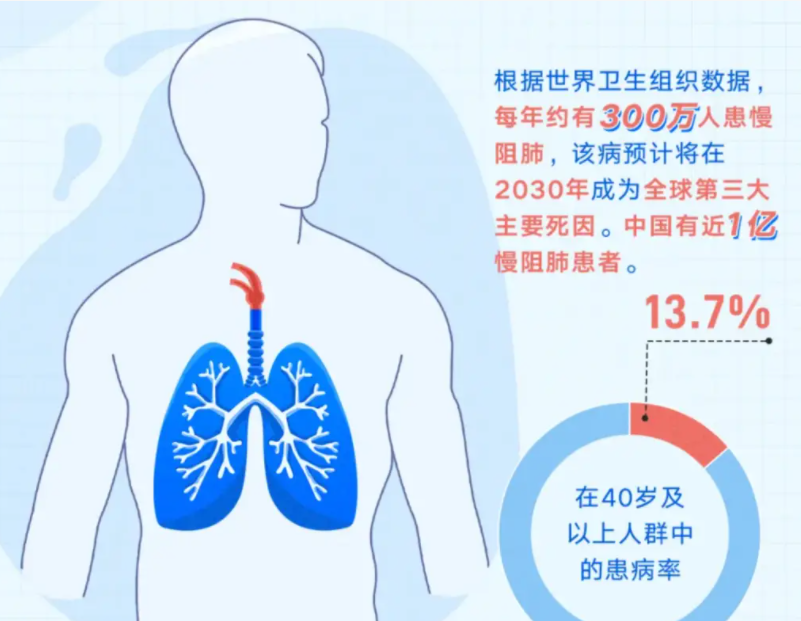
目前COPD是全世界三大死因之一,其中90%的死亡发生在低收入和中等收入国家[16],并且大多数国家数据显示,只有不到6%成年人得知自己患有COPD[17],这也充分的反映了人们对COPD的认识和诊断不足,这对于公共卫生来说是一项巨大的挑战。许多人患有这种疾病多年,并因其或其并发症而过早死亡;在全球范围内,由于持续暴露于COPD危险因素和人口老龄化,预计未来几十年COPD负担将增加[18]。因此,对COPD患者进行预后评估刻不容缓。GOLD指南[19]推荐的判断COPD预后的指标包括症状和气流受限严重程度、肺功能测定、急性加重住院频率、ABCD分组、运动耐量与体力活动(6 min步行试验、穿梭步行试验)、吸烟、合并症、营养状况、年龄、体重指数、长期氧疗、BODE指数;而COPD的预后不良常表现为症状加重、频繁住院治疗、运动耐量下降或缺失、共病的出现、生活质量下降及死亡,通过寻找相关指标与不良预后表现之间的关系,提前判断预后不良的存在,从而通过改善生活方式或进行药物、吸氧治疗来预防,这为COPD人群带来的益处不容小觑,例如延长COPD患者的生存时间,提高生活质量,甚至减轻家庭乃至经济、社会的负担。目前有研究表示,在COPD患者中,横断面上获得的DLCO%pred<60%与运动能力下降、症状加重、健康状况较差[20-22]及死亡风险增加有关。由此可见,DLCO不仅仅监测患者的肺功能,而且会给COPD患者带来巨大的福祉。
3 DLCO与COPD预后的相关性研究
3.1 DLCO与运动耐量
运动能力受损是COPD疾病患者发展进程的一个重要组成部分。运动不耐受是COPD的主要症状,由通气、心血管和周围肌肉之间的复杂相互作用造成[23-24]。呼吸障碍的不断进展导致患者运动耐量的下降,从而降低了COPD患者开展日常生活活动的能力,导致患者生活质量下降[25],对患者的心理、经济以及家庭,乃至社会带来了巨大的负担。随着病情进展,远端细支气管的阻塞和塌陷引起肺泡通气量减少,造成部分肺虽有血液灌流,但通气不足,从而引起功能性分流增加,使通气与血流比例失调;而部分区域由于肺气肿,肺泡膨胀挤压周围的毛细血管,致使肺毛细血管血量大量减少,肺泡间的血流量减少,从而导致生理无效腔气量增大。与此同时,肺泡与毛细血管的大量丧失导致肺弥散面积减少,进而引起弥散功能发生障碍[26]。虽然临床上多数患者肺功能未见明显下降,气流阻塞程度呈现轻度,但他们表现出的临床症状与客观检测指标并不相符,此时DLCO便可用来评估患者日常活动的耐受程度。轻度COPD患者出现劳力性呼吸困难与运动时呼吸肌的吸气神经驱动增高有关,而运动时神经驱动增加归因于动态机械异常(极低的吸气储备容积即IRV)。通气量/二氧化碳排出量比值(VE/VCO2)增加也是轻度COPD患者呼吸困难的一大因素,并且可加速向机械限制的进展。在不同严重程度的COPD患者中,低静息DLCO与高VE/VCO2、呼吸困难和运动受限有关。因此,低DLCO患者运动能力下降与较高的呼吸机要求、较快的动态IRV下降速度以及较大的运动时呼吸困难有关[27-28]。这些简单的测量应该被考虑用于临床评估轻度COPD患者的不明原因的运动不耐受。6 min步行试验(6-MWT)通常用于COPD患者运动能力的评估,并且运动障碍与慢阻肺患者急性加重导致入院及未来死亡风险增加有关[29-30]。研究[31]发现,无气流阻塞戒烟者的DLCO与6-MWT降低有关,并且肺一氧化碳可作为6-MWT下降的最小临床重要差异的预测因子[32]。COPD患者中DLCO的减少反映了终末细支气管异常扩张后肺泡毛细血管膜的损伤[33],并且低DLCO被证明是COPD严重恶化的独立预测因子[34],因此,DLCO减退和气流阻塞可识别出一组症状更明显的患者,这给临床上有明显反差的COPD患者的鉴别提供了重要工具。2013年一项研究表明[35],DLCO是所有COPD患者运动能力的最强预测因子。除第1秒用力呼气容积(FEV1)外,DLCO和吸气量对COPD患者的运动能力具有显著较高的预测价值。这表明,在临床监测COPD患者时,增加弥散能力和吸气能力的测量是有益的。
3.2 DLCO与合并症
DLCO可以取代COPD中常用的预后标志物,第一,DLCO下降与肺血管病变密切相关,而肺血管病变几乎总是存在于COPD中。为了证实DLCO与预后之间的联系,首先想起COPD引起的严重PAH与肺毛细血管密度降低有关,而DLCO是一种反映肺泡毛细血管界面完整性的指标,描述了吸入气体在肺泡、毛细血管和红细胞膜上的扩散率,以及最终与血红蛋白的反应性。这便是一个已知的降低DLCO的因素[36]。第二,肺动脉压越高,对预后的影响越大,DLCO便可作为一个有效的预后评估指标,用于早期识别COPD患者是否合并PAH等相关肺血管病变以及指导下一步的干预治疗。其次,肺气肿的存在导致了肺泡和毛细血管破坏,从而引起DLCO的进一步减少。第三,经常与COPD相关的左心疾病也可能导致一些患者的肺血管重塑,从而降低DLCO[37-38];在COPD合并有血栓栓塞病史的患者中,DLCO较低的发病率较高,这表明慢性血栓栓塞性疾病对DLCO降低有显著贡献[39]。由此可知,血流动力学紊乱造成疾病的严重程度与DLCO之间有着密切的关系。在COPD合并PAH的患者中,气体交换障碍与死亡密切相关。研究表明,严重的气体交换障碍会导致血液动力学指标紊乱,增加死亡风险。鉴于COPD患者中轻度PAH的高发病率,对轻度PAH患者血流动力学和气体交换对预后的影响的尤其值得关注[40-43]。
3.3 DLCO与死亡率
鉴于COPD恶化与死亡率之间的联系,以及医疗利用率和相关费用的高水平,识别频繁发作或有严重恶化风险的患者是一个优先事项。COPD已成为全球第三大死因,且死亡率仍在逐年上升。COPD的特点是由于小气道疾病和肺实质破坏导致气流阻塞。FEV1作为BODE[体重指数(BMI)、气流阻塞、呼吸困难和运动耐量]指数的一个组成部分,可能比作为一个个体参数更好地预测死亡率[44]。但FEV1%pred反映了气流阻塞的严重程度,而体积描记法测定的肺容积则反映了气流阻塞和肺弹性回缩力降低导致的气体潴留和肺过度膨胀。作为转移系数和肺泡容积的乘积,DLCO既反映了功能性肺容积的变化,也反映了通过肺泡毛细血管膜的气体传输,从而反映了肺气肿导致的肺实质破坏和肺毛细血管床丧失的程度,并且已知DLCO是COPD人群中的肺气肿相关的最佳因素之一[45],因此,需要进一步评估肺气肿的放射学程度以深入了解DLCO所捕获的病理生理状况。有研究表明低DLCO与死亡率相关,尽管这些研究都包含的是中至重度的COPD患者,但低DLCO的轻度COPD患者更需要引起大家关注,虽然也有研究表明DLCO%pred<60%的轻度COPD患者表现出死亡风险增加,但具体的原因目前尚不清楚[46]。因此,可以在常规实践中对COPD患者实施气体交换措施,为他们提供最佳预后信息,并且COPD的死亡率评估应包括DLCO,而不仅仅依赖于气流阻塞的严重程度[47]。
4小结与展望
DLCO是一种可用、廉价、无创的检查指标方法,是COPD患者预后的一个强有力的独立预测因子,已被考虑纳入COPD的预后方法中。DLCO紊乱所描述的潜在病理生理状况尚未被直接检查,但这些发现在广泛的肺活量和血液动力学参数中的一致性表明,DLCO是疾病严重程度的有力标志。总之,DLCO在COPD患者预后方面是有用的,尤其是对那些轻度气流阻塞却表现出与之不相符的呼吸困难的患者,DLCO有望成为COPD预后评估的强有力的指标,并且将给COPD患者及广大的临床工作者带来巨大的福祉,也将更加丰富COPD领域的研究。
参考文献
[1]WHO.WHO coronavirus disease(COVID-19)dashboard[EB/OL](2022-10-10)[2024-5-07]
[2]SORIANO J B,MURTHY S,MARSHALL J C,et al.A clinical case definition of post-COVID-19 condition by a Delphi consensus[J].The Lancet Infectious Diseases,2022,22(4):e102-e107.
[3]SHAH W,HILLMAN T,PLAYFORD E D,et al.Managing the long term effects of covid-19:summary of NICE,SIGN,and RCGP rapid guideline[J].BMJ,2021,372:n136.
[4]GROFF D,SUN A,SSENTONGO A E,et al.Short-term and long-term rates of postacute sequelae of SARS-CoV-2 infection:a systematic review[J].JAMA Network Open,2021,4(10):e2128568.
[5]HUGHES J M B,PRIDE N B.Examination of the carbon monoxide diffusing capacity(DLCO)in relation to its KCO and VA components[J].Am J Respir Crit Care Med,2012,186(2):132-139.
[6]SIBILA O,PEREA L,ALBACAR N,et al.Elevated plasma levels of epithelial and endothelial cell markers in COVID-19 survivors with reduced l-ung diffusing capacity six months after hospital discharge[J].Respir Res,2022,23(1):37.
[7]ZHAO Y,YANG C,AN X,et al.Follow-up study on COVID-19 survivors one year after discharge from hospital[J].IntJ Infect Dis,2021,112:173-182.
[8]IZCOVICH A,RAGUSA M A,TORTOSA F,et al.Prognostic factors for severity and mortality in patients infected with COVID-19:a systematic review[J].PLoS One,2020,15(11):e0241955.
[9]LEDERER D J,MARTINEZ F J.Idiopathic pulmonary fibrosis[J].N EnglJ Med.2018,378(19):1811-1823.
[10]HAMADA KUNIO,NAGAI SONOKO,TANAKA SHIGERU.Significance of pulmonary arterial pressure and diffusion capacity of the lung as prognosticator inpatients with idiopathic pulmonary fibrosis[J].Chest,2007,131(3):650-656.
[11]HOEPER M M,BEHR J,HELD M,et al.Pulmonary hypertension in patients with chronic fibrosing idiopathic interstitial pneumonias[J].PLoS One,2015,10(12):e0141911.
[12]HAMADA K,NAGAI S,TANAKA S,et al.Significance of pulmonary arterial pressure and diffusion capacity of the lung as prognosticator in patients with idiopathic pulmonary fibrosis[J].Chest,2007,131(3):650-656.
[13]KIMURA M,TANIGUCHI H,KONDOH Y,et al.Pulmonary hypertension as a prognostic indicator at the initial evaluation in idiopathic pulmonary fibrosis[J].Respiration,2013,85(6):456-463.
[14]KING T E J R,TOOZE J A,SCHWARZ M I,et al.Predicting survival in idiopathic pulmonary fibrosis:scoring system and survival model[J].Am J Respir Crit Care Med,2001,164:1171-1181.
[15]ALHAMAD ESAM H,CAL JOSEPH G,ALRAJHI NUHA N,et al.Predictors of mortality in patients with interstitial lung disease-associated pulmonary hypertension[J].J Clin Med,2020,9(12):3828.
[16]HALPIN D M G,CELLI B R,CRINER G J,et al.The GOLD Summit on chronic obstructive pulmonary disease in low and middle-income countries[J].Int J Tuberc Lung Dis,2019,23(11):1131-1141.
[17]HALBERT R J,NATOLI J L,GANO A,et al.Global burden of COPD:systematic review and meta-analysis[J].Eur Respir J,2006,28(3):523-532.
[18]MATHERS C D,LONCAR D.Projections of global mortality and burden of disease from 2002 to 2030[J].PLoS Med,2006,3(11):e442.
[19]HALPIN DMG,CRINER GJ,PAPI A,et al.Global initiative for the diagnosis,management,and prevention of chronic obstructive lung disease.The 2020 GOLD science committee report on COVID-19 and chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2021,203(1):24-36.-174-Chinese and Foreign Medical Research Vol.22,No.30 October,2024
[20]BALASUBRAMANIAN A,MACINTYRE N R,HENDERSON R J,et al.Diffusing Capacity of Carbon Monoxide in Assessment of COPD[J].Chest,2019,156(6):1111-9.
[21]ELBEHAIRY A F,O'DONNELL C D,ABD ELHAMEED A,et al.Low resting diffusion capacity,dyspnea,and exercise intolerance in chronic obstructive pulmonary disease[J].J Appl Physiol,2019,127(4)::1107-1116.
[22]FARKHOOY A,JANSON C,ARNARDÓTTIR R H,et al.Impaired carbon monoxide diffusing capacity is the strongest predictor of exercise intolerance in COPD[J].COPD,2013,10(2):180-185.
[23]O’DONNELL D E,LAM M,WEBB K A.Measurement of symptoms,lung hyperinflation,and endurance during exercise in chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1998,158(5 Pt 1):1557-1565.
[24]SERRES I,GAUTIER V,VARRAY A,et al.Impaired skeletal muscle endurance related to physical inactivity and altered lung function in COPD patients[J].Chest,1998,113(4):900–905.
[25]CELLI B R.Standards for the optimal management of COPD:a summary[J].Chest,1998,113(4 Suppl):283S-287S.
[26]葛均波,徐永健,王辰.内科学[M].9版.北京:人民卫生出版社,2018:22-23.
[27]GUENETTE J A,CHIN R C,CHENG S,et al.Mechanisms of exercise intolerance in global initiative for chronic obstructive lung disease grade 1 COPD[J].Eur Respir J,2014,44:1177-1187.
[28]ELBEHAIRY A F,CIAVAGLIA C E,WEBB K A,et al.Pulmonary gas exchange abnormalities in mild chronic obstructive pulmonary disease.Implications for dyspnea and exercise intolerance[J].Am J Respir Crit Care Med,2015,191:1384-1394.
[29]COTE C G,CASANOVA C,MARIN J M,et al.Validation and comparison of reference equations for the 6-min walk distance test[J].Eur Respir J,2008,31(3):571e8.
[30]SPRUIT M A,POLKEY M I,CELLI B,et al.Predicting outcomes from 6-minute walk distance in chronic obstructive pulmonary disease[J].J Am Med Dir Assoc,2012,13(3):291e7.
[31]PINTO-PLATA V M,COTE C,CABRAL H,et al.The 6-min walk distance:change over time and value as a predictor of survival in severe COPD[J].Eur Respir J,2004,23(1):28e33.
[32]ELBEHAIRY A F,O’DONNELL C D,ABD ELHAMEED A,et al.Low resting diffusion capacity,dyspnea,and exercise intolerance in chronic obstructive pulmonary disease[J].J Appl Phy-siol(1985),2019,127:1107–2216.
[33]DÍAZ A A,PINTO-PLATA A,HERNÁNDEZ C,et al.Emphysema and DLCO predict a clinically important difference for 6MWD decline in COPD[J].Respiratory Medicine,2015,109(7):882-889.
[34]MORRISON N J,ABBOUD R T,RAMADAN F,et al.Comparison of single breath carbon monoxide diffusing capacity and pressure-volume curves in detecting emphysema[J].Am Rev RespirDis,1989,139(5):1179-1187.
[35]BALCELLS E,ANTO J M,GEA J,et al.Characteristics of patients admitted for the first time for COPD exacerbation[J].Respir Med,2009,103(9):1293-1302.
[36]BUNEL V,GUYARD A,DAURIAT G,et al.Pulmonary arterial histologic lesions in patients with COPD with severe pulmonary hypertension[J].Chest,2019,156(1):33-44.
[37]CHANDRA S,SHAH S J,THENAPPAN T,et al.Carbon monoxide diffusing capacity and mortality in pulmonary arterial hypertension[J].J Heart Lung Transplant,2010,29(2):181-187.
[38]HOEPER M M,MEYER K,RADEMACHER J,et al.Diffusion capacity and mortality in patients with pulmonary hypertension due to heart failure with preserved ejection fraction[J].JACC Heart Fail,2016,4(6):441-449.
[39]NI Y,YU Y,DAI R,et al.Diffusing capacity in chronic obstructive pulmonary disease assessment:a meta-analysis[J].Chronic Respiratory Disease,2021,18:1–11.
[40]CHAOUAT A,NAEIJE R,WEITZENBLUM E.Pulmonary hypertension in COPD[J].Eur Respir J,2008,32(5):1371-1385.
[41]CHAOUAT A,BUGNET A-S,KADAOUI N,et al.Severe pulmonary hypertension and chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2005,172(2):189-194.
[42]WEITZENBLUM E.Chronic corpulmonale[J].Heart,2003,89(2):225-230.
[43]BARBERÀJ A,PEINADO V I,SANTOS S.Pulmonary hypertension in chronic obstructive pulmonary disease[J].Eur Respir J,2003,21(5):892-905.
[44]CELLI B R,COTE C G,LAREAU S C,et al.Predictors of survival in COPD:more than just the FEV1[J].Respir Med,2008,102 Suppl 1:S27-S35.
[45]NAMBU A,ZACH J,SCHROEDER J,et al.Relationships between diffusing capacity for carbon monoxide(DLCO),and quantitative computed tomography measurements and visual assessment for chronic obstructive pulmonary disease[J].Eur J Radiol,2015,84(5):980-985.
[46]DE-TORRES J P,O'DONNELL D E,CABRERA C,et al.Clinical and prognostic impact of low diffusing capacity for carbon monoxide values in patients with Global Initiative for Obstructive Lung Disease I COPD[J].Chest,2021,160(3):872-878.
[47]BOUTOU A K,SHRIKRISHNA D,TANNER R J,et al.Lung function indices for predicting mortality in COPD[J].Eur Respir J,2013,42(3):616-625.










