电针联合康复训练介导 LncRNA MALAT1/ BDNF 调控脑缺血再灌注损伤小鼠皮层突触可塑性的研究论文
2025-06-13 15:59:02 来源: 作者:xuling
摘要:电针联合康复训练可通过介导LncRNA MALAT1/BDNF促进CIRI小鼠神经功能恢复,减小脑梗死体积,改善大脑皮层突触可塑性。
[摘要]目的探究电针联合康复训练对脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)小鼠皮层突触可塑性改善的作用机制。方法选取2024年1—6月安徽中医药大学第二附属医院购买的30只SPF级C57BL/6小鼠作为研究对象,根据随机数字表法分为Sham组、MCAO/R(M)组、ER-M组、sh-NC-M组、sh-MALAT1-M组和sh-MALAT1-M-ER组,每组5只。改良神经严重度评分(Modified Neurological Severity Score,mNSS)量表评价造模完成后1 d和治疗第7天小鼠的神经功能;检测小鼠脑梗死体积;透射电镜观察小鼠突触超微结构;Western blot分析脑组织脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、突触后致密物95(postsynaptic density 95,PSD95)、神经突触素1(synapsin-1)蛋白表达;qRT-PCR检测长链非编码肺腺癌转移相关转录本1(long non-coding RNA metastasis associated lung adenocarcinoma transcript 1,LncRNA MALAT1)、BDNF、PSD95、synapsin-1的RNA表达水平;Pearson分析LncRNA MALAT1与BDNF mRNA水平的相关性;RNA结合蛋白免疫沉淀分析LncRNA MALAT1与BDNF的相互作用。结果造模后第1天,其余组小鼠mNSS评分均高于Sham组,差异有统计学意义(P均<0.05);与Sham组相比,M组和sh-NC-M组治疗第7天的mNSS评分、脑梗死体积、LncRNA MALAT1水平明显增加,ER-M组明显低于M组,sh-MALAT1-M组明显低于sh-NC-M组,sh-MALAT1-M-ER组明显低于ER-M组和sh-MALAT1-M组,差异有统计学意义(P均<0.05);M组和sh-NC-M组突触数量、BDNF、PSD95、synapsin-1蛋白及mRNA表达较Sham组明显降低,ER-M组明显高于M组,sh-MALAT1-M组明显高于sh-NC-M组,sh-MALAT1-M-ER组明显高于ER-M组和sh-MALAT1-M组,差异有统计学意义(P均<0.05);LncRNA MALAT1与BDNF mRNA存在明显相关性(r=-0.751,P<0.001);与使用免疫球蛋白G进行免疫共沉淀的对照组相比,BDNF蛋白-RNA复合物中LncRNA MALAT1明显升高,差异有统计学意义(P<0.05)。结论电针联合康复训练可通过介导LncRNA MALAT1/BDNF促进CIRI小鼠神经功能恢复,减小脑梗死体积,改善大脑皮层突触可塑性。
[关键词]脑缺血再灌注损伤;电针联合康复训练;突触可塑性;肺腺癌转移相关转录本1;脑源性神经营养因子
脑缺血再灌注损伤(cerebral ischemia-reper-fusion injury,CIRI)过程涉及炎症反应、氧化应激及神经元可塑性等多个方面[1]。有研究证实,将电针与跑轮训练联合应用,能进一步改善CIRI小鼠的神经功能[2]。长链非编码RNA肺腺癌转移相关转录本1(long non-coding RNA metastasis associated lung adenocarcinoma transcript 1,LncRNA MALAT1)能够通过调控基因表达、影响细胞增殖与凋亡等机制参与疾病的发生发展[3]。同时,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对神经元的存活、分化及突触可塑性具有显著促进作用[4]。基于此,本研究旨在探讨电针联合康复训练介导LncRNA MALAT1/BDNF调控CIRI小鼠皮层突触可塑性的机制,为CIRI的治疗提供新的思路,现报道如下。
1材料与方法
1.1材料
1.1.1实验动物30只体质量为22~25 g的SPF级C57BL/6小鼠购自杭州子源实验动物科技有限公司[生产许可证号:SCXK(浙)2019-0004],适应性饲养3 d。本研究经安徽中医药大学第二附属医院医学动物实验伦理委员会批准(2022120101)。
1.1.2试剂和仪器海马神经元细胞HT22购自上海联迈生物工程有限公司;LncRNA MALAT1干扰慢病毒购自上海吉凯基因化学技术有限公司;BDNF、突触后致密物95(postsynaptic density 95,PSD95)、神经突触素1(synapsin-1)抗体购自英国Abcam公司;BHW-PT/5S小鼠跑台(安徽必海微软件科技有限公司);15 mm毫针购自马鞍山邦德医疗器械有限公司;韩氏电针仪购自南京济生医疗科技有限公司;H-7650型透射电子显微镜购自日本日立公司。
1.2方法
1.2.1动物分组将30只小鼠按随机数字表法分为假手术组(Sham)、模型组(MCAO/R,M)、电针联合康复训练治疗+模型组(ER-M)、sh-NC+模型组(sh-NC-M)、sh-MALAT1+模型组(sh-MALAT1-M)和sh-MALAT1+模型+电针联合康复训练治疗组(sh-MALAT1-M-ER),每组5只。
1.2.2 CIRI小鼠模型的构建除Sham组外,其余组采用大脑中动脉闭塞(middle cerebral artery occlu⁃sion,MCAO)法建立CIRI小鼠模型。小鼠称重,麻醉,备皮,钝性分离左侧颈总动脉、颈外动脉和颈内动脉,结扎颈外动脉和颈总动脉,夹闭远端颈内动脉。在左侧颈动脉分叉处轻柔插入长度约18 mm的线栓,缝合、消毒。1 h后,拔出线栓约10 mm实现再灌注。Sham组不插入线栓,其余操作同MCAO模型构建。
1.2.3电针联合康复训练治疗及MALAT1慢病毒干扰sh-MALAT1-M组、sh-MALAT1-M-ER组小鼠在造模前3 d接受侧脑室注射LncRNA MALAT1干扰慢病毒(2μL,2 E+9 TU/mL),sh-NC-M组小鼠注射空载体慢病毒对照病毒。
慢病毒干扰实验:小鼠麻醉,将其固定于脑立体定位仪,备皮,消毒,剪开头皮,打磨出注射孔,向侧脑室注射病毒。缝合,放回饲养笼饲养。
电针治疗方法:ER-M组、sh-MALAT1-M-ER组小鼠造模完成后24 h给予电针联合康复训练治疗。穴位定位参照《大鼠穴位图谱的研制》[5],包括百会穴、大椎穴、人中。毫针刺入穴位后,连接韩氏电针仪进行治疗。30 min/次,1次/d,连续治疗7 d。
在电针治疗的基础上进行跑台训练,8~10 m/min,30 min/d,共训练7 d。
1.3观察指标
1.3.1小鼠神经功能的评价采用改良神经严重度评分(Modified Neurological Severity Score,mNSS)量表[6]评价造模后24 h小鼠的神经功能损伤情况及第7天神经功能恢复情况,总分0~18分,评分越高提示损伤越严重。
1.3.2小鼠脑梗死体积的检测治疗完成后麻醉后处死小鼠,取新鲜的全脑组织,切片,采用2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazole chloride,TTC)染色,孵育,拍摄图像,白色和红色区域分别表示脑梗死区和非梗死区。采用Image J软件计算小鼠脑梗死体积占比。
1.3.3小鼠缺血半暗带皮层突触超微结构观察取1 mm×1 mm×1 mm大小的小鼠缺血半暗带皮层区域组织块,固定,脱水,包埋,切片,柠檬酸铅、醋酸铀染色,透射电镜下观察小鼠皮层突触超微结构,拍摄图片。
1.3.4 Western blot定量评估小鼠缺血脑组织中BDNF、PSD95、synapsin-1蛋白表达剪碎脑组织,加入裂解缓冲液和苯甲基磺酰氟,匀浆3次,静置,上清液离心,超声裂解,离心。提取并测定蛋白浓度,电泳分离,转膜,封闭,分别加入BDNF、PSD95、synapsin-1一抗稀释溶液并于4℃震荡过夜,漂洗,加入二抗稀释溶液,室温震荡。漂洗,曝光,显影,以β-actin为内参,Image J软件处理,根据灰度值计算蛋白的相对表达水平。
1.3.5 qRT-PCR检测缺血脑组织LncRNA MALAT1、BDNF、PSD95、synapsin-1的RNA表达提取、纯化脑组织RNA,逆转录,扩增,以U6为内参,扩增。使用2-ΔΔCT公式计算LncRNA MALAT1、BDNF、PSD95、synapsin-1的RNA相对表达水平,PCR引物序列见表1。

1.3.6 LncRNA MALAT1与BDNF相互作用的检验小鼠海马神经元细胞HT22加入等体积RNA结合蛋白免疫沉淀(RNA-binding protein immunoprecipita⁃tion,RIP)裂解液,加入磁珠、RIP Wash Buffer和抗体。加入RIP Immunoprecipitation Buffer,离心,上清液加入磁珠-抗体复合物,孵育过夜,洗涤。提取、纯化RNA,逆转录,qRT-PCR检测LncRNA MALAT1表达。
1.4统计方法
采用SPSS 22.0统计学软件处理数据,mNSS评分、脑梗死体积、突触数量、BDNF、PSD95、synapsin-1蛋白表达水平、MALAT1、BDNF、PSD95、synapsin-1的RNA表达水平均为计量资料,经Shapiro-Wilk检验符合正态分布,以(±s)表示,组间比较行两独立样本t检验,组内比较行配对样本t检验;Pearson检验分析LncRNA MALAT1与BDNF mRNA的相关性。P<0.05为差异有统计学意义。
2结果
2.1各组小鼠神经功能评分比较
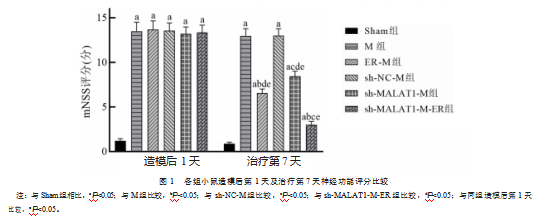
造模后第1天,Sham组小鼠mNSS评分均明显低于其余各组,差异有统计学意义(t=26.294、28.334、30.748、33.914、32.368,P均<0.001),提示造模成功。治疗第7天,M组和sh-NC-M组小鼠的mNSS评分较Sham组明显增加,差异有统计学意义(t=32.331、34.489,P均<0.001);ER-M组明显低于M组,差异有统计学意义(t=15.189,P<0.001);sh-MALAT1-M组明显低于sh-NC-M组,差异有统计学意义(t=10.580,P<0.001);sh-MALAT1-M-ER组明显低于ER-M组和sh-MALAT1-M组,差异有统计学意义(t=13.333、17.503,P均<0.001);治疗第7天,ER-M组、sh-MALAT1-M组和sh-MALAT1-M-ER组mNSS评分均明显低于造模后第1天,差异有统计学意义(t=14.958、11.132、26.109,P均<0.001)。见图1。
2.2各组小鼠治疗第7天脑梗死体积比较
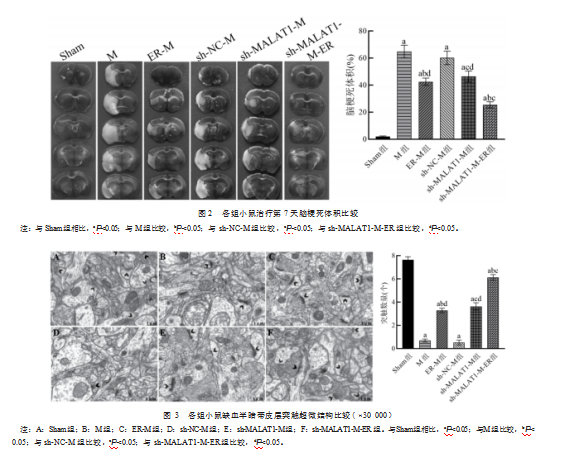
治疗完成后,M组和sh-NC-M组小鼠脑梗死体积明显高于Sham组,差异有统计学意义(t=30.078、25.863,P均<0.001);ER-M组明显低于M组,差异有统计学意义(t=9.261,P<0.001);sh-MALAT1-M组明显低于sh-NC-M组,差异有统计学意义(t=4.776,P<0.001);sh-MALAT1-M-ER组明显低于ER-M组和sh-MALAT1-M组,差异有统计学意义(t=10.922、10.015,P均<0.001)。见图2。
2.3各组小鼠缺血半暗带皮层突触超微结构比较Sham组小鼠缺血半暗带皮层突触数量多,且结构完整、清晰,突触囊泡大小均匀且丰富;M组和sh-NC-M组小鼠突触间隙融合,突触结构溶解,突触囊泡稀疏;ER-M组和sh-MALAT1-M组突触囊泡数量较M组、sh-NC-M组增加,间隙融合现象减轻,结构较清晰;sh-MALAT1-M-ER组突触结构溶解等情况进一步改善。与Sham组相比,M组和sh-NC-M组小鼠缺血半暗带皮层突触数量明显减少,差异有统计学意义(t=53.462、47.636,P均<0.001);ER-M组较M组明显增加,差异有统计学意义(t=25.156,P<0.001);sh-MALAT1-M组明显多于sh-NC-M组,差异有统计学意义(t=18.110,P<0.001);ER-M组、sh-MALAT1-M组明显少于sh-MALAT1-M-ER组,差异有统计学意义(t=20.746、13.975,P均<0.001)。见图3。
2.4各组小鼠缺血脑组织中BDNF、PSD95、synap⁃sin-1蛋白表达水平比较
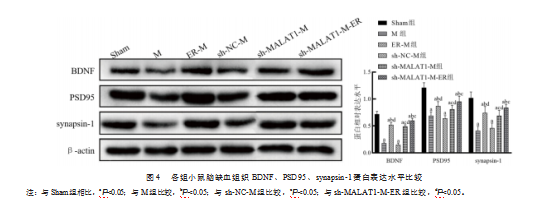
与Sham组相比,M组和sh-NC-M组小鼠缺血脑组织中BDNF更低,差异有统计学意义(t=22.422、21.859,P均<0.001),PSD95更低,差异有统计学意义(t=10.198、12.380,P均<0.001),synapsin-1蛋白表达水平更低,差异有统计学意义(t=10.028、8.810,P均<0.001);ER-M组高于M组,差异有统计学意义(t=17.000、3.786、5.116,P均<0.05);sh-MALAT1-M组高于sh-NC-M组,差异有统计学意义(t=17.920、4.419、3.823,P均<0.05);sh-MALAT1-M-ER组高于ER-M组,差异有统计学意义(t=3.162、2.464、2.376,P均<0.05),也高于sh-MALAT1-M组,差异有统计学意义(t=4.919、2.565、2.876,P均<0.05)。见图4。
2.5各组小鼠缺血脑组织中MALAT1、BDNF、PSD95、synapsin-1的RNA表达水平比较
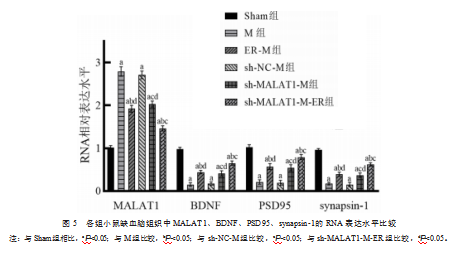
与Sham组比较,M组和sh-NC-M组LncRNA MALAT1水平升高,差异有统计学意义(t=32.940、36.922,P均<0.001);ER-M组低于M组,差异有统计学意义(t=14.303,P<0.001);sh-MALAT1-M组低于sh-NC-M组,差异有统计学意义(t=13.336,P<0.001);sh-MALAT1-M-ER组低于ER-M组和sh-MALAT1-M组,差异有统计学意义(t=10.286、13.825,P均<0.001);M组和sh-NC-M组BDNF mRNA较Sham组降低,差异有统计学意义(t=32.809、32.018,P均<0.001),PSD95 mRNA较Sham组降低,差异有统计学意义(t=23.190、21.872,P均<0.001),synapsin-1 mRNA较Sham组降低,差异有统计学意义(t=41.637、31.062,P均<0.001)。ER-M组高于M组,差异有统计学意义(t=11.463、9.358、8.437,P均<0.001);sh-MALAT1-M组高于sh-NC-M组,差异有统计学意义(t=7.442、8.489、6.957,P均<0.001);sh-MALAT1-M-ER组高于ER-M组,差异有统计学意义(t=7.334、5.336、8.032,P均<0.001),也高于sh-MALAT1-M组,差异有统计学意义(t=6.871、6.063、8.730,P均<0.001)。见图5。
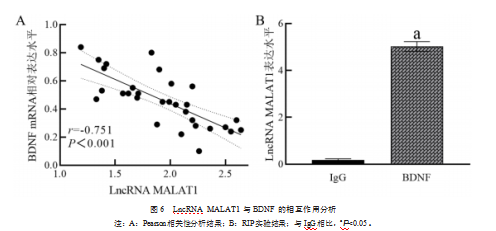
2.6 LncRNA MALAT1与BDNF的相互作用分析
LncRNA MALAT1与BDNF mRNA存在明显负相关(r=-0.751,P<0.001)。见图6A。与使用IgG进行免疫共沉淀的对照组相比,BDNF-RNA复合物中LncRNA MALAT1明显升高,差异有统计学意义(t=49.656,P<0.001)。见图6B。
3讨论
在神经科学领域,CIRI的治疗策略探索持续吸引着研究者的关注。尽管传统治疗手段取得了一定进展,但针对CIRI后神经元损伤与功能恢复的关键机制仍待深入解析。近年来,非编码RNA特别是LncRNA MALAT1在神经系统疾病中的调控作用逐渐显现,其通过复杂的分子网络影响神经元形态与功能[7-9]。同时,BDNF作为促进神经元存活与突触可塑性的关键因子,其表达调控成为神经修复研究的热点。鉴于电针疗法与康复训练在神经康复中的协同效应,本研究创新性地提出电针联合康复训练可能通过调控LncRNA MALAT1/BDNF信号通路,促进CIRI小鼠皮层突触可塑性的恢复。这一前沿假设不仅挑战了现有治疗理念,也为开发更加精准、有效的CIRI治疗策略提供了新的视角和实验基础。通过深入探究这一机制,旨在为临床患者带来更为显著的康复效果,提升生活质量。
本研究结果显示,电针联合康复训练显著降低了CIRI小鼠的mNSS评分。董苗苗等[10]发现,电针干预可改善CIRI大鼠神经功能,减少脑组织梗死体积。兰崴等[11]证实,电针结合康复训练可有效促进大鼠缺血侧大脑神经干细胞增殖。这些研究均强调了针灸和康复训练在促进CIRI后神经功能恢复中的积极作用。
Hu Y等[12]的研究证实,LncRNA MALAT1在CIRI小鼠脑组织中高表达,下调其表达可显著减轻缺氧/复氧对脑组织的损伤程度。本研究发现,CIRI小鼠中LncRNA MALAT1高表达,敲低其表达可以显著减轻小鼠的神经功能损伤,减少脑梗死体积,并促进突触可塑性的改善。Jin J等[13]发现,抑制LncRNA MARAT 1可通过调节AQP 4表达减轻CIRI小鼠脑组织损伤。这些结果表明,LncRNA MALAT1高表达可能抑制了突触重塑的过程,还可能通过与DNA、RNA或蛋白质相互作用,调控下游基因表达,参与CIRI发生发展。
本研究发现,CIRI小鼠BDNF表达显著下调,而电针联合康复训练能够显著上调其表达。这一发现进一步证实了BDNF在促进CIRI小鼠神经功能恢复中的关键作用。此外,本研究还发现LncRNA MALAT1与BDNF之间存在显著的负相关性,提示LncRNA MALAT1可能通过调控BDNF的表达来影响CIRI小鼠的神经修复过程。
本研究RIP实验结果显示,LncRNA MALAT1能够与BDNF直接结合并调控其表达。但ENCORI数据库中并未显示LncRNA MALAT1与BDNF间可能存在的靶向结合位点。本研究的这一发现揭示了LncRNA MALAT1在CIRI中发挥作用的新机制。Wu G[14]等证明了LncRNA MALAT1、BDNF分别与mRNA-129-5p存在靶向结合位点,LncRNA MALAT1通过抑制mRNA-129-5p表达上调BDNF的表达和分泌,促进施旺细胞的增殖和迁移。Ln⁃cRNA MALAT1可能通过靶向调节某些miRNA,间接影响miRNA靶点的表达,从而参与疾病的发生发展。
突触可塑性是神经系统适应环境变化的重要机制之一,也是神经修复和神经功能恢复的关键环节[15]。本研究发现,电针联合康复训练能够显著增加CIRI小鼠大脑皮层的突触数量,并上调PSD95和synapsin-1突触相关蛋白的表达。BDNF作为促进突触生长和可塑性的关键因子,其表达水平的上调可能直接促进了突触的重塑和功能的恢复。而Ln⁃cRNA MALAT1则可能通过调控BDNF的表达来间接影响突触可塑性。
综上所述,电针联合康复训练能够改善CIRI小鼠神经功能、减小脑梗死体积、促进大脑皮层突触可塑性方面的显著作用,LncRNA MALAT1/BDNF信号通路在这一过程中发挥了关键的调控作用。
[参考文献]
[1]Zhang Q,Jia M,Wang Y,et al.Cell death mechanisms in cerebral ischemia-reperfusion injury[J].Neurochem Res,2022,47(12):3525-3542.
[2]廖恒,郭俐宏,高玉姣,等.电针联合跑轮训练对脑缺血再灌注损伤模型大鼠神经及运动功能恢复的影响[J].世界科学技术-中医药现代化,2022,24(8):3249-3254.
[3]Malakoti F,Targhazeh N,Karimzadeh H,et al.Multiple function of lncRNA MALAT1 in cancer occurrence and progression[J].Chem Biol Drug Des,2023,101(5):1113-1137.
[4]Song L,Mu L,Wang H.MicroRNA-489-3p aggravates neuronal apoptosis and oxidative stress after cerebral ischemia-reperfusion injury[J].Bioengineered,2022,13(6):14047-14056.
[5]华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[6]杨树升,林丽,邱明义,等.大承气汤对脑出血模型大鼠mNSS评分及Nrf2信号通路的影响[J].华中科技大学学报:医学版,2016,45(2):164-169.
[7]Xiao W,Halabi R,Lin CH,et al.The lncRNA Malat1 is trafficked to the cytoplasm as a localized mRNA encod⁃ing a small peptide in neurons[J].Genes Dev,2024,38(7-8):294-307.
[8]Wright BW,Wilusz JE.An unexpected path for Malat1 in neurons:Trafficking out of the nucleus for translation[J].Genes Dev,2024,38(7-8):291-293.
[9]Ming Y,Deng Z,Tian X,et al.Anti-apoptotic capacity of MALAT1 on hippocampal neurons correlates with CASP3 DNA methylation in a mouse model of autism[J].Metab Brain Dis,2023,38(8):2591-2602.
[10]董苗苗,赖涵,李曼玲,等.电针干预脑缺血再灌注损伤模型大鼠核苷酸结合寡聚化结构域样受体蛋白3/半胱天冬氨酸蛋白酶1表达的变化[J].中国组织工程研究,2022,26(5):749-755.
[11]兰崴,唐巍.电针结合康复训练对脑缺血再灌注大鼠大脑部位Nestin、bFGF、EGF表达影响[J].辽宁中医药大学学报,2020,22(6):60-63.
[12]Hu Y,Ye C,Cheng S,et al.Propofol downr-egulates lncRNA MALAT1 to alleviate cerebral ischemia-reperfusion injury[J].Inflammation,2021,44(6):2580-2591.
[13]Jin J,Wang H,Zheng X,et al.Inhibition of LncRNA MALAT1 attenuates cerebral ischemic reperfusion in⁃jury via regulating AQP4 expression[J].Eur Neurol,2020,83(6):581-590.
[14]Wu G,Li X,Li M,et al.Long non-coding RNA MALAT1 promotes the proliferation and migration of schwann cells by elevating BDNF through sponging miR-129-5p[J].Exp Cell Res,2020,390(1):111937.
[15]Appelbaum LG,Shenasa MA,Stolz L,et al.Synaptic plasticity and mental health:Methods,challenges and opportunities[J].Neuropsychopharmacology,2023,48(1):113-120.










