苦参凝胶联合奥硝唑对耐药性滴虫性阴道炎患者临床症状消失时间、炎症反应指标的影响论文
2025-04-24 15:21:28 来源: 作者:xuling
摘要:苦参凝胶结合奥硝唑联合治疗耐药性滴虫性阴道炎患者疗效显著,临床症状消失时间缩短,炎症反应得到有效控制。
【摘要】目的:探讨苦参凝胶结合奥硝唑对耐药性滴虫性阴道炎患者临床症状消失时间和炎症反应指标的影响。方法:选取2022年9月—2023年8月黔西南州中医医院收治的80例患有耐药性滴虫性阴道炎的患者作为研究对象,随机分为A组和B组,每组各40例。A组接受苦参凝胶和奥硝唑联合治疗,B组接受传统治疗,即奥硝唑单独治疗。比较两组临床症状消失时间、炎症反应指标情况。结果:治疗后,A组临床常见症状消失时间短于B组,差异有统计学意义(P<0.05)。治疗后,A组白细胞介素-8(IL-8)、白细胞介素-13(IL-13)水平低于对照组,差异有统计学意义(P<0.05)。结论:苦参凝胶结合奥硝唑联合治疗耐药性滴虫性阴道炎患者疗效显著,临床症状消失时间缩短,炎症反应得到有效控制。
【关键词】苦参凝胶,耐药性,滴虫性阴道炎,联合用药
阴道滴虫性阴道炎是由滴虫寄生引起的女性生殖道感染,是全球女性常见的健康问题之一。疾病的典型症状包括阴道分泌物增多、瘙痒感、灼热感和尿频等,严重时可能影响患者的性生活和生活质量。据世界卫生组织(WHO)统计,阴道滴虫感染全球范围内广泛存在,尤其在发展中国家,其发生率更是居高不下[1-3]。然而,随着抗生素的广泛应用,特别是甲硝唑和奥硝唑等抗滴虫药物,耐药性滴虫性阴道炎的问题逐渐凸显。耐药性使得传统治疗方案失效,导致症状反复出现,给患者的生活带来了诸多不便,临床上已经观察到了对这些药物的耐药性逐渐增加的趋势,使得治疗变得更加困难和复杂。尽管一些研究努力探索耐药性滴虫性阴道炎的治疗方法,但当前文献中仍存在一些显著的知识空缺,已有的治疗方案虽然在一定程度上可以缓解患者的症状,但并未根治疾病,且在耐药性问题上的表现不尽如人意[4]。同时,关于新治疗方法的研究相对较少,对于滴虫性阴道炎的复杂生态学和耐药机制的理解仍然有限。苦参凝胶作为一种天然草药,其抗炎和抗菌的潜力可能为治疗提供新的方向。鉴于此,本研究旨在深入探讨耐药性滴虫性阴道炎的治疗问题,寻找一种新的、更有效的治疗方案,以期为患有耐药性滴虫性阴道炎的女性提供更好的治疗选择[5-7],现报告如下。
1资料与方法
1.1一般资料
选取2022年9月—2023年8月黔西南州中医医院收治的80例患有耐药性滴虫性阴道炎的患者作为研究对象,随机分为A组和B组,每组各40例。A组年龄22~47岁,平均年龄(36.13±5.57)岁;患病时间7~20 d,平均患病时间(22.13±1.69)d。B组年龄18~50岁,平均年龄(36.79±5.72)岁;患病时间6~22 d,平均患病时间(22.56±1.99)d。本研究经黔西南州中医医院伦理会批准,患者和家属对研究知情并签署同意书。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。
纳入标准:在临床症状和实验室检查(如湿涂片、培养)中均显示存在滴虫感染,曾经接受过常规治疗(如甲硝唑、奥硝唑)但症状未获得持久缓解。
排除标准:同时患有其他导致相似症状的生殖道感染,如细菌性阴道病、霉菌感染等;孕妇因为生理原因而使用限制特定药物;患有严重的基础疾病,如免疫系统缺陷等;对计划使用的治疗药物存在过敏反应或严重不良反应;儿童和青少年。
1.2方法
A组接受苦参凝胶联合奥硝唑治疗,苦参凝胶(贵阳新天药业股份有限公司,国药准字Z20050058,规格:5 g×4支)外用,用药之前清洁双手,将凝胶缓慢推入阴道,1支/次,1次/d。奥硝唑(湖南九典制药有限公司,国药准字H20113125,规格:0.25 g×12片)1.0~1.5 g/次,1次/d。
B组接受传统治疗,即奥硝唑单独治疗,给药方法同A组。
1.3观察指标
(1)比较两组症状消失时间。(2)采集空腹静脉血,采用酶联免疫吸附法比较两组白细胞介素-8(IL-8)、白细胞介素-13(IL-13)水平。
1.4统计学处理
采用SPSS 25.0软件进行统计学分析。计量资料以均数±标准差(x-±s)表示,检验正态性和方差齐性,组间比较采用两独立样本t检验。计数资料以例数和百分比(%)表示,组间比较采用字2检验。以P<0.05为差异有统计学意义。
2结果
2.1两组症状消失时间比较
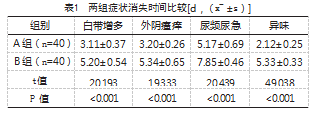
A组用药后白带增多、外阴瘙痒、尿频尿急和异味症状消失时间均明显短于B组,差异有统计学意义(P<0.05),见表1。
2.2两组治疗前后炎症因子水平比较
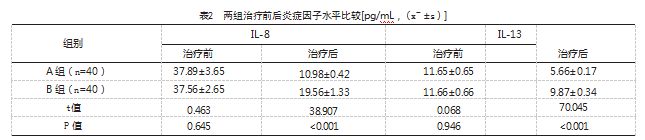
治疗前,两组炎症因子水平比较,差异无统计学意义(P>0.05);治疗后,A组炎症因子水平低于B组,差异有统计学意义(P<0.05)。见表2。
3讨论
阴道滴虫性阴道炎是由滴虫寄生引起的一种常见的女性生殖道感染。然而,随着抗生素的广泛应用,特别是甲硝唑和奥硝唑等抗滴虫药物,耐药性滴虫性阴道炎的问题逐渐凸显[8]。耐药性使得传统治疗方案失效,导致症状反复出现,给患者的生活带来了诸多不便[9]。随着抗生素使用的普及,我国耐药性滴虫性阴道炎的发病率逐渐上升,成为阴道感染治疗领域面临的一项严重挑战[10]。在许多情况下,传统的抗滴虫药物已经无法满足患者的需求,因为滴虫对这些药物产生了耐药性。与其他国家相比,由于地域、生活方式等因素的不同,我国在滴虫性阴道炎的发病率和治疗难度上可能存在差异。临床医生在面对耐药性滴虫性阴道炎时,亟需寻找新的治疗策略以提高治疗效果[11]。
传统的治疗方案主要包括甲硝唑和奥硝唑等抗滴虫药物。然而,这些药物的广泛使用导致了滴虫对其产生耐药性,从而减弱了其治疗效果[12-14]。此外,一些患者可能对传统治疗方案产生不良反应,如药物过敏等,使得选择合适的治疗方案变得更加困难。因此,本研究以苦参凝胶和奥硝唑联合治疗作为创新方案,旨在应对耐药性滴虫性阴道炎治疗的困境[15]。通过观察临床症状的消失时间和炎症反应指标的变化,我们得出联合治疗方案在改善患者症状和降低炎症水平方面的显著优势。这一疗效的显著性对于耐药性滴虫性阴道炎患者来说具有实际应用的临床意义,为患者提供了更为有效的治疗选择[16]。
本研究结果显示,A组临床症状消失时间明显低于B组,表明苦参凝胶和奥硝唑联合治疗能够更迅速地缓解患者的常见症状,包括白带增多、外阴瘙痒、尿频尿急和异味等,这一观察结果为联合治疗方案在改善患者生活质量方面的临床应用提供了有力的证据。在炎症反应方面,A组治疗后IL-8、IL-13水平低于B组,表明苦参凝胶联合奥硝唑治疗不仅在缓解症状上取得了成功,同时也显著降低了患者体内的炎症水平,从而有助于减轻患者疼痛感、提高患者生活质量,并可能减缓疾病的复发[17]。本研究结果提示,苦参凝胶和奥硝唑联合治疗在改善症状和降低炎症水平方面具有显著的疗效。这可能归因于苦参凝胶具有的抗炎和抗菌活性,与奥硝唑的联合应用产生协同效应[18]。对于滴虫性阴道炎患者,特别是那些耐药性患者,这一治疗方案的成功应用为开发更有效的联合治疗方案提供了启示[19-20]。
综上所述,苦参凝胶和奥硝唑联合应用治疗耐药性滴虫性阴道炎可改善患者临床症状,降低炎症水平,为耐药性滴虫性阴道炎的治疗提供了新的思路和选择。然而,未来仍需更多大规模、多中心的研究来验证这一疗效,并深入了解其机制,以进一步提高治疗水平和改善患者生活质量。同时,本研究还有不足之处,首先,样本量相对较小,临床试验的外部推广性受到一定限制;其次,长期疗效和复发率的观察期相对较短,未来的研究应该更加关注这些方面;最后,对于苦参凝胶联合奥硝唑治疗的具体机制仍需深入研究,以揭示其在耐药性滴虫性阴道炎治疗中的作用机制。
参考文献
[1]KISSINGER P.Trichomonas vaginalis:a review of epidemiologic,clinical and treatment issues[J].BMC Infect Dis,2015,15(5):307.
[2]SOBEL R,SOBEL J D.Metronidazole for the treatment of vaginal infections[J].Expert Opin Pharmacother,2015,16(7):1109-1115.
[3]JIN L,BAI X,LUAN N,et al.A designed tryptophan-and lysine/arginine-rich antimicrobial peptide with therapeutic potential for clinical antibiotic-resistant[J].Candida Albicans Vaginitis,2016,59(5):1791-1799.
[4]SOBEL J D.Recurrent vulvovaginal candidiasis[J].Am J Obstet Gynecol,2016,214(1):15-21.
[5]KAAMBO E,FRICA C W J.The threat of aerobic vaginitis to pregnancy and neonatal morbidity[J].Afr J Reprod Health,2017,21(2):108-118.
[6]HASHEMI M M,ROVIG J,HOLDEN B S,et al.Ceragenins are active against drug-resistant candida auris clinical isolates in planktonic and biofilm forms[J].J Antimicrob Chemother,2018,73(6):1537-1545.
[7]SOBEL J D,SOBEL R.Current treatment options for vulvovaginal candidiasis caused by azole-resistant Candida species[J].Expert Opin Pharmacother,2018,19(9):971-977.
[8]LIRIO J,GIRALDO P C,AMARAL R L,et al.Antifungal(oral and vaginal)therapy for recurrent vulvovaginal candidiasis:a systematic review protocol[J].BMJ Open,2019,9(5):103-105.
[9]PANIAGUA C G L,MONROY P E,SOLIS R R,et al.O-serogroups of multi-drug resistant cervicovaginal Escherichia coli harboring a battery of virulence genes[J].J Infect Chemother,2019,25(7):494-497.
[10]RODRIGUEZ C C,GREGORIO M C,MOLARESV A,et al.Biofilms and vulvovaginal candidiasis[J].Colloids Surf B Biointerfaces,2019,17(4):110-125.
[11]BOHBOT J M,BRAMI G,GOUBARD A,et al.Ten questions about bacterial vaginosis[J].Gynecol Obstet Fertil,2020,48(9):693-702.
[12]MELODY K,ROY C N,KLINE C,et al.Long-acting Rilpivirine(RPV)preexposure prophylaxis does not inhibit vaginal transmission of RPV-resistant HIV-1 or select for high-frequency drug resistance in humanized mice[J].J Virol,2020,94(8):121.
[13]RIGO G V,TASCA T.Vaginitis:review on drug resistance[J].Curr Drug Targets,2020,21(16):1672-1686.
[14]SINGH R.Single-cell sequencing in human genital infections[J].Adv Exp Med Biol,2020,12(55):203-220.
[15]TOMAS M,PALMEIRAO A,SIMOESS,et al.Bacterial vaginosis:Standard treatments and alternative strategies[J].Int J Pharm,2020,58(7):119659.
[16]SCILLATO M,SPITALE A,MONGELLI G,et al.Antimicrobial properties of Lactobacillus cell-free supernatants against multi drug-resistant uro genital pathogens[J].Microbiologyopen,2021,10(2):110-112.
[17]CENKOWSKI M,WUDEL B,POLIQUIN V.Vaginal trichomoniasis[J].Cma J,2022,194(6):217.
[18]SOBEL J D,AKINS R.Determining susceptibility in candida vaginal isolates[J].Antimicrob Agents Chemother,2022,66(6):46-49.
[19]SOBEL J D,SEBASTIAN S,BOIKOV D A.A longitudinal study on fluconazole resistance in Candida albicans vaginal isolates[J].Mycoses,2023,66(7):563-565.
[20]SOUSA L G V,PEREIRA S A,CERCA N.Fighting polymicrobial biofilms in bacterial vaginosis[J].Microb Biotechnol J,2023,16(7):1423-1437.










