胃癌新辅助化疗疗效的影响因素分析论文
2025-03-07 11:26:03 来源: 作者:xuling
摘要:NAC前患者的肿瘤临床T分期、血小板分布宽度、腺苷脱氨酶、尿素是预测治疗疗效的独立影响因素。在筛查适合开展NAC的胃癌患者时,应重点关注上述指标。
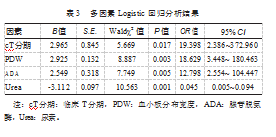
[摘要]目的探讨与分析胃癌新辅助化疗(neoadjuvant chemotherapy,NAC)疗效的影响因素。方法回顾性选取2019年1月—2022年6月在苏州大学第三附属医院胃肠外科接受NAC治疗的60例胃癌(gastric cancer,GC)患者的临床资料。根据肿瘤消退分级(tumor regression grade,TRG)将其分为有效组(n=33)和无效组(n=27)。比较两组患者的临床资料,采用多因素Logistic回归分析筛选可预测疗效的独立因素。结果本研究中NAC有效率为55.00%(33/60)。Logistic回归分析结果显示,胃癌患者NAC前较高的血小板分布宽度(OR=18.629,95%CI:3.448~180.463)、较高的腺苷脱氨酶(OR=12.798,95%CI:2.554~104.447)、较晚的临床T分期(OR=19.398,95%CI:2.386~372.960)是NAC治疗胃癌疗效的独立危险因素(P均<0.05);较高的尿素水平(OR=0.045,95%CI:0.005~0.094)是NAC治疗胃癌疗效的独立保护因素(P<0.05)。结论NAC前患者的肿瘤临床T分期、血小板分布宽度、腺苷脱氨酶、尿素是预测治疗疗效的独立影响因素。在筛查适合开展NAC的胃癌患者时,应重点关注上述指标。
[关键词]胃癌;新辅助化疗;疗效
胃癌(gastric cancer,GC)是最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因[1]。尽管手术方法和手术技巧有所改进,但GC患者的5年总生存率仍低于25%[1]。近年来,新辅助化疗(neoad⁃juvant chemotherapy,NAC)已被证明可以降低GC患者的肿瘤分期并增加根治性手术的可能性[2]。随着对肿瘤药物的不断研究,出现了许多NAC方案,但治疗的整体临床缓解率仅为20%~45%[3-4]。因此,在选择NAC之前预测疗效至关重要,但目前预测指标尚未被标准化。
门脉期CT扫描得出的放射学特征和一些临床标记物是NAC预测模型的关键组成部分[5]。但这些参数不易获取且预测效能较低,不利于推广使用。在临床工作中,研究人员容易忽略正常范围内的外周血指标,导致不能发现潜在的临床意义。2020年,Chen YH等[6]曾尝试利用外周血指标来预测GC患者的NAC疗效,但其研究纳入的指标不全面,且模型的预测能力较弱。本研究旨在弥补上述研究不足,利用经济且简单的临床参数开发GC患者NAC疗效的预测模型,以期协助外科医生精确选择可能的受益者。现报道如下。
1资料与方法
1.1一般资料
回顾性选取2019年1月—2022年6月在苏州大学第三附属医院胃肠外科接受NAC治疗的60例胃癌(gastric cancer,GC)患者的临床资料。根据肿瘤消退分级(tumor regression grade,TRG)将其分为有效组(33例)和无效组(27例)。本研究经医学伦理委员会审核批准。
1.2纳入与排除标准
纳入标准:①胃镜活检病理诊断为胃腺癌[7];②经过多学科审议后决定进行NAC;③患者接受替吉奥和奥沙利铂(tigio and oxaliplatin,SOX)新辅助治疗方案;④拥有完整的临床数据和实验室检验结果;⑤完成整个NAC周期;⑥NAC术后1个月内进行根治性GC切除术(D2)。
排除标准:①NAC前有放疗史者;②化疗期间接受额外放疗或免疫治疗者;③未能完成规定的化疗方案者;④影像学、病理或血液学检查结果不完整者;⑤合并急性疾病者(如急性感染、急性脏器功能不全等);⑥合并慢性疾病(如慢性肾功能不全、慢性肝功能不全,慢性凝血病,慢性血液学功能不全等)未得到控制和稳定者;⑦曾患有其他恶性肿瘤者。
1.3方法
收集所有患者的临床资料。①生物学资料:包括年龄、性别、体重指数(body mass index,BMI)。②肿瘤相关资料:包括肿瘤部位、肿瘤分化程度、肿瘤临床分期、临床T(clinical T,cT)分期、临床淋巴结(clinical N,cN)分期和新辅助治疗周期。③实验室指标:包括血红蛋白(hemoglobin,HB)、血小板分布宽度(platelet distribution width,PDW)、腺苷脱氨酶(adenosine deaminase,ADA)、尿素(Urea)、糖类抗原199(carbohydrate antigen 199,CA199)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)。
本研究中,两名病理学家依据第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)的医务工作者一致认同肿瘤退缩分级(tumor regression grade,TRG)评估了NAC的有效性[8]。其中TRG=3为少量肿瘤消退或进一步进展性恶化设为无效组,TRG=0~2为肿瘤退缩表现较为满意设为有效组[9]。
患者的肿瘤临床分期、cT分期和cN分期由专业影像学医生判断。
1.4统计方法
使用SPSS 27.0和R 4.2.1统计学软件进行数据分析。依据连续性数值变量(BMI等)是否符合正态分布,分别选择平均数或中位数作为截断点,将连续性数值变量转变为分类变量,用例数(n)表示,行χ2检验,P<0.05为差异有统计学意义。
2结果
2.1两组患者生物学资料、肿瘤特征、化疗周期和血清学指标比较
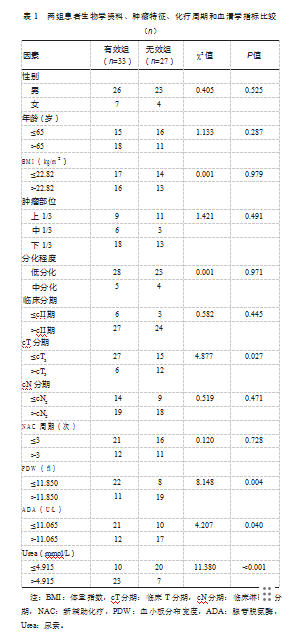
两组患者cT分期、PDW、ADA和Urea比较,差异有统计学意义(P均<0.05)。两组年龄、性别、BMI、肿瘤部位、肿瘤分化程度、肿瘤临床分期、cN分期和化疗周期对比,差异无统计学意义(P均>0.05),见表1。
2.2多因素Logistic回归分析
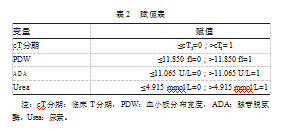
将单因素Logistic回归分析中差异有统计学意义的指标纳入多因素Logistic回归并进行赋值,见表2。结果显示,胃癌患者NAC前较高的PDW(OR=18.629,95%CI:3.448~180.463)、较高的ADA(OR=12.798,95%CI:2.554~104.447)、较晚的cT分期(OR=19.398,95%CI:2.386~372.960)是NAC治疗胃癌疗效的独立危险因素(P均<0.05);较高的Urea水平(OR=0.045,95%CI:0.005~0.094)是NAC治疗胃癌疗效的独立保护因素(P<0.05),见表3。
3讨论
除了降低肿瘤分期和提高根治性切除的可能性外,NAC还消除了胃癌的早期微转移并提高了患者的生存率[10]。然而接受NAC后达到病理完全缓解(TRG=0)的胃癌患者仅有10%[11]。因此,筛选对NAC敏感的患者至关重要。
PDW是用于评估血小板形态和活化的重要指标[12]。血小板活化后释放转化生长因子-β(trans⁃forming growth factor-β,TGF-β)能够使肿瘤细胞的DNA免受损伤,在癌症细胞中产生化学耐药并促进肿瘤细胞的转移[13]。同时,有研究发现使用TGF-β抑制剂可以促进癌细胞在G1/S期以外分裂,从而增加化疗的敏感性[14-15]。此外,在Chen H等[16]的研究中发现,活化的血小板衍生的TGF-β以刺激胰腺癌细胞中的PI3K/Akt和MEK/Erk信号传导,从而降低化疗的敏感性。这就解释了为什么PDW水平高的患者不易在NAC中获益。类似的结果在乳腺癌患者的NAC中也被发现[17],但作为胃癌NAC的预测指标尚未被挖掘。
ADA的主要参与腺苷的代谢。在肿瘤经历缺氧和坏死时,腺苷将被大量释放[18-19]。这也导致ADA的补偿性增加,当积累的腺苷与腺苷受体结合时,有效的抗肿瘤免疫反应被抑制,这能够促进骨髓来源抑制细胞和调节性T细胞的增殖和激活[20]。在这种免疫抑制微环境中,NAC破坏肿瘤的能力受到损害[21]。人体通过肝脏中的尿素循环产生尿素,有研究表明,尿素水平低的的患者在药物治疗的早期更容易发生肝损害[22]。此外,在大型队列研究中,肝功能障碍已被确定为预后不良的危险因素。cT分期较高的患者的病情往往更严重,反映出更深的肿瘤受累情况。肿瘤的局部缺氧和肿瘤微环境中炎症因子的大量积聚会影响NAC的疗效[23-24]。
本研究结果显示PDW、ADA、Urea、肿瘤cT分期是预测NAC治疗胃癌疗效的独立因素(OR=18.629、12.798、0.045、19.398,P均<0.05)。在刘怡等[23]的相关研究中显示,NAC有效性的独立影响因素为年龄(P=0.027)、cT分期(OR=2.90,95%CI:1.04~8.01,P=0.041)、肿瘤直径(OR=7.15,95%CI:1.72~29.65,P=0.007)。本研究结果与其相似。
综上所述,NAC前患者的肿瘤cT分期、PDW、ADA、Urea是预测治疗疗效的独立影响因素。因此,在筛查适合开展NAC的胃癌患者时应重点关注这些指标。
[参考文献]
[1]Smyth EC,Nilsson M,Grabsch HI,et al.Gastric cancer[J].Lancet,2020,396(10251):635-648.
[2]单慧明,周靖宇,谢婷婷,等.MRI影像学特征预测乳腺癌新辅助化疗疗效的可行性[J].中国医学影像学杂志,2019,27(12):905-909,913.
[3]冯彩珍,程瑾,洪楠,等.胃癌新辅助化疗效果影像学评估进展[J].中国实用外科杂志,2018,38(10):1197-1200.
[4]Zhang X,Liang H,Li Z,et al.Perioperative or postopera⁃tive adjuvant oxaliplatin with S-1 versus adjuvant oxali⁃platin with capecitabine in patients with locally advanced gastric or gastro-oesophageal junction adenocarcinoma undergoing D2 gastrectomy(RESOLVE):An open-label,superiority and non-inferiority,phase 3 randomised con⁃trolled trial[J].Lancet Oncol,2021,22(8):1081-1092.
[5]Wang Y,Zhang J,Guo S,et al.Indications of neoadjuvant chemotherapy for locally advanced Gastric Cancer patients based on pre-treatment clinicalpathological and labora⁃tory parameters[J].JCancer,2020,11(20):6000-6008.
[6]Chen YH,Xiao J,Chen XJ,et al.Nomogram for predict⁃ing pathological complete response to neoadjuvantchemo⁃therapy in patients with advanced gastric cancer[J].World Journal of Gastroenterology,2020,26(19):2427-2439.
[7]Xu X,Zheng G,Zhang T,et al.Is pathologic tumor regres⁃sion grade after neo-adjuvant chemotherapy a promising prognostic indicator for patients with locally advanced gastric cancer?A cohort study evaluating tumor regres⁃sion response[J].Cancer Chemother Pharmacol,2019,84(3):635-646.
[8]Amin MB,Greene FL,Edge SB,et al.The Eighth Edi⁃tion AJCC Cancer Staging Manual:Continuing to build a bridge from a population-based to a more"personalized"approach to cancer staging[J].CA:A cancer journal for clinicians,2017,67(2):93-99.
[9]Ikoma N,Estrella JS,Blum Murphy M,et al.Tumor re⁃gression grade in gastric cancer after preoperative therapy[J].J Gastrointest Surg,2021,25(6):1380-1387.
[10]李清婉,张治平,高德培,等.CT影像组学标签预测局部进展期胃癌新辅助化疗疗效的多中心分析[J].医学影像学杂志,2022,32(4):619-625.
[11]周悦乔,林辉雄,刘志强.新辅助化疗对晚期非小细胞肺癌患者疗效及血清学指标影响的研究[J].癌症进展,2018,16(9):1170-1173.
[12]郁昊,代恩荣,王荣锋.多西他赛,奥沙利铂及替吉奥新辅助化疗方案对晚期胃癌患者肿瘤标志物、血管新生及细胞侵袭分子的影响[J].海南医学院学报,2018,24(1):86-89.
[13]Fu S,Liu L,Zhang X,et al.Platelet indices in laryn⁃geal cancer[J].Cancer Biomark,2018,21(3):675-680.
[14]Ohmori T,Yang JL,Price JO,et al.Blockade of tumor cell transforming growth factor-betas enhances cell cycle progression and sensitizes human breast carci⁃noma cells to cytotoxic chemotherapy[J].Exp Cell Res,1998,245(2):350-359.
[15]刘波,张登云,郑自文,等.新辅助化疗联合D2根治术治疗胃癌预后模型的构建[J].青岛大学学报:医学版,2022,58(2):165-172.
[16]Chen H,Lan X,Liu M,et al.Direct TGF-β1 signaling between activated platelets and pancreatic cancer cells primes cisplatin insensitivity[J].Cell Biol Int,2013,37(5):478-484.
[17]Li Y,Zhang J,Wang B,et al.Development and valida⁃tion of a nomogram to predict the probability of breast cancer pathologic complete response after neoadjuvant chemotherapy:A retrospective cohort study[J].Front Surg,2022,9:878255.
[18]陈佳,丁茜琳,王铮,等.基于常规CT图像的纹理分析在进展期胃癌新辅助化疗疗效预测中的价值[J].临床放射学杂志,2019,38(11):2100-2105.
[19]Antonioli L,Blandizzi C,Pacher P,et al.Immunity,in⁃flammation and cancer:A leading role for adenosine[J].Nat Rev Cancer,2013,13(12):842-857.
[20]Bagheri S,Saboury AA,HaertléT.Adenosine deami⁃nase inhibition[J].Int J Biol Macromol,2019,141:1246-1257.
[21]Zhulai G,Oleinik E,Shibaev M,et al.Adenosine-metabolizing enzymes,adenosine kinase and adenosine deaminase,in Cancer[J].Biomolecules,2022,12(3):418.
[22]范珊琳,汪品秀,孔飞,等.胃癌新辅助化疗后肿瘤退缩分级预测因素的研究进展[J].国际肿瘤学杂志,2023,50(2):112-116.
[23]Li YL,Weng LM,Wu SS,et al.Change on biochemical indicators of renal function in drug-induced liver injury and its clinical significance[J].Zhonghua Gan Zang Bing Za Zhi,2019,27(2):143-145.
[24]徐兴,郑志超,张涛,等.进展期胃癌新辅助化疗肿瘤退缩分级的临床病理相关性研究[J].实用肿瘤杂志,2019,34(4):316-320.
[25]刘怡,张珂诚,郗洪庆,等.胃癌新辅助化疗疗效及影响因素分析[J].解放军医学院学报,2018,39(2): 117-121.










