HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值分析论文
2024-11-13 10:48:53 来源: 作者:dingchenxi
摘要:目的探讨HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值。结论HPV-DNA与E6/E7mRNA在正常宫颈组织及炎性宫颈组织中的表达较低,而在CIN组织中的表达显著上升。HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值明确。
摘要:目的探讨HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值。方法选取本院2021年1月—2022年1月收治的可疑宫颈病变早筛患者1200例作为研究对象。分别使用宫颈液基细胞学(TCT)检查、人乳头瘤病毒(HPV)E6/E7mRNA检测、第二代杂交捕获实验(HC-2)HPV-DNA检测以及阴道镜下病理活检手段对宫颈癌进行筛查与诊断。分析HPV E6/E7mRNA检测以及HPV-DNA检测在宫颈早期癌变中的诊断价值。结果总体HPV E6E7mRNA阳性率42.33%,HPV E6/E7mRNA定量分析(经对数转换)平均(2.25±0.39)。总体HPV-DNA阳性率57.42%,HPV-DNA定量分析平均(489.53±102.43)。不同病理结果患者的HPV E6/E7mRNA以及DNA定性和定量分析结果,差异均有统计学意义(P<0.05)。ROC结果显示两者联合检测的曲线下面积0.801,约登指数0.618,高于单独检测。结论HPV-DNA与E6/E7mRNA在正常宫颈组织及炎性宫颈组织中的表达较低,而在CIN组织中的表达显著上升。HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值明确。
关键词:人乳头瘤病毒;宫颈癌;宫颈液基细胞学;病理活检
0引言
人乳头瘤病毒(HPV)是一种无包膜球形双链DNA病毒,属于乳多孔病毒科,其中以宫颈HPV-DNA为代表的病毒在宿主细胞内复制,HPV通过多种途径进入宫颈[1]。大量E6/E7mRNA被翻译成相关癌蛋白,这些蛋白产物能够通过泛素化和磷酸化途径使正常表达的抑癌基因失活,最终导致宫颈癌变的发生[2]。HPV-DNA与E6/E7mRNA联合筛查不仅可以减少因细胞学异常导致的HPV阳性分流及术后阴道镜转诊所需费用,还能降低患者的医疗成本。基于此,本研究选取1200例可疑宫颈病变早筛患者作为研究对象,旨在探讨HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值。
1资料与方法
1.1一般资料
选取2021年1月—2022年1月本院收治的可疑宫颈病变早筛患者1200例作为研究对象。纳入标准:①出现阴道流血、接触性出血、白带异常或增多、外阴瘙痒、下腹部疼痛等可疑宫颈病变临床表现;②签署知情同意书;③同意行宫颈液基细胞学(TCT)检查、人乳头瘤病毒(HPV)E6E7mRNA检测、第二代杂交捕获实验(HC-2)HPV-DNA检测以及阴道镜下病理活检。排除标准:①既往有其他宫颈病变病史或子宫切除等相关手术史;②既往有CIN病史;③妊娠或哺乳期妇女,以及行经期妇女;④入组7d内无阴道冲洗、阴道用药或性生活史;⑤合并精神类疾病或其他原因无法完成随访者。本研究经医院伦理委员会审批。
1.2方法
所有研究对象均在非经期时间段进行取样,且确保7d内没有阴道灌洗,服药和性生活史。取样时患者取膀胱截石位,用窥阴器暴露宫颈后,清除附着的分泌物和黏液。用特制的宫颈脱落细胞取样刷轻轻深插宫颈口内,同向转动5周,静置5~10s。将取出的细胞放入取样瓶内,记录号码以及相关资料。用Branch DNA法测定HPV E6/E7mRNA,离心机设定为3000rmin离心5min,弃去上清,蒸馏水洗涤,并再次离心,去上清,依次加入蛋白酶K 3μL以及加裂解液300mL,混匀,恒温箱(65℃)孵育30min,反应结束,用购自郑州科蒂亚生物技术有限公司生产的Kodia宫颈稳态试剂盒测定HPV E6/E7mRNA的表达,并严格参考试剂的使用说明书,将反应板置于冷光仪中,自动计算HPV E6E7mRNA的拷贝数值(Copies),一共重复3次测定,并取结果均值。
用HC-2法检测HPV-DNA,溶解待检样本,并逐步使核酸解链和变性,将HPV-DNA单链释放。将全长病毒RNA探针与之结合,充分形成RNA/DNA复合物,使用美国Digene公司生产的二抗(碱性磷酸酶偶联)结合复合物,加入碱性磷酸酶底物以促进化学发光信号产生,将反应板置于冷光仪中,自动计算HPV-DNA的拷贝数值(Copies),一共重复3次测定,并取结果均值。
此外,所有患者均接受阴道镜病理活检检查,阴道镜影像异常的患者接受宫颈活体组织病理检查,镜下3,6,9,12点的正常转化区接受宫颈活体组织检查。
1.3评价指标
HPV E6/E7mRNA以及DNA表达的定性分析,以平均拷贝数>1.0视为阳性,否则为阴性。HPV E6/E7mRNA以及DNA表达的定量分析,则以平均拷贝数表示。病理组织活检结果分型则根据《妇产科学》[3]中相关标准,分为正常组织、慢性宫颈炎、低级别CIN、高级别CIN以及宫颈浸润癌。
1.4统计学分析
使用SPSS 24.0软件包进行统计学分析。由于HPV E6/E7mRNA表达的定量资料不属于正态分布,进行对数转换后进行比较。HPV-DNA表达的定量资料经Q-Q检验符合正态分布。计数资料和计量资料分别使用百分比、平均数±标准差表示,进行卡方检验与t检验(多组间使用单因素方差分析)。HPV E6/E7mRNA以及DNA定量表达联合检测对宫颈癌筛查的价值使用受试者工作特征曲线(ROC)分析。以α=0.05为检验标准。
2结果
2.1筛查结果
本研究1200例患者均完成HPV E6/E7mRNA检测以及阴道镜下病理活检。其中,HPV E6/E7mRNA和DNA检测样本来源于TCT剩余标本的宫颈上皮脱落细胞。病理活检结果显示,178例样本来源于正常宫颈组织,682例为炎性组织,332例确诊为CINⅠ级,另有8例确诊为CINⅡ~Ⅲ级,无宫颈浸润癌样本。总体HPV E6/E7mRNA阳性样本508例,阳性率42.33%,HPV E6/E7mRNA定量分析(经对数转换)范围1.56~3.78,平均(2.25±0.39)。总体HPV-DNA阳性样本689例,阳性率57.42%,HPV-DNA定量分析范围56~690,平均(489.53±102.43)。
2.2不同病理结果患者HPV E6/E7mRNA及HPV-DNA水平比较
不同病理结果患者的HPV E6/E7mRNA以及HPV-DNA定性和定量分析结果,差异均有统计学意义(P<0.05),详见表1。
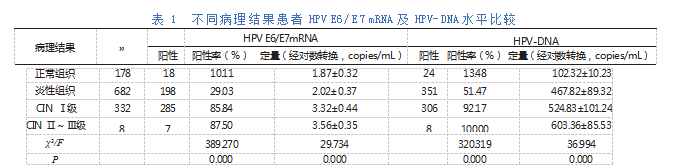
2.3 HPV E6/E7mRNA及HPV-DNA定量水平筛查宫颈癌价值
对观察组和对照组患者入组时的HPV E 6/E7mRNA和HPV-DNA定量水平进行ROC分析,结果显示HPV E6/E7mRNA单独定量诊断阈值为3.35,曲线下面积0.783,约登指数0.569;HPV-DNA单独定量诊断阈值为485.5,曲线下面积0.608,约登指数0.481;两者联合检测的曲线下面积0.801,约登指数0.618。详见表2,图1、2、3。
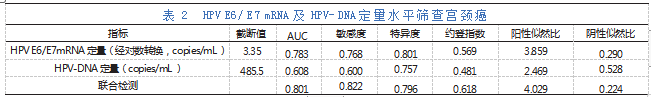
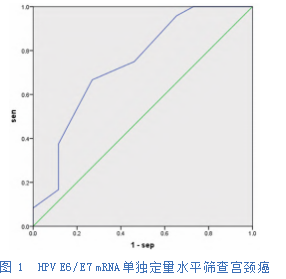
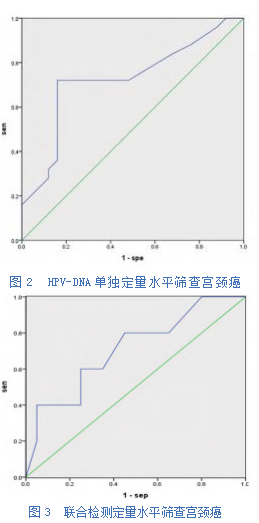
3讨论
大量研究发现,宫颈癌是目前世界上唯一能够通过筛查与预防降低发病率的恶性肿瘤[4]。对其采取积极有效的防治措施具有非常重大的现实意义。HPV是一种无包膜球形双链DNA病毒(HPV),属于乳多孔病毒科HPV,现已发现100多个亚型,致癌亚型多达30多个[5]。HPV主要存在于宫颈细胞内,分为游离型和整合型2种类型,其中以宫颈HPV-DNA为代表的病毒在宿主细胞内复制,HPV通过多种途径进入宫颈。就宫颈癌筛查手段而言,HPV-DNA结合细胞学检测筛查是目前临床上普遍采用的第一线筛查手段,能够提高宫颈病变检出率及筛查灵敏度并降低假阴性。当前在宫颈癌筛查手段中,HPV-DNA结合细胞学检测筛查是临床上普遍采用的一线筛查手段,能够提高宫颈病变检出率及筛查灵敏度,降低假阴性。但也有学者提出,HPV-DNA仅为病因检测而不能反映HPV病毒在已经感染细胞中整合情况,活性及其他情况,也不能判断病毒活动度及评估宫颈病变发展风险[6]。同时,HPV-DNA检测时间长,假阳性率高,且需要多次阴道镜转诊来确定是否存在过度治疗;因此,迫切需要一种新的筛查手段来解决上述问题。随着分子生物学技术的快速发展,HPV分子分型逐渐成为热点研究方向之一。近年来出现了一些针对不同类型细胞的分型技术。液基细胞学是研究宫颈细胞生长情况最直接有效的方法之一,但由于该技术操作复杂,费用昂贵等因素限制了它在临床中的应用,因此现阶段仍不能准确地反映出宫颈及病变的真实情况;但HPV E6/E7mRNA的检测特异性较好,阳性预测值较高,可以说明病毒癌基因已转录表达,可用来了解机体宫颈细胞或者组织发展的趋势,对于临床及时诊治宫颈病变,阻断其恶性发展具有重要的指导作用[7]。联合筛查不仅可以减少因细胞学异常导致的HPV阳性分流及术后阴道镜转诊所需费用,还能降低患者的医疗成本,避免过度治疗,促进精准医疗的实施。三种筛查方法在宫颈癌筛查中各有优缺点,应根据不同人群选择合适的方法进行检查,避免对宫颈造成损伤或损伤后再手术等情况发生,从而为患者提供准确可靠的信息,使患者了解自己的过去、现在以及将来。
属于小双链HPV基因组的HPV E6/E7mRNA近年被发现病毒载量改变与宫颈癌的发病和病理过程密切相关。有学者研究认为HPV基因和宫颈细胞基因整合在CIN转化为宫颈癌过程中起着重要作用,当宿主被HPV病毒感染时,HPV病毒会过多表达E6/E7而造成免疫逃逸从而使正常细胞转变为癌细胞[8]。在临床上,HPV可通过胎盘屏障进入胎儿体内;也可能经呼吸道或消化道入侵母体生殖道。因此,检测人乳头瘤病毒感染对宫颈癌预防具有重大意义[9]。但该领域仍有许多问题亟待解决。动物实验表明,HPV E6/E7蛋白可作为抑癌基因,通过抑制端粒酶的活性、影响细胞周期调控以及促进宫颈组织细胞增殖来达到治疗宫颈癌的目的;且及早发现宫颈癌前病变,可为预防和治疗宫颈癌打下基础[10]。而在本研究中,不同病理结果患者的HPV E6/E7mRNA以及HPV-DNA定性和定量分析结果,差异均有统计学意义,提示HPV E6/E7mRNA以及HPV-DNA定性和定量分析对宫颈癌的筛查具有积极意义,后续ROC分析也显示两项指标联合检测对宫颈癌的筛查效能要高于单独检测。
综上所述,HPV-DNA与E6/E7mRNA在正常宫颈组织及炎性宫颈组织中的表达较低,而在CIN组织中的表达显著上升。HPV-DNA与E6/E7mRNA联合检测对宫颈癌筛查的价值明确,且高于两项指标单独检测。
参考文献
[1]陈丹,张晓兰,周淑君.宫颈癌患者HPV-E6/E7mRNA H PV-D NA检测及临床意义[J].中国妇幼保健,2021,36(20):43-47.
[2]黄珊珊,徐凤娟,成雁,等.高危型HPV E6/E7 mRNA与HC2 HPV-DNA联合检测在宫颈病变筛查中价值[J].中华实用诊断与治疗杂志,2020,34(6):24-28.
[3]吴永茂,吴季兰,练惠织,等.HPV癌基因E6/E7 mRNA在宫颈癌及癌前病变诊断中的临床价值[J].中国妇幼保健,2020,35(2):36-39.
[4]吴赛青,程平,胡丽娟,等.HPV E6/E7 mRNA与DNA检测法在子宫颈癌前病变筛查中的对比分析[J].临床与实验病理学杂志,2022,38(8):44-48.
[5]张茗,金东玲,李广慧,等.人乳头瘤病毒E6/E7 mRNA检测在小于30岁宫颈癌筛查中的临床分析[J].中国医师进修杂志,2022,45(11):1046-1049.
[6]彭惠媛.年轻女性使用HPV E6/E7mRNA联合薄层液基细胞学检测技术筛查宫颈病变临床分析[J].中国妇幼保健,2021,36(13):322-327.
[7]吴赛青,程平,胡丽娟,等.HPV E6/E7 mRNA与DNA检测法在子宫颈癌前病变筛查中的对比分析[J].临床与实验病理学杂志,2022,18(8):38-44.
[8]雷冬梅,林艳丽,郭瑞霞,等.TCT,HPVE6/E7mRNA与hTERC基因联合检测在宫颈癌筛查中的应用价值研究[J].现代妇产科进展,2020,2(5):349-352.
[9]陈思佳,穆宇松,张林月,等.应用CRISPR/Cas9靶向细胞内整合的HPV E6,E7基因治疗宫颈癌[J].国际遗传学杂志,2020,43(2):72-77.
[10]刘晓旭,梁建梅,苏学艳,等.HPV DNA和HPV E6/E7 mRNA检测在宫颈病变诊治中应用价值的比较[J].国际妇产科学杂志,2021,48(4):462-466.










