培美曲塞联合调强放疗技术在Ⅲ期非小细胞肺癌治疗中的应用效果论文
2024-10-16 11:35:34 来源: 作者:dingchenxi
摘要:目的:探讨培美曲塞联合调强放疗技术(IMRt)在Ⅲ期非小细胞肺癌(NSCLC)治疗中的应用效果。方法:选取2021年1月—2022年8月钟祥市人民医院肿瘤内科收治的68例Ⅲ期非小细胞肺癌患者,按照随机数表法分为两组,各34例。
【摘要】目的:探讨培美曲塞联合调强放疗技术(IMRt)在Ⅲ期非小细胞肺癌(NSCLC)治疗中的应用效果。方法:选取2021年1月—2022年8月钟祥市人民医院肿瘤内科收治的68例Ⅲ期非小细胞肺癌患者,按照随机数表法分为两组,各34例。培美曲塞组给予培美曲塞联合IMRt治疗,多西他赛组给予多西他赛联合IMRt治疗。比较两组患者临床疗效、生存率及不良反应。结果:治疗4个周期后,培美曲塞组客观缓解率、临床控制率与多西他赛组比较,差异均无统计学意义(P>0.05);培美曲塞组白细胞减少、恶心/呕吐、脱发发生率均明显低于多西他赛组,差异有统计学意义(P<0.05);两组疾病进展时间及1年生存率比较,差异无统计学意义(P>0.05)。结论:培美曲塞联合IMRt与多西他赛联合IMRt治疗Ⅲ期NSCLC的效果相当,但培美曲塞的不良反应发生率低。
【关键词】非小细胞肺癌;三维适形放射治疗;培美曲塞;多西他赛;应用效果
肺癌是临床上非常常见的恶性肿瘤,其中非小细胞肺癌(NSCLC)是癌症最常见的类型,约占肺癌的80%[1]。在临床实践中,NSCLC的发病是隐匿性的,大多数患者没有明显的临床表现。当被诊断时,他们往往处于中晚期,错过了最佳的手术治疗机会。近年来,随着医学技术不断发展,放射疗法已经成为中晚期NSCLC重要治疗手段,其中调强放疗技术(IMRt)是一种高精度的放射治疗技术,通过优化放射束的形状、强度和方向,使其能够更准确地适应肿瘤的形状和体积,以减少对周围正常组织的损害[2-3]。不过相关研究指出,由于中晚期NSCLC的癌细胞繁殖较迅速,部分患者对于放疗不敏感,临床疗效相对较差[4]。临床相关研究显示,培美曲塞作为二线化疗用药在NSCLC治疗中取得了满意疗效[5]。基于此,本研究分析培美曲塞联合IMRt在Ⅲ期NSCLC治疗中的应用效果,现报告如下。
1资料与方法
1.1一般资料
选取2021年1月—2022年8月钟祥市人民医院肿瘤内科收治的68例Ⅲ期非小细胞肺癌患者作为研究对象,纳入标准:(1)患者伴有低热、胸部胀痛及咳血等表现,均经病理学、CT或者胸部X线检查确诊;(2)TNM分期为Ⅲ期;(3)存活期预计至少6个月以上;(4)一般状况评分(KPS)[6]≥70分;(5)化疗前1个月未接受过化疗或者放疗;(6)至少接受4个周期治疗。排除标准:(1)既往接受过本治疗方案;(2)对研究所用药物有禁忌证;(3)严重心肝肾功能障碍。按照随机数表法分为两组,各34例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性,见表1。本研究经医院医学伦理委员会批准(编号:S2020-021-020);患者及家属均签署知情同意书。

1.2方法
入院后均详细记录相关资料,化疗之前做好生化检查和相关影像学检查,并根据患者全身状况给予提升白细胞、营养干预及止吐等处理。
培美曲塞组予以培美曲塞联合IMRt治疗。(1)治疗第1天时,给予注射培美曲塞二钠(江苏奥赛康药业有限公司;国药准字H20080624;规格:0.5 g)500 mg/m2静脉滴注,化疗21 d为1个疗程,持续治疗4~6个疗程。(2)IMRt:医生对患者进行详细的病例评估,包括肿瘤类型、大小、位置等信息,根据评估结果,使用影像学技术(如CT、MRI等)及辅助软件进行肿瘤定位和区域分割。利用计算机辅助规划系统,制定IMRt的治疗计划,计划考虑到肿瘤和周围器官的位置、形状及剂量要求,通过分解放射束成多个激光束,并为每个激光束设定相应的剂量。患者需要躺在治疗床上,将特殊固定装置用于确保患者的准确定位,治疗机器会根据计划投射多个激光束,每个激光束的强度和形状按照计划进行调整,以实现高度个体化的放射剂量输送。治疗完成后,医生会对患者进行进一步评估,包括仔细检查肿瘤的缩小情况及周围组织的剂量分布。
多西他赛组给予多西他赛联合IMRt治疗。第1天,多西他赛注射液(深圳万乐药业有限公司;国药准字H20110136;规格:0.5 mL∶20 mg)75 mg/m2静脉滴注,化疗21 d为1个疗程,持续治疗4~6个疗程;IMRt治疗同培美曲塞组。
1.3观察指标及评价标准
(1)采用放射肿瘤协作组中的标准对患者放射治疗不良反应(包括恶心、呕吐、皮肤损伤、全身乏力等)程度进行判断[7-8]。(2)通过WHO实体瘤效果评定标准对患者疗效进行评价。进展(PD)为患者出现新病灶或者肿瘤体积增大≥25%;稳定(SD)为患者肿瘤体积增大<25%或者减小<50%;显著缓解(PR)为患者肿瘤体积减小≥50%,时间在4周以上,且无新病灶出现;完全缓解(CR)为无新病灶出现,肿瘤完全消退;客观缓解率=CR率+PR率,疾病控制率=CR率+PR率+SD率[9]。(3)统计两组患者的生存率,并记录疾病进展时间。
1.4统计学处理
本研究数据采用SPSS 22.0统计学软件进行分析和处理,计量资料以(x-±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1两组临床疗效比较
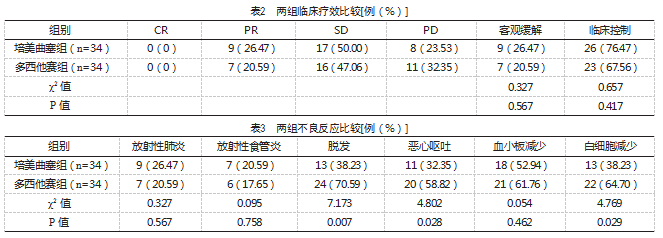
两组患者均完成化疗及放疗。培美曲塞组患者中化疗周期为4~6个周期,中位化疗周期为5个周期;多西他赛组患者化疗周期为4~6个周期,中位化疗周期为5个周期。治疗4个周期后,培美曲塞组客观缓解率、临床控制率与多西他赛组比较,差异无统计学意义(P>0.05),见表2。
2.2两组不良反应比较
两组均无一例因为治疗期间不良反应而停止治疗,治疗期间无死亡发生。培美曲塞组脱发、白细胞减少及恶心呕吐发生率均明显低于多西他赛组,差异有统计学意义(P<0.05);两组血小板减少、放射性肺炎及放射性食管炎发生率比较,差异无统计学意义(P>0.05),见表3。
2.3两组生存情况比较
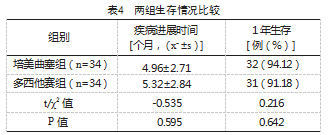
随访至2023年8月,两组患者均无一例失访发生,随访时间为6~30个月,中位随访时间为27.3个月。两组疾病进展时间及1年生存率比较,差异无统计学意义(P>0.05),见表4。
3讨论
局部晚期NSCLC是指已经出现了锁骨上或者纵隔淋巴结转移等远处转移[10]。目前,在局部晚期NSCLC患者中,仅有部分ⅢA期患者有手术治疗的机会,可给予根治手术联合放化疗的方案进行治疗,而对于已经失去手术治疗的患者,多给予放化疗联合的方案进行治疗[11]。
放射治疗虽然有一定疗效,但是部分患者由于肿瘤体积较大或者对放射治疗敏感度较低等原因,导致疗效较差[12]。有研究指出,与单独放疗相较,化疗联合放疗的临床疗效明显提高,提高了局部病灶控制效果,以及减少了远处转移[13]。其作用机制可能为通过放射治疗能够使肿瘤体积缩小,造成肿瘤局部血液的供应情况出现明显改善,这可能会有助于肿瘤细胞增殖,而同步放化疗,通过化疗药物对肿瘤细胞的杀灭作用,可减少肿瘤细胞增殖。因此,放化疗联合治疗成为晚期NSCLC重要的治疗手段。多西他赛是一种紫杉醇药物,属于细胞周期特异性类别。当作用于微管时,它可以提高微管的稳定性并引起异常排列,影响细胞分裂,诱导细胞逐渐凋亡,延长细胞周期的G2/M期。此时,对放疗的敏感性相对较高,可以显著提高放疗的有效性。培美曲塞属于一种抗叶酸制剂,可破坏癌症细胞中正常的叶酸依赖性代谢过程,从而抑制癌症细胞复制、肿瘤生长和增殖,最终发挥抗肿瘤作用。培美曲塞、多西他赛均为二线治疗晚期NSCLC的常用抗癌药物,部分研究中亦作为一线治疗用药,二者疗效相近,且患者均可耐受治疗[14-16]。
本研究中,经过4个周期治疗后,两组客观缓解率及疾病控制率比较差异不显著;随访发现,两组患者疾病进展时间及1年生存率比较差异不显著,提示培美曲塞化疗同步IMRt与多西他赛同步IMRt治疗Ⅲ期NSCLC的效果相当,均较满意。不过,对于局部晚期NSCLC患者而言,治疗难度较大,本组资料中,两组患者均无一例完全缓解出现,仍然需要进一步探讨更加有效的治疗方案,以进一步改善无法行手术治疗的局部晚期NSCLC患者的预后。对于无法行手术治疗的局部晚期NSCLC患者,其治疗的主要目的就是控制病情进展,并减少放化疗所引起的不良反应,这也是临床工作者考虑的一个重要问题。本研究中,两组患者不良反应主要以血小板减少、脱发、白细胞减少多见。两组均无一例因为放化疗不良反应而停止治疗,治疗期间无死亡发生,不良反应均可耐受,其中培美曲塞组白细胞减少、恶心/呕吐、脱发发生率均明显低于多西他赛组,提示培美曲塞的毒副作用更低。但本研究样本量偏少,可扩大样本量,并延长观察时间,分析对患者远期预后的影响,进一步研究证实。
综上所述,培美曲塞化疗同步IMRt与多西他赛治疗Ⅲ期NSCLC的效果相当,但培美曲塞的不良反应发生率低。
参考文献
[1]白晓燕.同期放化疗与三维适形放疗治疗非小细胞肺癌的效果及不良反应[J].中国实用医刊,2019,2(12):33-36.
[2]崔磊,徐晓南,曾星,等.同步加量调强放疗技术在直肠癌术前同期放化疗的应用效果[J].中国医药科学,2021,11(10):187-190.
[3]牛锐,胡永强.食管癌放疗应用容积旋转调强放疗技术的可行性研究[J].中国医学工程,2019,27(6):28-30.
[4]任杰,杨威,宋君.原发性肺肉瘤样癌MSCT特征及与非小细胞癌鉴别诊断分析[J].中国CT和MRI杂志,2022,20(8):77-79.
[5]刘旭,陈菁,方青山,等.KLK5和KLK13在非小细胞癌中的表达及临床意义[J].热带医学杂志,2022,22(2):194-197.
[6]杨飞虎,张军豪,刘爱玲.CT与超声引导下经皮肺穿刺活检术诊断非小细胞癌与病理结果对比[J].中国临床医学影像杂志,2021,32(10):726-728.
[7]林秀琴,徐健,许树红,等.ADH、ALDH基因多态性与饮酒的交互作用对肺癌的影响研究[J].预防医学,2021,33(10):1022-1025.
[8]韩蕃颉,王海滨,苏新云,等.3项血清肿瘤标志物、SAA及DCLK1联合检测在非小细胞癌患者预后判断中的价值[J].国际检验医学杂志,2021,42(17):2154-2157.
[9]王雅楠,武云.立体定向放疗在早期非小细胞癌治疗中的应用效果[J].现代医学与健康研究,2021,5(11):71-73.
[10]周路,余征,刘星.调强放疗治疗局部晚期NSCLC的预后影响因素分析[J].中国实用医药,2020,15(19):52-54.
[11]刘伯轩,陈成,刘月光,等.免疫细胞化学对胸腔积液中的肺非小细胞癌分类与恶性间皮瘤的鉴别诊断分析[J].临床研究,2020,28(7):25-27.
[12]张丽,刘汝泉,王贺,等.安罗替尼联合伽玛刀治疗局部晚期非小细胞癌疗效[J].医药论坛杂志,2020,41(6):48-52.
[13]FEYERABEND S,SAAD F,LI T,et al.Survival benefit,disease progression and quality-of-life outcomes of Abiraterone acetate plus Prednisone versus Docetaxel in metastatic hormone-sensitive prostate cancer:a network meta-analysis[J].Eur J Cancer,2018,103(2):78-87.
[14]SONG P,HUANG C,WANG Y.The efficacy and safety comparison of Docetaxel,Cabazitaxel,Estramustine,and Mitoxantrone for castration-resistant prostate cancer:a network meta-analysis[J].IntJ Surg,2018,56(2):133-140.
[15]TASSINARI D,CHERUBINI C,ROUDNAS B,et al.Treatment of Metastatic,castration-resistant,Docetaxel-resistant prostate cancer:a systematic review of literature with a network Meta-analysis of randomized clinical trials[J].Rev Recent Clin Trials,2018,13(3):226-237.
[16]KASSRM L,SHOHDY K S,ABDEL O.Abiraterone acetate/androgen deprivation therapy combination versus Docetaxel/androgen deprivation therapy combination in advanced hormone-sensitive prostate cancer:a network meta-analysis on safety and efficacy[J].Curr Med Res Opin,2018,34(5):903-910.
[17]GRAVIS G,BOHER J M,CHEN Y H,et al.Burden of metastatic castrate naive prostate cancer patients,to identify men more likely to benefit from early Docetaxel:further analyses of CHAARTED and GETUG-AFU15 studies[J].Eur Urol,2018,73(6):847-855.










