难治性类风湿关节炎的研究进展论文
2024-09-26 11:32:23 来源: 作者:liziwei
摘要:难治性类风湿关节炎(D2T RA)是一种复杂的类风湿关节炎(RA)亚型,其特征是对传统疾病修改抗风湿药(DMARDs)治疗有限或无效。本文对D2T RA的综述旨在探讨其临床特点及治疗策略,常用的药物治疗包括DMARDs、生物制剂和靶向治疗药物。
【摘要】难治性类风湿关节炎(D2T RA)是一种复杂的类风湿关节炎(RA)亚型,其特征是对传统疾病修改抗风湿药(DMARDs)治疗有限或无效。本文对D2T RA的综述旨在探讨其临床特点及治疗策略,常用的药物治疗包括DMARDs、生物制剂和靶向治疗药物。
【关键词】类风湿关节炎抗风湿药靶点生物
类风湿关节炎(RA)是一种慢性炎症性关节疾病,其特征是进行性的关节破坏和身体功能受损。近年来,RA的治疗取得了显著进展。
首先,2010年对RA分类标准进行的修订使早期诊断成为可能。这对于及早开始治疗以减少关节损害具有重要意义。早期干预可以延缓疾病的进展,并改善患者的预后。其次,“治疗到靶点策略”已经被广泛接受并应用于RA的治疗中。第三,生物疾病修饰传统疾病修改抗风湿药(bDMARDs)和靶向合成DMARDs(tsDMARDs)已经可用于对甲氨蝶呤(MTX)反应不足的患者。这些药物具有针对炎症过程的不同的作用机制,可以有效控制疾病活动,并减少关节损害。最后,欧洲抗风湿病联盟(EULAR)定期发布关于RA管理的循证治疗建议,为临床医生提供指导。这些指南为治疗决策提供依据。
然而,一些患者表现出对多种药物的耐药性。即使使用了两种或更多具有不同作用机制的药物也无法控制疾病活动。这种情况被称为“难以治疗的RA”,即难治性类风湿关节炎(D2T RA)。D2T RA是一个异质性和多因素的状态,其主要问题是疾病活动度无法得到控制,导致生活质量下降,并给患者带来经济负担。关于D2T RA的研究和出版物还相对较少,因为该概念相对较新。我们对D2T RA的机制及在这些患者中形成“难以治疗”状态的因素尚不完全清楚。进一步的研究将有助于揭示这些问题,并为改善难治性RA的治疗提供新的思路。
1 D2T RA影响因素
持续性炎症性D2T RA是指具有持续炎症活动的情况,而非炎症性D2T RA则几乎没有明显的炎症迹象。D2T RA的形成涉及多种因素,包括滑膜炎、吸烟、药物不良反应、bDMARDs的免疫原性、复发性药物不良反应、合并症、阴性疾病结局(如继发性纤维肌痛)、药物不依从和药物使用不当等。
根据国际调查的结果,风湿病专家认为心血管疾病、关节外表现和感染是D2T RA发展的三大决定因素。其他可能导致D2T RA的因素包括恶性肿瘤、糖尿病、骨质疏松症、疼痛综合征、肺和肾疾病、抑郁症、肥胖症、胃肠道疾病和骨关节炎等。
然而,目前尚不清楚这些因素中的关键因素是什么。根据基线时疾病的高活动度、类风湿因子和抗环瓜氨酸肽抗体(ACPAs)的血清阳性及肺部受累等因素,可能是D2T RA的主要原因之一。此外,衰老相关因素(如细胞/免疫衰老、恶性肿瘤史)、器官损害(如心血管疾病、慢性肾病、肝病)、环境因素(如吸烟、传染病等)及其他因素(如肥胖、不依从和血栓形成史)也可能参与D2T RA的形成。然而,需要注意的是,这些因素可能因患者、性别、国家和种族而异。
总之,D2T RA是一种异质性和多因素的疾病状态,涉及多个免疫机制和相关因素。通过进一步的研究,我们可以更好地理解D2T RA的形成机制,并为预防和治疗提供更有效的策略。
2 RA对DMARDs的反应
2.1常规合成DMARDs
RA的一线锚定药物是MTX,属于常规合成DMARDs(csDMARDs)类。虽然其抗炎特性尚不完全清楚,但人们普遍认为它会干扰二氢叶酸还原酶活性并产生腺苷。此外,MTX可以减少嘌呤和嘧啶的合成,抑制转甲基化反应,参与一氧化氮合酶的解偶联,并抑制核因子κB(NF-κB)和Janus激酶(JAK)信号转导器和转录激活剂(STAT)信号通路的活性。然而,对MTX的不适当治疗反应通常表明已经迈出了将已建立的RA发展为D2T RA的第一步。约25%的患者在一年内停止服用MTX。症状开始时年龄较小、基线疾病活动度较高及类风湿因子阳性是MTX无效导致治疗反应不当的危险因素。另一项临床研究表明,女性,体重指数(BMI)>25 kg/m2、吸烟、血清类风湿因子阳性和合并糖尿病是MTX治疗反应不当的危险因素。由于药物不良反应(如肝损伤、口腔炎、脱发和骨髓抑制)导致MTX的使用受到限制,这也对RA的治疗构成了重大障碍。日本的一项分析发现,慢性肾脏病RA患者服用MTX可能导致严重的血液学毒性。此外,生物利用度影响RA患者对MTX的反应,肠胃外给药可能比口服给药更有效。
总体而言,csDMARDs治疗RA的效果可能受到多种因素的影响。其中,当从RA早期诊断到治疗(D2T)或已确诊的RA患者具有射频阳性、较年轻的发病年龄和较高的基线疾病活动度等特征时,可能会出现不适当的治疗反应。由于csDMARDs表现出多靶点作用模式,我们需要探索D2T RA的致病机制,并解释不适当的治疗反应。这对于改善治疗效果至关重要。
2.2 bDMARDs
bDMARDs在临床实践中被广泛应用,并为治疗RA的患者提供了巨大的动力。当csDMARDs治疗失败后,临床医生通常转向bDMARDs作为下一线治疗选择,其中包括肿瘤坏死因子抑制剂(TNFi)和抗白细胞介素-6(抗IL-6)抗体。
然而,20%~30%的患者对bDMARDs治疗无效,仍无法获得理想的治疗反应。例如,在接受阿达木单抗治疗的患者中,有24.8%的人检测到抗药物抗体(ADA)。阿达木单抗水平可能因为BMI≥30 kg/m2而降低,而ADA水平和较低的阿达木单抗水平是治疗12个月无效的重要指标[12]。此外,在对TNFi反应不佳的患者中,辅助性T细胞17(Th17)细胞数量显著增加。因此,针对白细胞介素-17(IL-17)通路的药物如比美吉珠单抗(Bimekizumab)可能对TNFi无反应患者有效。
另外,单独使用TNFi治疗会增加治疗反应不理想的风险,因此联合使用bDMARDs和csDMARDs可能是必要的[14]。然而,药物组合疗法的有效性和安全性仍需要更多数据来评估。
除了TNFi之外,抗IL-6受体抗体也是治疗选择之一。IL-6通过与IL-6受体结合并激活相关信号通路,在RA患者中起到重要的作用。托珠单抗是一种抗IL-6受体抗体,已经在DMARDs反应不足的患者中显示出改善50%(ACR50)、70%(ACR70)和24%(ACR30)的治疗反应。然而,目前尚无可靠的生物标志物来预测临床反应,因此仍需要进一步研究。
利妥昔单抗是针对CD20分子的治疗药物,已被批准用于治疗成人RA。它被认为是ACPAs阳性患者的最佳选择,因为长期的B细胞耗竭会影响ACPAs等自身抗体的产生。然而,B细胞耗竭也会导致免疫抑制作用,增加感染和癌症风险[17]。因此,在应用利妥昔单抗前,需要对患者进行筛查并接种疫苗。
阿巴西普是一种T细胞共刺激拮抗剂,通过调节CD80/CD86-CD28共刺激信号来减少炎症和免疫反应,同时也能调节记忆B细胞。该药物在bDMARDs初次治疗的患者中显示出与CD38和/或CD27记忆B细胞计数相关的治疗反应。然而,在先前接受过bDMARDs治疗的患者中,阿巴西普可能不是最佳选择,与阿巴西普相比,利妥昔单抗、托珠单抗或乌帕替尼治疗可能具有更好的疗效。
总之,TNFi治疗不理想的反应主要受到靶向途径和ADA产生的影响。对于确认RA诊断的患者,疾病活动性、炎症标志物和RF水平可能会影响对抗IL-6受体抗体的治疗反应。阿巴西普治疗反应与记忆B细胞计数的基线水平显著相关。对于ACPAs阳性患者,B细胞耗竭剂可能是最佳选择。与csDMARDs相比,bDMARDs提供了更具针对性和精确的治疗机制。
2.3 tsDMARDs
JAK抑制剂(JAKi)如托伐菌素和巴瑞替尼,通过干扰破骨细胞的分化和增殖,针对JAK1/2并抑制NF-κB配体的受体激活来起到保护骨骼的作用。已有研究表明,托伐菌素可以抑制JAK3/1/2和酪氨酸激酶2的磷酸化,阻止STAT的聚集、二聚化和核转位。在既往未使用过MTX、糖皮质激素或生物类疗法(bDMARDs)的早期D2T RA患者中,JAKi显示出显著的缓解效果。在经过托伐菌素治疗44~45个月后,对于对MTX不适宜的患者,也观察到了类似的优势。事实上,以靶向小分子疗法(tsDMARDs)作为一种新的治疗策略已经取得了显著的效果,但其安全性仍然存在争议。
简而言之,JAKi的治疗反应会受到患者用药史的影响,特别是既往是否使用过MTX或糖皮质激素。对于已经尝试过两个或多个生物或靶向小分子RA药物无效的D2T RA患者来说,JAKi仍然是一种可行的选择。
3 D2T RA的管理和治疗策略
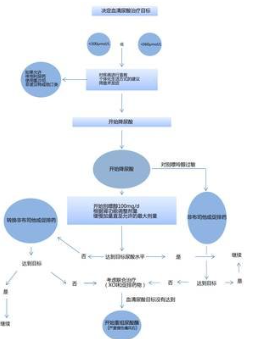
EULAR工作组提出了D2T RA患者就诊时应考虑以下几点:第一步要考虑误诊的可能性及是否存在与关节炎体征和/或症状相似的并发症。超声检查也应该被用于重新评估。其次,应讨论治疗依从性的问题。如果当前使用的药物无效,可以考虑增加剂量或切换到具有不同机制的b/tsDMARDs。另外,还应考虑非药物干预,如运动、教育、支持和自我管理计划。
简而言之,D2T RA患者就诊时应密切关注误诊的可能性和共存疾病的存在,使用超声检查重新评估,并讨论治疗依从性。如果当前药物无效,可以尝试增加剂量或切换到具有不同机制的治疗药物。此外,还可以考虑非药物干预手段帮助患者减轻症状和提高生活质量。
虽然目前没有足够的证据来确定在转换药物时最好选择哪种b/tsDMARDs,但一项回顾性分析的研究显示,在TNFi抑制剂、IL-6抑制剂、T细胞共刺激信号抑制剂和JAK抑制剂中,JAK抑制剂显示出最有利的结果,例如缓解诱导率。与TNFi相比,IL-6抑制剂和T细胞共刺激信号抑制剂在改善疾病活动和身体功能方面具有相似的效果,但JAK抑制剂在这些方面明显优于TNFi。在初步队列研究中发现,接受JAK抑制剂或IL-6抑制剂治疗的患者的药物保留率明显高于接受TNFi或T细胞共刺激信号抑制剂治疗的患者。经过多变量分析,使用Cox比例风险模型发现停药与TNFi、T细胞共刺激信号抑制剂的使用及与糖皮质激素的联合使用有关。Yoshii等的另一项研究也表明,与D2T RA患者的治疗失败有关的是与糖皮质激素的联合使用。还需要进一步的研究来确定药物和非药物干预在治疗D2T RA方面如何结合的其他证据。
4小结与展望
在D2T RA的各种促成因素中,有些是可干预的,如吸烟、肥胖、依从性差和牙周炎,而另一些则难以干预,如不可逆的器官损伤。纠正可干预因素对于抑制D2T RA的发展也很重要。此外,RA患者在诊断后应有机会获得非药物治疗,例如适当的运动、教育和支持。由于缓解期患者的生活质量及功能明显优于疾病活动度低的患者,因此RA的主要目标应该是缓解。因此,我们可能需要考虑针对所有RA患者缓解的治疗,而不仅仅是抑制D2T RA的发作。
总之,D2T RA是一种复杂的疾病,各种因素有助于其发展。为了预防D2T RA的发作,在诊断后早期使用适当的药物治疗患者,同时适当评估合并症和环境因素的状态至关重要。
参考文献
[1]SMOLEN J S,ALETAHA D,BARTON A,et al.Rheumatoid arthritis[J].Nat Rev Dis Primers,2018,4:18001.
[2]NAGY G,ROODENRIJS N M T,WELSING P M J,et al.EULAR definition of difficult-to-treat rheumatoid arthritis[J].Annals of the Rheumatic Diseases,2021,80(1):31-35.
[3]BUCH M H,EYRE S,MCGONAGLE D.Persistent inflammatory and non-inflammatory mechanisms in refractory rheumatoid arthritis[J].Nature Reviews Rheumatology,2021,17(1):17-33.
[4]ROODENRIJS N M T,DE HAIR M J H,VAN DER GOES M C,et al.Characteristics of difficult-to-treat rheumatoid arthritis:results of an international survey[J].Annals of the Rheumatic Diseases,2018,77(12):1705-1709.
[5]DE HAIR M J H,JACOBS J W G,SCHONEVELD J L M,et al.Difficult-to-treat rheumatoid arthritis:an area of unmet clinical need[J].Rheumatology,2018,57(7):1135-1144.
[6]WATANABE R,OKANO T,GON T,et al.Difficult-to-treat rheumatoid arthritis:current concept and unsolved problems[J].Frontiers in Medicine,2022,9:1049875.
[7]CRONSTEIN B N,AUNE T M.Methotrexate and its mechanisms of action in inflammatory arthritis[J].Nature Reviews Rheumatology,2020,16(3):145-154.
[8]BLUETT J,SERGEANT J C,MACGREGOR A J,et al.Risk factors for oral Methotrexate failure in patients with inflammatory polyarthritis:results from a UK prospective cohort study[J].Arthritis Research&Therapy,2018,20(1):1-6.
[9]SIDDIQUI A,TOTONCHIAN A,ALI J B J,et al.Risk factors associated with non-respondence to Methotrexate in rheumatoid arthritis patients[J/OL].Cureus,2021,13(9):e18112.https://pubmed.ncbi.nlm.nih.gov/34692323/.
[10]MITSUBOSHI S.Risk of haematological events and preventive effect of folic acid in Methotrexate users with chronic kidney disease and rheumatoid arthritis:analysis of the Japanese adverse drug event report database[J].British Journal of Clinical Pharmacology,2021,87(5):2286-2289.
[11]SCHAEVERBEKE T,TRUCHETET M E,KOSTINE M,et al.Immunogenicity of biologic agents in rheumatoid arthritis patients:lessons for clinical practice[J].Rheumatology,2016,55(2):210-220.
[12]JANI M,CHINOY H,WARREN R B,et al.Clinical utility of random anti-tumour necrosis factor drug testing and measurement of anti-drug antibodies on long-term treatment response in rheumatoid arthritis[J].The Lancet,2015,385:S48.
[13]WIESE M D,HOPKINS A M,KING C,et al.Precision medicine with leflunomide:consideration of the DHODH haplotype and plasma Teriflunomide concentration and modification of outcomes in patients with rheumatoid arthritis[J].Arthritis Care&Research,2021,73(7):983-989.
[14]TAM H K J,ROBINSON P C,NASH P.Inhibiting IL-17A and IL-17F in rheumatic disease:therapeutics help to elucidate disease mechanisms[J].Current Rheumatology Reports,2022,24(10):310-320.
[15]WANG J,PLATT A,UPMANYU R,et al.IL-6 pathway-driven investigation of response to IL-6 receptor inhibition in rheumatoid arthritis[J/OL].BMJ Open,2013,3(8):e003199.https://pubmed.ncbi.nlm.nih.gov/23959753/.
[16]TENG Y K O,WHEATER G,HOGAN V E,et al.Induction of long-term B-cell depletion in refractory rheumatoid arthritis patients preferentially affects autoreactive more than protective humoral immunity[J].Arthritis Research&Therapy,2012,14:1-11.
[17]WU F,GAO J,KANG J,et al.B Cells in rheumatoid arthritis:pathogenic mechanisms and treatment prospects[J].Frontiers in Immunology,2021,12:750753.
[18]GOTTENBERG J E,MOREL J,PERRODEAU E,et al.Comparative effectiveness of Rituximab,Abatacept,and Tocilizumab in adults with rheumatoid arthritis and inadequate response to TNF inhibitors:prospective cohort study[J].BMJ,2019,364:l67.
[19]TANAKA Y.Recent progress in treatments of rheumatoid arthritis:an overview of developments in biologics and small molecules,and remaining unmet needs[J].Rheumatology,2021,60(Supplement_6):vi12-vi20.
[20]MCLORNAN D P,POPE J E,GOTLIB J,et al.Current and future status of JAK inhibitors[J].The Lancet,2021,398(10302):803-816.
[21]OCHI S,SONOMOTO K,NAKAYAMADA S,et al.Preferable outcome of Janus kinase inhibitors for a group of difficult-to-treat rheumatoid arthritis patients:from the FIRST registry[J].Arthritis Research&Therapy,2022,24(1):1-13.
[22]WANG F,SUN L,WANG S,et al.Efficacy and safety of Tofacitinib,Baricitinib,and Upadacitinib for rheumatoid arthritis:a systematic review and meta-analysis[J].Mayo Clinic Proceedings,2020,95(7):1404-1419.
[23]NAGY G,ROODENRIJS N M T,WELSING P M J,et al.EULAR points to consider for the management of difficult-to-treat rheumatoid arthritis[J].Annals of the Rheumatic Diseases,2022,81(1):20-33.
[24]WATANABE R,OKANO T,YAMADA S,et al.Drug retention of biologics or jak inhibitors in patients with difficult-to-treat rheumatoid arthritis:results from the answer cohort[J].Ann Rheum Dis,2022,81(Suppl.1):527-528.
[25]YOSHII I,SAWADA N,CHIJIWA T.Clinical characteristics and variants that predict prognosis of difficult-to-treat rheumatoid arthritis[J].Rheumatology International,2022,42(11):1947-1954.










