结直肠侧向发育型肿瘤的癌变及筛查研究现状论文
2024-09-04 10:50:27 来源: 作者:zhouxiaoyi
摘要:结直肠侧向发育型肿瘤(colorectal laterally spreading tumor,CLST)是起源于结直肠黏膜,直径≥10 mm的一类平坦隆起型病变,以侧向发育为主要特征,与结直肠其他隆起性腺瘤相比,CLST具有不同的形态学特征、特殊的生长方式及更高的恶性潜能,被认为与结直肠癌的发生发展密切相关。现有共识是,大规模早期筛查、早诊断、早治疗是防控结直肠癌及CLST癌变的关键。
【摘要】结直肠侧向发育型肿瘤(colorectal laterally spreading tumor,CLST)是起源于结直肠黏膜,直径≥10 mm的一类平坦隆起型病变,以侧向发育为主要特征,与结直肠其他隆起性腺瘤相比,CLST具有不同的形态学特征、特殊的生长方式及更高的恶性潜能,被认为与结直肠癌的发生发展密切相关。现有共识是,大规模早期筛查、早诊断、早治疗是防控结直肠癌及CLST癌变的关键。CLST的癌变过程涉及多种分子机制,近年来,随着内镜设备的更新、各种辅助技术的发展,以及内镜医师对CLST的认识增强,CLST检出率较前增加。现对CLST癌变及筛查研究现状做一综述。
【关键词】侧向发育型肿瘤结直肠癌癌变特征癌变机制筛查
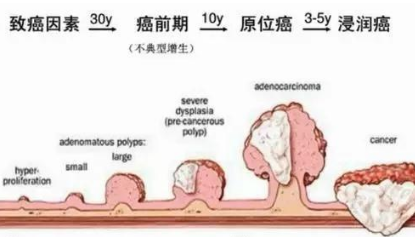
随着我国经济高质量发展,居民生活水平的日益提升,大众在吃喝住行方面都有了显著的改善,特别是在饮食方式上,大众更加偏好重口味,各种高糖高脂、辛辣冰冷、刺激性的食物摄入量急剧增加,长期饥饱失常、饮食不当、熬夜等,使结直肠癌(colorectal cancer,CRC)患者数量不断上升。由于我国人们缺乏CRC筛查意识及缺乏有效的筛查手段,其发病率呈年轻化趋势,且发生、发展隐秘,多数患者发现时已属于CRC中晚期。CRC是典型的“寂静的肿瘤”,根据患者各阶段的发病情况及病理表现可分为4个阶段,每个阶段的存活率各异。在1期越早治疗,治愈率越高,5年存活率可达90%以上;而4期可发生全身广泛扩散,其5年生存率仅8%。CRC非一蹴而就,这个过程通常需要数十年的时间[1],这一特征使CRC成为可预防、部分可治愈、大部分可通过治疗延长生存时间的恶性肿瘤之一[2]。因此,提高CRC前体病变的检出率、切除率成为降低CRC发病率和累积死亡率的关键环节。CRC前体病变有结直肠腺瘤、息肉病伴异型增生、无蒂锯齿状病变、传统锯齿状腺瘤、炎症性肠病相关异型增生等[3]。结直肠侧向发育型肿瘤(colorectal laterally spreading tumor,CLST)因其病理类型主要为腺瘤或锯齿状病变,被认为是CRC的一种特殊前体病变[4]。随着内镜技术的发展及内镜医生对CLST的认识,CLST的内镜检出率逐渐提高。CLST的筛查技术手段多样,一些系统性个体化筛查方案仍在不断探索和突破中。
1 CLST癌变特征
CLST被定义为直径≥10 mm、沿肠壁周围横向扩散的扁平型肿瘤[5]。CLST比息肉样腺瘤具有更高的恶性潜力,具有独特的病理形态和发育模式,因此,CLST在结肠镜(colonoscopy,CS)检查下经常被误诊。近年来,由于内镜诊断和治疗技术的不断发展,CLST的检出率有所提高。CLST与CRC密切相关,CLST可在20年内发展为晚期CRC,由于术前对CLST的评估不充分,一些患者未能接受适当的治疗。因此,充分了解CLST的癌变特征,对制定准确的治疗方案、精准的术前评估具有重要意义。内镜下CLST的形态多种多样,可分为颗粒性CLST(CLST-granular type,CLST-G),其分为颗粒均一型(CLST-G-homogeneous type,CLST-GH)和结节混合型(CLST-G-nodular mixed type,CLST-GM);非颗粒性CLST(CLST-non-granular type,CLST-NG),其分为扁平隆起型(CLST-NG flat elevated type,CLST-NG-F)和假凹陷型(CLST-NG pseudo depressed type,CLST-NG-PD)。研究显示,CLST 4个亚型的临床病理学特征存在显著差异,CLST-GM和CLST-NG-PD癌变的风险明显升高,且CLST-GM和CLST-NG-PD是CLST癌变的独立危险因素[6]。对于CLST的好发部位,既往文献存在争议,不同国家和地区的报道也不同,意大利及日本的研究指出CLST好发于右半结肠[3,7]。我国研究也显示右半结肠CLST的比例最高,而许炎钦等[8]指出CLST好发于远端结肠,且主要分布于直肠。李继昂等[6]研究显示,CLST好发于右半结肠,其次为直肠,CLST好发部位可能与当地人群的遗传背景、饮食等有关。此外,直肠部位的CLST癌变率较高,这可能是因为直肠的CLST-GM和CLST-NG-PD比例较高,两组者更易癌变,且相较于其他部位,直肠管腔更大、血供更丰富,CLST生长速度明显更快,而病变越大癌变风险越高;肠内容物中的致癌物质及炎症介质在直肠等远端结肠中停留时间较长,长时间刺激可能会导致癌变风险增大。研究发现,CLST患者中老年人(≥60岁)比例最高[9],可能随着年龄增长肠道功能障碍发生率明显升高,更易受慢性炎症刺激,且与肠道相关炎症的暴露次数增加及肠道菌群发生变化等因素相关[10-11]。除此之外,男性患者明显多于女性[12],可能是相较于女性,男性更多地暴露于CRC等病变的危险因素,如进食蛋白质类食物、吸烟等,但近期也有研究显示女性CLST患病率更高,并指出可能与遗传背景、肠道菌群或性激素相关[13]。病变直径是影响CLST癌变的另一重要因素。既往研究显示,CLST病变越大,其恶性风险程度越高,且黏膜下浸润性癌的发生风险也随病变增大而增高[14]。病变直径为CLST癌变的独立危险因素,病变直径≥2.0 cm的患者发生癌变的风险更高。研究发现结肠远端病变、病变直径≥20 mm、有慢性胆囊炎、病理类型为传统锯齿状腺瘤(traditional serrated adenoma,TSA)、患有冠状动脉粥样硬化性心脏病为CLST型锯齿状病变合并高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)或癌变的独立危险因素,而高甘油三酯水平为保护因素[15]。
2 CLST癌变途径
目前对于CLST癌变途径还没有统一的看法,普遍认为这是一个包含多种基因变异和多阶段致癌的繁杂历程,以往研究表明CLST发生癌变的途径有以下3个,(1)腺瘤-癌途径:传统途径,约占癌变途径的80%[16];(2)de novo途径:是指不经过腺瘤发展阶段,而直接从正常肠黏膜癌变,恶性程度较高;(3)锯齿状途径:研究显示,CRC变途径中15%~30%是通过“锯齿状病变途径”发生的[17]。锯齿状病变因存在黏液帽、扁平和边界模糊等特征在内镜下难以诊断,导致漏诊率及不完整切除率较高。
3 CLST癌变分子机制
基因突变是DNA核苷酸序列的变化,这种变化可以是准时的,即局限于一个碱基对,也可以涉及多个碱基对,包括缺失、加成、扩增和重组。CLST癌变的主要分子机制包括KRAS基因突变、APC基因突变、p53基因、Ki-67过表达、桥粒芯糖蛋白4(desmoglein 4,Dsg4)过表达、斑菲素蛋白3(plakophilin 3,PKP3)过表达、连接桥粒斑珠蛋白(junction plakoglobin,JUP)过表达、环指蛋白6(ring finger protein 6,RNF6)过表达等。
3.1 KRAS基因突变
KRAS基因编码一种小GTP酶,其在CRC中的突变率为40%~54%。早年Hiraoka等[18]发现CLST存在很高的KRAS突变率。已有研究证实,KRAS突变状态与肿瘤血管生成及肿瘤细胞增殖、迁移等生物学行为有关[19]。
3.2 APC基因突变
与CRC遗传易感性相关的基因还包括APC基因,其为管家基因,归为肿瘤抑制基因。APC可以直接协助染色体的分离,抑制DNA复制,从而抑制结直肠肿瘤的发生和发展。
3.3 p53基因
p53基因是人体最重要的抑癌基因,基因突变后,其空间构象发生改变,编码的蛋白不仅失去正常功能,还可产生类似癌基因编码蛋白的功能,由抑癌基因转变为癌基因,促使癌细胞的分裂增殖,参与肿瘤的发生,提高CLST癌变机会。
3.4 Ki-67过表达
Ki-67是一种存在于细胞核中的蛋白,其水平与p53基因突变呈正相关,CRC中Ki-67高表达往往提示肿瘤预后不佳[20]。Nakae等[21]研究发现,腺瘤阶段的CLST-NG中的Ki-67表达水平(58%)显著高于CLST-G(30%)。
3.5桥粒家族蛋白
研究发现,与正常大肠黏膜组织隆起型腺瘤及大肠癌组织相比,桥粒胶糖蛋白家族成员DSG2、PKP3、JUP在结直肠CLST中的蛋白表达水平均显著上调[22]。提示桥粒家族蛋白DSG2、PKP3、JUP可能在CLST生长发育过程中扮演着重要的作用。
3.6 RNF6过表达
有研究表明,RNF6在CRC中的过表达可以增加糖原合酶激酶3β(glycogen synthase kinase-3,GSK-3β)磷酸化水平或泛素化人转导样增强蛋白3(transducin-like enhancer protein 3,TLE3),导致Wnt/β-catenin信号通路的激活,促进了结直肠细胞的侵袭和迁移,提示RNF6通过影响Wnt/β-catenin信号通路促进CRC的发生发展。RNF6蛋白表达水平在癌旁正常组织、结直肠隆起型腺瘤(protruded-type colorectal adenoma,PA)、CLST及CRC组织中呈递增趋势,且在CLST中的表达与其上皮内瘤变级别相关,提示RNF6可能参与了CLST的发展及癌变过程,有望成为CLST理想的治疗靶点[23]。
3.7 Wnt信号通路的激活
有研究提示,Wnt信号通路的激活可能与LST的发生、发展相关[24]。Wnt信号通路相关分子富含亮氨酸重复序列G蛋白偶联受体5(LGR5)、细胞周期蛋白依赖性激酶5(CDK5)和β-连环蛋白(β-catenin)均与肿瘤生物学行为关系紧密,并与多种肿瘤的不良预后有关。CDK5参与多种癌症的肿瘤增殖、迁移和侵袭过程,LST组织中CDK5的表达高于正常组织及PA组织,提示CDK5可能与LST的特殊生长方式相关。LGR5是Wnt信号传导的一部分,可以调节Wnt信号通路的表达水平,并且对肿瘤的发生、发展和转移起至关重要的作用。研究发现LGR5在LST组织表达水平低于CRC组织而高于PA组织,LGR5在正常组织、炎性息肉、腺瘤、腺癌中的阳性表达呈现逐渐增高趋势,考虑其表达与异型增生程度相关[25]。提示LGR5可能参与LST的特殊生长方式或恶变潜能,是促进结直肠黏膜组织异性增生并进一步导致LST癌变进展的重要分子。既往研究证实β-catenin表达升高可以激活Wnt信号通路下游靶基因进而促进EMT[26]。因此,LGR5、CDK5可能通过Wnt/β-catenin信号通路调控EMT参与LST的特殊生长方式和癌变。
4 CRC及CLST的筛查方法
经过近30年的探索与努力,我国关于CRC及CLST的研究取得了显著的进步,为提高CRC及CLST早诊早治率,科研工作者不断推动技术革新并优化现有策略,现如今,筛查方式及方案已多种多样。
4.1粪便隐血试验(FOBT)
FOBT是一种重要的非侵入式癌症筛查方式,多项随机对照研究结果支持粪便隐血检测用于CRC筛查,其主要包括愈创木酯法(guaiac-based FOBT,gFOBT)和免疫化学法(fecal immunochemical test,FIT)。血红蛋白中的含铁血红素有催化过氧化物分解的作用,当消化道少量出血时,能催化试剂中的过氧化氢分解并释放新生态氧,氧化色原物质而显色,显色的深浅与血红蛋白的含量呈正相关。FOBT正是利用上述原理,为CRC的早期发现、早期诊断提供重要参考。有关研究显示,FOBT特异度较好,达95.8%,而敏感度不佳,为41.9%[27]。近年来,FOBT技术不断优化及改进。gFOBT基于指示试剂愈创木脂可以与粪便中含有的血红素反应从而呈现蓝色的原理,其结果显示迅速、清晰。但其特异度差,部分食物及药物对结果有较大干扰,其假阳性率达30%,需要多次采样。而FIT是利用单克隆或多克隆抗体直接检测人粪便中的血红蛋白,不受进食食物的影响,一定程度上解决了gFOBT的不足,更适用于大众的筛查。
4.2粪便DNA检测
CRC患者不断地有肿瘤细胞脱落到肠腔内并随着粪便排出体外,其中含有特殊成分(如甲基化的人类基因),这些微量的DNA变化必须通过高度灵敏的化验才能检测出来。研究显示,粪便DNA检测对CRC和进展期息肉的敏感度均优于FIT[28]。
4.3蛋白质标志物
常见的粪便标志物:血红蛋白、粪便钙卫蛋白(fecal calprotectin,FCP)、肿瘤型M2丙酮酸激酶(M2 pyruvate kinase,M2-PK)等。M2-PK是一项较为标志性的指标,并且广泛应用于各种恶性肿瘤的前期诊断和后期治疗。近年来,有学者认为FCP是CRC的潜在标志物。FCP是由中性粒细胞产生的钙结合蛋白(约36 kDa),占细胞总蛋白质的5%,中性粒细胞通过肠黏膜下的微小血管分泌进入肠腔,进而释放出FCP。粪便中的钙卫蛋白含量高,理化性质稳定,分布均匀,在肠道发生炎症反应时,转移进入肠腔的粒细胞增多进而导致FCP含量的增加。肿瘤组织的周围存在有炎症细胞,由于它的浸润与扩展,FCP的含量也在不断上升。
4.4循环肿瘤细胞(circulating tumor cells,CTCs)
CTCs是外周血中发生癌变的各类细胞的总称,其附着于肿瘤病灶转移到外周血中,大部分会被吞噬或清除,少数能逃逸而锁定其他部位增殖扩散,增加CRC患者的死亡风险。除此之外,CTCs在早期诊断过程中对肿瘤患者的疗效预测具有参考价值,在耐药机制的研究中也有重要的临床意义。
4.5循环肿瘤DNA(circulating tumor DNA,ct-DNA)
ct-DNA是肿瘤早筛的重要成员之一。研究表明,ct-DNA将应用于CRC患者辅助化疗和时长的选择、用于辅助治疗和一线治疗预后的判断、CRC术后是否有微小残留的检测[29]。
4.6循环肿瘤RNA(circulating tumor RNAs,ctRNAs)
miRNA是现阶段描述最广泛的非侵入性生物标志物,广泛存在于血清和粪便中。miRNA CRC早期筛查项目利用分子诊断技术,检测外周血中CRC关联的特征性microRNA表达水平的变化,使用特定算法,可以在CRC发生的超早期进行动态监测,准确度高达82.4%,远高于常规血清学肿瘤标志物。
4.7肿瘤标志物(tumor marker,TM)
TM是指由恶性肿瘤细胞产生,并可在血液、组织液、分泌液或肿瘤组织中检测到的物质。对于CRC及CLST的诊断有重要意义的TM有血清癌胚抗原(carcinoembryonic antigen,CEA)、结肠癌抗原CA11-19(100 kDa糖蛋白)和外周血黏附分子CD24等。CEA指癌胚抗原,是一种结构复杂的可溶性糖蛋白。CEA的升高往往与肿瘤的增大有关,但其对结肠癌的检测和诊断无特异性,而是有助于判断CRC的预后,监测疗效和发现复发。CA11-19标记蛋白,研究发现其敏感度达98%,特异度达84%[30]。
4.8彩色多普勒超声检查、超声内镜检查
彩超不仅可以检查出CRC的类型,还可以诊断癌症的浸润和转移情况,其准确度高,操作简单,迅速,对CRC及CLST的筛查具有较高的临床价值。超声内镜(endoscopic ultrasonography,EUS),被誉为“内镜医生的火眼金睛”,其对CRC及CLST浸润深度的判断及壁外淋巴结的肿大诊断较准确,优于腹部CT等影像学检查,还可进一步行EUS引导下细针穿刺活检(EUS-guided fine needle aspiration,EUS-FNA),获得病理组织,为手术及化疗提供依据,在CRC及CLST的早期诊断及治疗中有很大的应用价值。
4.9结肠造影(CT colonography,CTC)
CTC是一种微创检查手段,也被称为CT仿真CS,与CS相比,CTC敏感度略低,不过因其侵入性较低、并发症较少等优点,适合用于年老、虚弱、肠道狭窄、接受抗凝治疗患者的筛查。但其有诸多局限性,如价格昂贵、存在射线危害、需注射造影剂,无形中给受筛查人群增加了心理压力,导致依从性低。
4.10磁共振(magnetic resonance imaging,MRI)和磁共振全身弥散成像(whole body diffusion weighted imaging,WB-DWI)检查
MRI具有很好的高软组织密度分辨率,可据此判断病灶侵犯深度,从而帮助临床将肿瘤进行分期,对手术方案的制定和术后观察具有重要的作用[31]。但其检查所需时间长,检查的密闭环境及产生的噪音会令部分患者感到不安,这些有可能成为筛查过程中的障碍。WB-DWI又称“MR类PET”技术,其有诸多优势如可以应用到常规体检当中、无辐射损害、无须注射造影剂和经受放射性核素污染、检查方法简单、迅速、无创,对CRC及CLST的早期诊断具有重要意义。
4.11 CS检查
“CS检查+病理活检”是CRC筛查中最为重要的步骤,是筛查流程的核心环节。CS可完整地检视整段结直肠的情况,必要时对病变部位进行染色及取活组织做病理检查[32],还可对肠道病变进行治疗,如息肉等良性病变镜下直接摘除、镜下止血、清除大肠异物等。但其仍存在局限性,如受检者要严格进行饮食限制和肠道准备,以便检查没有异物干扰;预检过程也较为复杂,患者需要先完成血常规及凝血象检查,还需提供心电图结果;有药物过敏史、严重的呼吸系统疾病伴痰多者、伴有严重心脑血管疾病者不适合做无痛检查,普通肠镜使受检者需承受较大痛苦;CS作为侵入性检查有一定的并发症发生率,如急性腹痛、出血、穿孔等;实施CS初筛需要庞大的人力资源和设施投入,考虑到我国当前内镜相关的医疗资源短缺的问题,它的实际运用受到了很大的制约。
4.12风险问卷评估
CRC的危险因素包括遗传因素、行为与环境因素、心理因素、慢性炎症、肠道菌群、代谢相关疾病等,且各因素之间有交互作用。现有的依据CRC高危因素制定的,临床实践中运用较多的有高危因素问卷(high risk factor questionnaire,HRFQ)调查和亚太结直肠肿瘤筛查评分系统(Asia-Pacific colorectal screening,APCS)。在现阶段,我国研究人员不断完善HRFQ的各项功能,从而与FOBT互相配合共同完成CRC及CLST的筛查工作。与HRFQ相比,APCS具有更高的准确性和实用性,并且在操作方法上也更为容易,大大节省了时间,提高了工作效率,最为重要的是对肠道肿瘤的测量值较为精准[33]。
4.13肠道菌群
肠道菌群在结直肠肿瘤的发生发展过程中有着显著作用。房永坤等[34]研究表明,CRC患者的粪便和组织中的肠道菌群与正常人相比,乳杆菌目富集,柔嫩梭菌减少,乳杆菌属在CRC及CLST患者的粪便及肠黏膜中丰度显著增加。产肠毒素脆弱拟杆菌(enterotoxigenic bacteroides fragilis,ETBF)在患者的粪便和黏膜可以检测到,它加快结肠屏障损伤,其编码的金属蛋白酶脆弱拟杆菌毒素(Bacteroides fragilisenterotoxin,BFT),通过靶向肠细胞紧密连接,切割E-cadherin,从而增加炎症和肠道通透性,诱导CRC的慢性肠道炎症和组织损伤。有研究通过实时荧光定量聚合酶链式反应,与肝细胞癌(hepatocellular carcinoma,HC)组相比,CLST组ETBF的丰度显著增高,此结果表明,ETBF可能在CLST的发生发展中有着重要作用[35]。
4.14人工智能(artficial intelligence,AI)
AI的发展已经成功地渗透到医学领域,并在诊断和治疗多种癌症,尤其是治疗CRC方面得到了广泛应用,引起了医学的广泛关注。AI的最新突破,特别是通过其新兴的子领域“深度学习”,对计算机辅助CS检测和定性具有直接影响,也促进了医学图像分析的应用,对结肠息肉大小的测量具有较高的准确性和可靠性,能避免内镜医师自身对息肉大小的错误评估。CRC是一种高度可预防的疾病,CAD是降低这种恶性肿瘤发病率的关键一步。CAD可以帮助内镜医生检测和诊断癌前病变或早期CRC,并给予及时诊断和治疗,从而可以明显改善CRC及CLST患者的临床预后[15]。
5 CRC及CLST筛查所面临的挑战
CRC及CLST筛查覆盖率低的现象背后,是诸多因素共同作用的结果。其一,大部分无症状居民健康意识薄弱,初筛顺应性较差,缺乏参与筛查的行为动机。对此应呼吁公众珍爱健康,提高人群的主动筛查意识和依从性,采取正确的科普教育方式使公众提高防癌意识。其二,初筛工具自身存在一定的局限性,如问卷筛查的主观性偏差、试剂检测的特异性不足、筛查耗时、费用相对高昂等直接提高了服务开展过程中用户参与门槛。对此中央和地方财政应加大对癌症筛查民生工程的资源投入,纳入更多前沿癌症早筛技术,政府机构、医疗机构、企业共同促进癌症筛查民生项目发展。其三,现阶段我国医疗资源分布不平衡,消化内镜医师技术参差不齐,造成了不同地区不同医院的医师对早期癌症的识别和诊断能力不同,对此应采取科学合理的培训,培养出大量优秀的內镜医师,切实保障内镜诊疗结果的真实性与可靠性。
综上所述,CLST在国内的相关研究刚起步,但其发生率并不低,目前对于CLST的发生及癌变途径还没有统一的结论,何种机制导致此病变呈隐匿生长并具有恶变潜质,机制尚不清楚。因此,过大医务人员应努力探索,不断进步,正确地认识CLST病变,提高CRC及CLST的诊断技术,优化筛查方案,并对其进行合理有效的治疗,从而降低CRC及CLST癌变的发生率。
参考文献
[1]International Agency for Research on Cancer.The Section of Cancer Surveillance[Z/OL].[2021-02-20].
[2]CAO W,CHEN H D,YU Y W,et al.Changing profiles of cancer burden worldwide and in China:a secondary analysis of the global cancer statistics 2020[J].Chinese Med J-Peking,2021,134(7):783-791.
[3]ROTONDANO G,BIANCO M A,BUFFOLI F,et al.The Cooperative Italian FLIN Study Group:prevalence and clinico-pathological features of colorectal laterally spreading tumors[J].Endoscopy,2011,43(10):856-861.
[4]张菊嫦,王学青,李爱民,等.结直肠侧向发育型肿瘤的临床病理特征和治疗方法的发展趋势分析[J].中华消化杂志,2017,37(2):88-93.
[5]KUDO S,LAMBERT R,ALLEN J I,et al.Nonpolypoid neoplastic lesions of the colorectal mucosa[J].Gastrointest Endosc,2008,68(4 Suppl):S3-S47.
[6]李继昂,黄晓俊.结直肠侧向发育型肿瘤的临床病理特征及癌变的危险因素分析[J].中国医刊,2023,58(5):489-494.
[7]范久亿,李军,丁士刚.Wnt信号通路在结直肠侧向发育型肿瘤中的研究进展[J].胃肠病学,2018,23(11):689-692.
[8]许炎钦,林峥嵘,钟世顺,等.老年人结直肠侧向发育型肿瘤恶变相关危险因素分析[J].中华消化内镜杂志,2020,37(12):892-897.
[9]冯轶,牛应林,李鹏,等.结直肠侧向发育型肿瘤的内镜表现及病理特点研究[J].中国内镜杂志,2019,25(1):79-84.
[10]HAO Y,WANG Y,QI M,et al.Risk factors for recurrent colorectal polyps[J].Gut Liver,2020,14(4):399-411.
[11]杨丽萍,马臻棋,王学红,等.肠道菌群与结肠息肉的关系研究进展[J].中国医刊,2022,57(2):139-141.
[12]吉晓凤,金多晨,党旖旎,等.结直肠侧向发育型肿瘤包括15例多发性病变的临床病理特征及癌变风险因素分析[J].南京医科大学学报(自然科学版),2022,42(4):535-541.
[13]ISHIGAKI T,KUDO S E,MIYACHI H,et al.Treatment policy for colonic laterally spreading tumors based on each clinicopathologic feature of 4 subtypes:actual status of pseudodepressed type[J/OL].Gastrointest Endosc,2020,92(5):1083-1094.e6.
[14]KIM K O,JANG B I,JANG W J,et al.Laterally spreading tumors of the colorectum:clinicopathologic features and malignant potential by macroscopic morphology[J].Int J Colorectal Dis,2013,28(12):1661-1666.
[15]木合塔尔·色特瓦勒迪.结直肠侧向发育型锯齿状病变癌变相关危险因素分析[D].乌鲁木齐:新疆医科大学,2023.
[16]DEKKER E,TANIS P J,VLEUGELS J L A,et al.Colorectal cancer[J].Lancet,2019,394(10207):1467-1480.
[17]周林香,沈磊.结直肠无蒂锯齿状病变的临床及内镜特征分析[J].临床消化病杂志,2023,35(5):376-380.
[18]HIRAOKA S,KATO J,TATSUKAWA M,et al.Laterally spreading type of colorectal adenoma exhibits a unique methylation phenotype and K-ras mutations[J].Gastroenterology,2006,131(2):379-389.
[19]LI W,LEE M R,KIM T,et al.Activated STAT3 may participate in tumor progression through increasing CD133/survivin expression in early stage of colon cancer[J].Biochem Biophys Res Commun,2018,497(1):354-361.
[20]HAYASHI H,BEPPU T,SAKAMOTO Y,et al.Prognosticvalue of Ki-67 expression in conversion therapy for colorectal liverlimited metastases[J].Am J Cancer Res,2015,5(3):1225-1233.
[21]NAKAE K,MITOMI H,SAITO T,et al.MUC5AC/β-catenin expression and KRAS gene alteration in laterally spreading colorectal tumors[J].World J Gastroenterol,2012,18(39):5551-5559.
[22]王显飞.结直肠侧向发育型肿瘤分子标志物的筛查及其生长机制初探[D].广州:南方医科大学,2016.
[23]郑晓芳,王锦玉,李子鑫,等.结直肠侧向发育型肿瘤组织中RNF6蛋白的表达变化及其意义[J].山东医药,2023,63(9):36-40.
[24]张泉,朱蓉,赵逵.Wnt/β-catenin信号通路及相关因子与大肠侧向发育型肿瘤发病机制的研究进展[J].重庆医学,2019,48(5):841-844.
[25]薛伟彩,王建立,许建成,等.结直肠息肉和结直肠癌中CD24和Lgr5的表达[J].中国老年学杂志,2018,38(13):3116-3119.
[26]JASS J R.Classification of colorectal cancer based on correlation of clinical,morphological and molecular features[J].Histopathology,2007,50(1):113-130.
[27]GIES A,BHARDWAJ M,STOCK C,et al.Quantitative fecal immuno chemical tests for colorectal cancer screening[J].International Journal of Cancer,2018,143(2):234-244.
[28]MU J Y.Plausibility of an extensive use of stool DNA test for screening advanced colorectal neoplasia[J].Clin Chimica Acta,2020,501:42-47.
[29]刘骏,吴双杰,李孟军,等.ctDNA检测KRAS基因在结直肠癌预后中价值的临床研究及Meta分析[J].同济大学学报(医学版),2023,44(4):580-587.
[30]NIKOLAOU S,QIU S,FIORENTINO F,et al.Systematic review of blood diagnostic markers in colorectal cancer[J].Techniques in Colo-proctology,2018,22(7):481-498.
[31]叶文钦,陈泽文,陈忠,等.多参数MRI在结直肠癌诊断中的应用价值[J].中国CT和MRI杂志,2017,15(5):135-138.
[32]TAN W S,TANG C L,KOO W H.Opportunistic screening for colorectal neoplasia in Singapore using faecal immunochemical occult blood test[J].Singapore Med J,2013,54(4):220-223.
[33]翟爱军,翟惠虹,陈洪,等.APCS评分系统与问卷调查在体检人群结直肠癌机会性筛查中效果的比较[J].中华保健医学杂志,2018,20(3):217-219.
[34]房永坤.结直肠癌患者肠道菌群多样性及其与临床病理特征关系的研究[D].大连:大连医科大学,2023.
[35]沈潇男.结直肠侧向发育型肿瘤的肠道菌群特点[D].上海:上海交通大学,2023.










