对乙酰氨基酚引起的急性肝损伤对大鼠脑内内源性物质的影响论文
2024-07-02 09:37:09 来源: 作者:xieshijia
摘要:目的探索对乙酰氨基酚引起的急性肝损伤对大鼠脑内内源性物质的影响。方法2023年4—6月在蚌埠医科大学选取12只雄性Sprague-Dawley大鼠,采用随机数表法分为对照组(生理盐水灌胃)和对乙酰氨基酚组(以灌胃给药方式建立急性肝损伤模型),各6只。测定大鼠肝脏谷丙转氨酶和谷草转氨酶活力,脑内多巴胺和5-羟色胺含量及血浆中5-羟色胺含量。结果对乙酰氨基酚组大鼠肝脏谷丙转氨酶和谷草转氨酶活力均显著高于对照组[(30.31±18.02)U/L vs(7.58±1.65)U/L],[(53.53±26.54)U
[摘要]目的探索对乙酰氨基酚引起的急性肝损伤对大鼠脑内内源性物质的影响。方法2023年4—6月在蚌埠医科大学选取12只雄性Sprague-Dawley大鼠,采用随机数表法分为对照组(生理盐水灌胃)和对乙酰氨基酚组(以灌胃给药方式建立急性肝损伤模型),各6只。测定大鼠肝脏谷丙转氨酶和谷草转氨酶活力,脑内多巴胺和5-羟色胺含量及血浆中5-羟色胺含量。结果对乙酰氨基酚组大鼠肝脏谷丙转氨酶和谷草转氨酶活力均显著高于对照组[(30.31±18.02)U/L vs(7.58±1.65)U/L],[(53.53±26.54)U/L vs(16.99±1.35)U/L],差异有统计学意义(t=-2.887、-2.882,P均<0.01)。与对照组相比,对乙酰氨基酚组大鼠的皮层和海马组织多巴胺含量内分别增加了9.9%和8.6%,在皮层、海马组织和血浆内5-羟色胺含量分别增加了14.8%、3.1%和9.5%,但差异无统计学意义(P均>0.05)。结论与对照组相比,对乙酰氨基酚引起的急性肝损伤使大鼠脑内的内源性物质水平有上升趋势,但差异无统计学意义。造成这种结果的原因可能是对乙酰氨基酚给药剂量或给药频率不够所致的肝损伤程度不够。
[关键词]对乙酰氨基酚;急性肝损伤;多巴胺;5-羟色胺
Effects of Acetaminophen-induced Acute Liver Injury on Endogenous Sub⁃stances in Rat Brain
ZHANG Jiaxin1,YE Xionglong2,HUANG Zhijian2,WU Xiaoyue2,CHENG Hongwei2,KONG Weimin2
1.Department of Pharmacy,Hunan Provincial People′s Hospital/the First Hospital Affiliated to Hunan Normal Univer‐sity,Changsha,Hunan Province,410002 China;2.School of Pharmacy,Bengbu Medical University,Bengbu,Anhui Province,233030 China
[Abstract]Objective To explore the effects of acetaminophen-induced acute liver injury on endogenous substances in rat brain.Methods Twelve male Sprague-Dawley rats were selected from April to June 2023 at Bengbu Medical University and divided into six each of control group(physiological saline gavage)and acetaminophen group(to estab‐lish an acute liver injury model by gavage administration)by random number table method.The liver alanine amino‐transferase and aspartate aminotransferase activities,brain dopamine and 5-hydroxytryptamine levels and plasma 5-hydroxytryptamine levels were measured in rats.Results The liver alanine aminotransferase and aspartate aminotrans‐ferase activities of rats in the acetaminophen group were significantly higher than those of the control group[(30.31±18.02)U/L vs(7.58±1.65)U/L],[(53.53±26.54)U/L vs(16.99±1.35)U/L],and the differences were statisti‐cally significant(t=-2.887,-2.882,both P<0.01).Compared with the control group,rats in the acetaminophen group showed an increase of 9.9%and 8.6%within the cortical and hippocampal tissue dopamine content,respectively,and 14.8%,3.1%,and 9.5%within the cortical,hippocampal tissue,and plasma 5-hydroxytryptophan content,respec‐tively,but the difference was not statistically significant(all P>0.05).Conclusion Acute liver injury induced by acet‐aminophen resulted in a trend toward increased levels of endogenous substances in the rat brain compared with the control group,but there was no statistically significant difference.It is hypothesized that the reason for this result may be the insufficient level of liver injury due to the insufficient dose or frequency of acetaminophen administration.
[Key words]Acetaminophen;Acute liver injury;Dopamine;5-Hydroxytryptamine
对乙酰氨基酚(Acetaminophen,APAP)过量常引发药物性肝损害、急性肝损伤(Acute Liver Fail‐ure,ALF)、肝性脑病(Hepatic Encephalopathy,HE),甚至死亡,已成为被广泛关注的重大公共卫生问题[1,2]。肝损伤时体内多巴胺(Dopamine,DA)和5-羟色胺(5-hydroxytryptamine,5-HT)含量发生改变,改变趋势与模型类型、实验室等因素有关。研究表明,HE常伴随着脑内DA水平的升高[3]。此外,CCl4诱导的HE大鼠的海马组织DA水平显著降低[4]。文献报道,在肝损伤状态下中,大鼠的肝脏、血浆及脑内海马组织5-HT的含量显著增高[5-6]。本研究旨在探索APAP引起的ALF对大鼠脑内内源性物质的影响。本研究于2023年4—6月在蚌埠医科大学选取12只雄性Sprague-Dawley大鼠分为对照组和APAP组,灌胃给予大鼠1 000 mg/kg APAP进行ALF模型构建,分析其肝脏损伤情况和脑内源性物质的变化,以增加对APAP所致肝损伤和脑损伤的认识。现报道如下。

1材料与方法
1.1实验材料
1.1.1实验动物雄性Sprague-Dawley大鼠12只,由杭州医学院提供,合格证编号为(20230406Aazz01 00000812)。动物实验经蚌埠医科大学动物伦理委员会批准(伦动科批字[2023]第167号)。动物在恒湿(55±5)%,恒温(23±1)℃的自然昼夜环境饲养,并给予标准饲料及自由饮水。
1.1.2实验材料多巴胺酶联免疫吸附测定试剂盒(武汉伊莱瑞特生物科技股份有限公司);血清胺盐酸盐(阿拉丁试剂有限公司);半胱氨酸(上海皓鸿生物医药科技有限公司);甲醇(色谱级,美国Thermo Scientific公司);高氯酸(茂名市雄大化工有限公司);盐酸(国药集团化学试剂有限公司),实验室用水为超纯水,其他为市售分析纯。
1.1.3实验仪器Synergy HT多功能微孔板检测系统;高效液相色谱-荧光检测仪(由CBM-20A系统控制器、LC-20A输液泵、CTO-20A柱温箱、RF-20A荧光检测器、SIL-20A自动进样器和Labsolutions工作站等组成);Milli-Q Gradient A10超纯水器;Ver‐sati台式微量冷冻离心机;F6/10手持式高速匀浆机;ME204E/02万分之一电子天平,XP205十万分之一电子天平;漩涡混合仪;磁力搅拌器;超低温冰箱。
1.2方法
1.2.1对乙酰氨基酚诱导急性肝损伤大鼠模型的建立用0.5%CMC-Na溶液溶解APAP,配置浓度为100 mg/mL APAP溶液。大鼠适应性喂养1周后,采用随机数表法分为APAP组(237.67±18.79)g和对照组(237.5±29.83)g,各6只。APAP组大鼠按体质量单次灌胃APAP溶液,剂量为1 000 mg/kg[7],对照组大鼠按体质量灌胃生理盐水10 mL/kg。处死前12 h禁食不禁水。给药24 h后采集大鼠血液,置于肝素(10 IU/mL)处理过或未处理的EP管中,4 000 g离心10 min制备血浆和血清样本,置于4℃暂存。大鼠麻醉后经股动脉放血后,收集肝脏和脑组织(皮层和海马组织),滤纸滚血后置于-80℃冻存。
1.2.2大鼠脑内DA含量的测定按1∶10(w∶v)的比例分别称取50 mg皮层和25 mg海马组织置于玻璃匀浆器中,加入9倍体积生理盐水,充分研磨,涡旋混匀,12 000 rpm/min离心10 min,移取匀浆上清于干净的1.5 mL EP管中,12 000 rpm/min重复离心10 min取上清于干净的1.5 mL EP管中待测。整个处理过程处于冰浴或者4℃的环境中。依据,DA酶联免疫吸附测定试剂盒说明书所述操作步骤测定大鼠脑内DA含量[8],在450 nm波长处测定光密度(Optical Density,OD)值,计算结果。
1.2.3生物介质中5-HT的测定高氯酸沉淀剂由1.12 mL高氯酸,38.88 mL超纯水和0.007 27 g半胱氨酸配制而成。
组织样本处理:在万分之一电子天平上称取脑组织(皮层和海马组织)约50 mg,置于干净的2 mL EP管中,记录重量,加入250μL高氯酸沉淀剂,使用电动匀浆仪进行组织匀浆,18 000 rpm/min离心10 min,取200μL组织上清于干净的1.5 mL EP管中,18 000 rpm/min重复离心10 min,取上清液于干净的进样瓶中待测。
血浆样本处理:吸取100μL血浆,加入干净的1.5 mL EP管中,加入400μL高氯酸沉淀剂,涡旋混匀,18 000 rpm/min离心10 min,移取400μL血浆上清于干净的1.5 mL EP管中,18 000 rpm/min重复离心10 min,取上清液于干净的进样瓶中待测。
5-HT母液:称取0.006 04 g 5-HT盐酸盐,移液枪加入200μL甲醇溶解,再加800μL甲醇,配成5 mg/mL 5-HT母液。将5-HT的母液用甲醇进行梯度稀释成浓度为15.625、125、250、500、1 000、2 000、4 000 ng/mL的母液,-20℃保存。移取上述的不同浓度的工作曲线母液10μL于干净的1.5 mL EP管中,加入90μL高氯酸沉淀剂,涡旋混匀,18 000 rpm/min低温离心10 min,移取液体于干净的进样瓶中待测。整个处理过程处于冰浴或4℃的环境中。以标准品浓度(y)对色谱峰峰面积(x)用加权(权重系数为1/x2)最小二乘法进行线性回归,计算标准曲线并回算浓度。所有标准曲线标准品精确度在(标示值±15%)范围内。5-HT标准曲线公式为y=20 166.2x+652.516(r2=0.987 8)。色谱条件:WelchUltimateXB-C18柱(4.6×250 mm,5μm)。流动相:磷酸盐缓冲液(50 mMKH2PO4,0.08 mMEDTA,超纯水溶解):甲醇=88∶12(v∶v)。流速为1 mL/min。进样量20μL,样品分析时长为20 min。荧光检测器激发波长为290 nm,发射波长为330 nm。柱温箱温度为40℃。
1.3观察指标
比较两组谷丙转氨酶(Alanine Aminotransfer‐ase,ALT)、谷草转氨酶(Aspartate Transaminase,AST)水平;比较两组DA、5-HT水平。
1.4统计方法
采用SPSS 26.0统计学软件对数据进行处理。大鼠肝脏ALT和AST活力值数据采用非参数检验中Mann Whitney U test进行检验,其他服从正态分布且方差齐性的计量资料使用t检验,均以(±s)表示。P<0.05为差异有统计学意义。
2结果
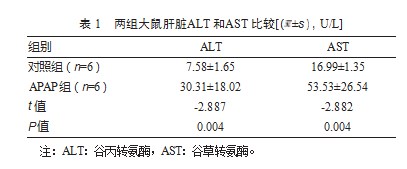
2.1两组大鼠肝脏ALT和AST比较
与对照组大鼠相比,APAP组大鼠肝脏的ALT和AST活力均显著上升,差异有统计学意义(P均<0.01)。见表1。
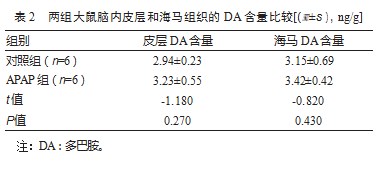
2.2两组大鼠脑内皮层和海马组织的DA含量比较
与对照组相比,APAP组大鼠皮层和海马组织中DA的含量有上升趋势,在皮层和海马组织中分别增加了9.9%和8.6%,但差异无统计学意义(P均>0.05)。见表2。
2.3两组大鼠脑内皮层、海马组织和血浆中的含量比较
与对照组相比5-HT在大鼠皮层、海马组织和血浆中的含量分别增加了14.8%、3.1%和9.5%,但差异无统计学意义(P均>0.05)。见表3。

3讨论
APAP是用途广泛的解热镇痛药[9],过量使用和滥用可能引发ALF、HE甚至是死亡[10-11]。本研究旨在探索APAP引起的ALF对大鼠脑内内源性物质的影响,将12只雄性Sprague-Dawley大鼠分为对照组和APAP组,观察其肝脏损伤情况和脑内源性物质的变化,以增加对APAP所致肝损伤和脑损伤的认识。
本研究采用灌胃给予大鼠1 000 mg/kg APAP进行ALF模型构建,通过观察造模后大鼠皮层和海马组织内DA和5-HT的变化,来探究该模型是否引起脑损伤。首先,本研究中ALT和AST两种指标分别升高约4.0和3.2倍,表明过量的APAP引发大鼠一定程度的肝损伤。因此,APAP引起的药源性肝损伤模型的构建是成功的。文献曾报道过与本研究类似的结果,在灌胃给予大鼠1 250 mg/kg APAP的ALF模型中,ALT在24 h时模型组值大约达到对照组的4倍,分别为(134.67±18.36)U/L和(31.80±5.12)U/L,AST在24 h时模型组值大约为对照组的2倍,分别为(171.33±15.77)U/L和(93.67±27.31)U/L[12]。本研究发现,APAP组大鼠给药24 h后皮层和海马组织内DA和5-HT的水平均呈上升趋势,但差异无统计学意义(P均>0.05)。其中,DA在ALF大鼠的皮层和海马组织内分别增加了9.9%和8.6%,5-HT在皮层、海马组织和血浆内分别增加了14.8%、3.1%和9.5%。以上结果表明,单次灌胃给予1 000 mg/kg的APAP,虽然能够造成大鼠肝损伤,但是脑损伤程度对比,差异无统计学意义(P均>0.05),这可能与肝损伤程度不够有关。有文献报道连续14 d灌胃给予大鼠1 000 mg/kg APAP后,相比于对照组,ALT和AST分别上升14.7和3.9倍[13],肝损伤程度更高。因此,后期可考虑由单次给药变为多次给药造模,以期达到脑损伤。
当然,结果的不理想可能与肝损伤模型类型、实验环境和动物本身个体差异等因素有关。文献中的不同肝损伤模型中DA和5-HT的变化趋势并不一致,甚至同一种模型不同的研究者得出的研究结论也不尽相同。例如,Ding S[3]报道用TAA诱导MHE大鼠,MHE组大鼠肝脏、血清和海马组织中DA水平显著升高;Abdelghffar EAR[14]报道,经TAA处理的大鼠HE模型中,HE组大鼠脑内DA含量减少,5-HT含量增加。ZHANG YX报道,在CCl4诱导的ALF大鼠的肝脏和血浆中5-HT含量增加[5]。El Khiat A等[15]在TAA诱导的ALF大鼠研究表明,ALF大鼠脑内5-HT水平下降。
综上所述,本研究中APAP肝损伤模型引起的脑损伤无统计学差异的原因可能是肝损伤程度不够。接下来,可尝试改变APAP肝损伤模型的造模方式,包括改变给药方式、给药时间和给药剂量,增加肝损伤程度,对APAP引起的脑损伤进行进一步的研究。
[参考文献]
[1]邵宇云,王涵,王潇,等.Notch1在对乙酰氨基酚诱导的肝损伤中的作用及机制[J].南京医科大学学报:自然科学版,2023,43(10):1350-1355,1365.
[2]赵强.对乙酰氨基酚诱导急性肝损伤相关的关键转录因子的鉴定与分析[D].太原:山西医科大学,2023.
[3]Ding S,Liu L,Jing H,et al.Dopamine from cirrhotic liver contributes to the impaired learning and memory ability of hippocampus in minimal hepatic encephalopa‐thy[J].Hepatol Int,2013,7(3):923-936.
[4]Chen B,Yang Y,Li S,et al.The critical role of hippo‐campal dopamine in the pathogenesis of hepatic encepha‐lopathy[J].Physiol Res,2021,70(1):101-110.
[5]Zhang YX,Li C,Liang XR,et al.Role of 5-HT degra‐dation in acute liver injury induced by carbon tetrachlo‐ride[J].Eur J Pharmacol,2021,908:174355.
[6]Saad MA,Rastanawi AA,El-Yamany MF.Alogliptin abates memory injuries of hepatic encephalopathy induced by acute paracetamol intoxication via switching-off autophagy-related apoptosis[J].Life Sci,2018,215:11-21.
[7]Jin SM,Kil HR,Park K,et al.Gene expression in rat hearts following oral administration of a single hepato‐toxic dose of acetaminophen[J].Yonsei Med J,2012,53(1):172-180.
[8]Bai Z,Yang P,Yu F,et al.Combining adoptive NK cell infusion with a dopamine-releasing peptide reduces se‐nescent cells in aged mice[J].Cell Death Dis,2022,13(4):305.
[9]黄友芳.γ-谷氨酰半胱氨酸减轻对乙酰氨基酚所致小鼠药物性肝损伤的作用及机制研究[D].南京:南京大学,2021.
[10]Bunchorntavakul C,Reddy KR.Acetaminophen(APAP or N-Acetyl-p-Aminophenol)and Acute Liver Failure[J].Clin LiverDis,2018,22(2):325-346.
[11]Fisher ES,Curry SC.Evaluation and treatment of acet‐aminophen toxicity[M].Drug-induced Liver Injury,2019,263-272.
[12]朱平生,焦炎杰,付双楠,等.对乙酰氨基酚致大鼠肝损伤早期生物标志物水平的变化规律[J].中国实验方剂学杂志,2019,25(2):118-123.
[13]Wang L,Zhang L,Wang J,et al.Protective effect of dandelion leaf water extracts on APAP-induced liver in‐jury in rats and its mechanism[J].Cell Mol Biol(Noisy-le-grand),2022,68(5):24-33.
[14]Abdelghffar EAR,El-Nashar HAS,Fayez S,et al.Ame‐liorative effect of oregano(Origanum vulgare)versus si‐lymarin in experimentally induced hepatic encephalopa‐thy[J].Sci Rep,2022,25,12(1):17854.
[15]El Khiat A,Tamegart L,Draoui A,et al.Kinetic dete‐rioration of short memory in rat with acute hepatic en‐cephalopathy:Involvement of astroglial and neuronal dysfunctions[J].Behav Brain Res 2019,367:201-209.










