伴肠母细胞分化的胃腺癌临床病理分析论文
2024-06-25 10:57:46 来源: 作者:xieshijia
摘要:目的:探讨伴肠母细胞分化的胃腺癌(GAED)的临床病理学特征、免疫表型、诊断及鉴别诊断。方法:回顾性分析2016年1月—2022年10月福州市中医院、福建医科大学附属第二医院及泉州市第一医院收治的10例GAED患者的临床资料,观察组织病理形态学和免疫组化结果。结果:10例GAED患者中男8例,女2例;平均年龄69.4岁。主要表现为腹痛、呕血伴黑便。6例发生于胃窦,2例发生于胃体,2例发生于贲门。肿瘤最大径2.5~8.0 cm,平均5.1 cm。镜下肿瘤主要呈管状、乳头状,少量呈筛状或实性片状,肿瘤细胞胞浆
【摘要】目的:探讨伴肠母细胞分化的胃腺癌(GAED)的临床病理学特征、免疫表型、诊断及鉴别诊断。方法:回顾性分析2016年1月—2022年10月福州市中医院、福建医科大学附属第二医院及泉州市第一医院收治的10例GAED患者的临床资料,观察组织病理形态学和免疫组化结果。结果:10例GAED患者中男8例,女2例;平均年龄69.4岁。主要表现为腹痛、呕血伴黑便。6例发生于胃窦,2例发生于胃体,2例发生于贲门。肿瘤最大径2.5~8.0 cm,平均5.1 cm。镜下肿瘤主要呈管状、乳头状,少量呈筛状或实性片状,肿瘤细胞胞浆透亮或弱嗜酸性。免疫表型:肿瘤细胞表达SALL4(9/10)、GPC3(6/10)、AFP(4/10)、CDX2(8/10)、CD10(2/10)、P53(8/10,突变型)。HER2基因检测2例出现基因扩增(2/10)。结论:GAED是一种产甲胎蛋白的胃腺癌少见特殊亚型,具有特殊的病理学形态及免疫表型。与普通型胃腺癌相比,侵袭性更强,预后更差。
【关键词】胃腺癌;肠母细胞分化;临床病理分析
Clinicopathological Analysis of Gastric Adenocarcinoma with Enterblastc Differentiation/JIANG Zhangying,CHU Shuqiang,CHEN Weishan,HUANG Zhongxin.//Chinese and Foreign Medical Research,2024,22(9):68-71
[Abstract]Objective:To investigate the clinicopathological features,immunophenotype,diagnosis and differential diagnosis of gastric adenocarcinoma with enteroblastic differentiation(GAED).Method:The clinical data of 10 patients with GAED admitted to Fuzhou Hospital of Traditional Chinese Medicine,the Second Affiliated Hospital of Fujian Medical University and the First Hospital of Quanzhou City from January 2016 to October 2022 were retrospectively analyzed,and the histopathologic and immunohistochemical results were observed.Result:Among the 10 patients with GAED,there were 8 cases of males and 2 cases of females.The mean age was 69.4 years.The main manifestations were abdominal pain,hematemesis and black stool.There were 6 cases occurred in the antrum,and 2 cases in the body of the stomach,and 2 cases in the cardia.The maximum tumor diameter was 2.5-8.0 cm,with an average of 5.1 cm.Under the microscope,the tumors were mainly tubular and papillary,and a few were sieve or solid sheet.The cytoplasm of the tumor cells was clear or weakly eosinophilic.Immunophenotype:tumor cells expressed SALL4(9/10),GPC3(6/10),AFP(4/10),CDX2(8/10),CD10(2/10),P53(8/10,mutant).HER2 gene test showed gene amplification in 2 cases(2/10).Conclusion:GAED is a rare and specific subtype of alpha-fetoprotein-producing gastric adenocarcinoma with special pathological morphology and immunophenotype.Compared with common gastric adenocarcinoma,it is more aggressive and has a worse prognosis.
[Keywords]Gastric adenocarcinoma Enteroblastic differentiation Clinicopathological analysis
First-author's address:Fuzhou Hospital of Traditional Chinese Medicine,Fuzhou 350001,China
伴肠母细胞分化的胃腺癌(GAED)是一种产甲胎蛋白的胃腺癌特殊亚型,该肿瘤组织学形态类似于胚胎早期的胎儿肠样结构,癌细胞具有特征性的透明胞浆,因此又命名为胎儿肠样腺癌或胃透明细胞癌。1994年由Matsunou等[1]首次报道,2019年WHO胃肿瘤分类正式将GAED增加为胃腺癌的一种新亚型,ICD-0编码为3[2]。相比于普通型胃腺癌,GAED侵袭性更强,预后更差[3]。由于GAED少见,容易误诊为普通型胃腺癌、肝样腺癌等肿瘤,因此临床和病理医生需加强对GAED的认识。本文结合相关文献报道,探讨10例GAED的临床病理学特征、免疫表型、鉴别诊断等情况,以期提高对该肿瘤的认识,现报告如下。
1资料与方法
1.1一般资料
回顾性分析2016年1月—2022年10月福州市中医院、福建医科大学附属第二医院及泉州市第一医院收治的10例GAED患者的临床资料。纳入标准:病理诊断为GAED[2]。排除标准:合并其他部位肿瘤;妊娠期或哺乳期;临床依从性差,无法配合研究。本研究经福州市中医院医学伦理委员会批准。
1.2方法
收集并观察10个病例的临床资料、影像学图像及随访结果。全部标本经10%中性福尔马林固定,常规脱水、石蜡包埋、切片、HE染色,封片等过程。免疫组化染色采用EnVision法,DAB显色,苏木精复染。所选一抗包括肿瘤细胞增殖相关蛋白(Ki67)、婆罗双树样基因4(SALL4)、磷脂酰肌醇蛋白聚糖3(GPC3)、甲胎蛋白(AFP)、肝细胞石蜡抗原1(HepPar-1)、尾型同源盒转录因子2(CDX2)、肾胰岛素残基溶酶(CD10)、P53、人表皮生长因子受体2(HER2)、突触素(Syn)、神经细胞黏附因子(CD56)、嗜铬素A(CgA)、错配修复蛋白(MLH1、PMS2、MSH2、MSH6)抗体,所选抗体及试剂盒均为即用型,均购自福州迈新生物技术有限公司。HE切片及免疫组化片由两位消化病理专科医师复阅确认。EB病毒检测采用原位杂交检测RNA(EBER),试剂盒购自Leica公司。HER2免疫组化判读为2+或3+时,采用荧光原位杂交(FISH)进一步检测其基因状态,试剂购自美国雅培Vysis试剂盒。
2结果
2.1 GAED患者的临床特点
10例患者中男8例,女2例;年龄59~81岁,平均年龄69.4岁;主要表现为腹痛、呕血伴黑便。内镜检查胃部见明显占位,均考虑为恶性肿瘤;血清AFP 3例术前升高,2例术后恢复正常,1例术后未降低;均行根治性手术切除,其中4例术后行化疗,2例术后行化疗+靶向治疗;随访3~28个月,平均随访12.4个月,其中2例患者死亡,2例患者出现远处器官转移,其余患者无瘤生存,见表1。

2.2 GAED患者大体观
6例发生于胃窦,2例发生于胃体,2例发生于贲门。7例表现为溃疡型,见图1;3例为隆起型。肿瘤最大径2.5~8.0 cm,平均5.1 cm。肿瘤无包膜,界不清,切面灰白、灰黄、质中。

2.3 GAED患者肿瘤镜下观
肿瘤镜下形态基本相似,位于胃黏膜表面,无包膜,边界不清,呈浸润性生长。9例(90%)患者可见管状结构、8例(80%)可见乳头状区(图2),5例(50%)可见筛状区,4例(40%)可见实性片状结构。肿瘤细胞边界清晰,呈柱状或立方形,胞浆丰富透明或弱嗜酸性,细胞核呈圆形、卵圆形,核仁明显,核异型性明显,病理性核分裂象多见。10例(100%)间质可见明显的坏死。其中病例2、5、9混合普通型胃腺癌,病例6合并神经内分泌癌,病例8合并肝样腺癌。8例(80%)可见神经侵犯、9例(90%)可见脉管内癌栓,9例(90%)可见淋巴结转移。
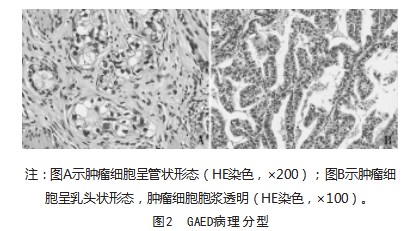
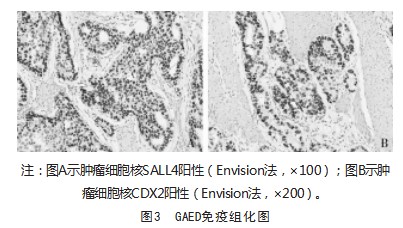
2.4 GAED患者肿瘤免疫表型
10例患者中9例肿瘤细胞表达SALL4(图3A),6例患者表达GPC3,4例患者表达AFP,1例患者表达HepPar-1(小灶弱阳性),8例患者表达CDX2(图3B),2例患者表达CD10,8例患者表达P53(突变型)。增殖指数(Ki67)60%~90%;而肿瘤细胞错配修复蛋白(MLH1、PMS2、MSH2、MSH6)均未缺失,EBER原位杂交均阴性。其中1例合并小细胞癌,表达Syn、CD56、CgA。
2.5 GAED患者肿瘤基因检测
HER2基因检测2例出现基因扩增。
3讨论
GAED由于缺乏大数量的病例报道和研究,其病因及发病机制目前尚不明确,有研究认为其可能是机体模拟胎儿胃肠上皮分化而形成的肿瘤[4]。该肿瘤较少见,其确切发病率尚不清楚,据新近一项涵盖2 273例胃腺癌的研究,发现有51例表现出胚胎性肠上皮分化特点,发病率为2.24%[5];国内赵宏颖等[6]研究报道其发病率为14%。因此,笔者推测GAED在日常工作中可能并不罕见,但由于缺乏充分认识常误诊为其他肿瘤,导致目前文献报道病例量相对较少。
3.1临床特点
经文献复习,GAED好发于中老年人,男性多见。常表现为腹痛、呕血、黑便等不适症状[7-8]。肿瘤常通过内镜检查发现,胃窦部病变多见,肿瘤最大径1.13~7.41 cm[5]。本组病例平均年龄69.4岁,8例为男性,其余临床特征与文献报道基本相符。需特别注意的是,GAED患者常伴有血AFP升高,但AFP升高并非诊断GAED的必要条件[9]。本组中3例出现血AFP升高,其中2例术后降至正常,与大多数文献报道情况一致。但另1例患者术后血AFP持续处于高值,而该病例手术切缘阳性。Yamabuki等[10]研究认为GAED术后血AFP未降低可能与患者体内肿瘤残留相关。因此,GAED患者术后有必要常规监测血AFP,可在一定程度上反映体内是否有肿瘤残留。
3.2组织学特点
GAED大体类似于普通型胃腺癌,常表现为溃疡型。镜下大多数呈管状、乳头状,少数呈筛状、梁状或实性结构,肿瘤细胞呈立方形或高柱状,具有特征性的透明胞浆,胞浆内富含糖原,部分肿瘤细胞胞浆呈轻度嗜酸性,胞浆内可见嗜酸性小体,形态学类似于“胚胎性肠上皮”。间质可见明显出血坏死。肿瘤病灶中常合并普通型腺癌、肝样腺癌或卵黄囊样分化的肿瘤。本组病例组织学形态与文献报道基本一致。其中1例合并神经内分泌癌,该病例病理分期为pT3N1M0,术后随访3个月未见复发及转移。目前文献GAED合并神经内分泌癌罕见报道,仅李解珍等[11]报道2例,其病理分期分别为pT4aN3aM0、pT3N1M0,术后随访9个月余未见复发及转移。对于GAED合并其他肿瘤成分时,其生物学行为及临床预后等情况与单纯GAED是否差异目前尚不清楚,仍需更长时间的随访及大数量的研究报道。
3.3免疫表型及分子遗传学特点
GAED应同时具有胚胎性分化和肠型分化的免疫表型。胚胎性分化表现为癌细胞表达胚胎干细胞的标记物或某些胚胎性蛋白,如AFP、GPC3、SALL4等,GAED应至少表达三者之一[12]。肠型分化表现为癌细胞表达肠型上皮标记物,如CDX2、CD10等。本组10例患者的免疫表型均显示胚胎性分化和肠型分化,与文献报道一致[7-8]。目前GAED的分子研究尚处于探索阶段,有研究发现约70%的GAED具有TP53基因突变,20%~30%具有HER2基因扩增,突变率高于普通型腺癌[5]。
3.4鉴别诊断
3.4.1普通型胃腺癌该类肿瘤常呈管状、乳头状结构,组织学结构与GAED难以区分。但前者胞浆常为嗜酸性,通常不表达AFP、SALL4、GPC3等胚胎性蛋白标记物。而后者胞浆丰富透明,可表达胚胎性蛋白标记物。
3.4.2肝样腺癌肝样腺癌与GAED十分相似,常伴有血清AFP升高,且二者形态结构及免疫表型均有重叠。但肝样腺癌主要形成实性结构,癌细胞呈多角形,肝细胞样,胞浆丰富嗜酸;而GAED以管状、乳头状结构为主,癌细胞胞浆丰富透明。免疫表型方面,肝样腺癌不表达CDX2、CD10等肠上皮标记物,而GAED则相反。由于GAED常与肝样腺癌混合存在,二者在临床表现、免疫表型及分子病理学特征上具有相似性,因此有部分学者认为二者属于同一实体,肝样腺癌可能是GAED的实性亚型[13]。
3.4.3胃转移性肝细胞癌该肿瘤与GAED鉴别困难。二者均可伴有血清AFP升高,均可表达AFP和GPC3,尤其当GAED混合肝样腺癌时与胃转移性肝细胞癌更易混淆。免疫表型有助于区分二者,GAED通常表达SALL4及CDX2,不表达HepPar-1,而前者则反之。
3.5预后及治疗
相比于普通型胃腺癌,GAED侵袭性更强,患者预后更差[8]。Murakami等[9]回顾性研究28例GAED患者,发现90%患者出现脉管侵犯,远高于普通型胃腺癌(26%~45%);约31%患者出现肝脏转移,远高于普通型胃腺癌(6%)。这些患者随访30个月时已有15例死亡,中位生存期仅为29个月[9]。本组患者平均随访12个月,2例死亡,2例出现远处器官转移,9例出现淋巴结转移。治疗方面,GAED主要以根治性手术切除为主,术后辅以化疗或靶向治疗。近年来,有研究发现DNA甲基转移酶(DNMT)在肿瘤的发生发展中起着十分重要的作用,目前被认为是各种癌症的治疗靶点。而DNMT3A蛋白表达与GAED存在密切联系,因此DNMT3A可能也是治疗GAED的潜在靶点[14]。
参考文献
[1]MATSUNOU H,KONISHI F,JALAL R E,et al.Alpha-fetoprotein-producing gastric carcinoma with enteroblastic differentiation[J].Cancer,1994,73(3):534-540.
[2]WHO Classification of Tumours Editorial Board.WHO classification of tumors of the digestive system[M].Lyon:IARC Press,2019:85-95.
[3]CHEN Y G,QU H,JIAN M,et al.High level of serum AFP is an independent negative prognostic factor in gastric cancer[J].Int J Biol Markers,2015,30(4):387-393.
[4]MOTOYAMA T,AIZAWA K,WATANABE H,et al.Alpha-fetoprotein producing gastric carcinomas:a comparative study of three different subtypes[J].Acta Pathol Jpn,1993,43(3):654-661.
[5]AKAZAWA Y,SAITO T,HAYASHI T,et al.Next-generation sequencing analysis for gastric adenocarcinoma with enteroblastic differentiation:emphasis on the relationship with hepatoid adenocarcinoma[J].Hum Pathol,2018,78:79-88.
[6]赵宏颖,石中月,谷雨妹,等.伴肠母细胞分化的胃腺癌临床病理学及分子特征及c-myc在其表达的意义[J].诊断病理学杂志,2021,28(7):518-522.
[7]MATSUMOTO K,UEYAMA H,MATSUMOTO K,et al.Clinicopathological features of alpha-fetoprotein producing early gastric cancer with enteroblastic differentiation[J].World J Gastroenterol,2016,22(36):8203-8210.
[8]KURODA N,YORITA K.Clinicopathologic study of 10 cases of gastric adenocarcinoma with hepatoid or enteroblastic differentiation[J].Pol J Pathol,2018,69(2):128-135.
[9]MURAKAMI T,YAO T,MITOMI H,et al.Clinicopatgologic and immunohistochemical characteristics of gastric adenocarcinoma with enteroblastic differentiation:a study of 29 cases[J].Gastric Cancer,2016,19(2):498-507.
[10]YAMABUKI T,OMI M,YONEMORI A,et al.Gastrointestinal obstruction due to solitary lymph node recurrence of alpha-fetoprotein-producing gastric carcinoma with enteroblastic differentiation[J].Case Rep Gastroenterol,2014,8(1):1-6.
[11]李解珍,黄海建,陈小岩,等.伴肠母细胞分化的胃腺癌12例临床病理学分析[J].中华病理学杂志,2021,50(6):626-631.
[12]YATAGAI N,SAITO T,AKAZAWA Y,et al.Frequent loss of heterozygosity of SMAD4 locus and prognostic impacts of SMAD4 immunohistochemistry in gastric adenocarcinoma with enteroblastic differentiation[J].Hum Pathol,2019,88:18-26.
[13]KINJO T,TANIGUCHI H,KUSHIMA R,et al.Histologic and immunohistochemical analyses ofα-fetoprotein-producing cancer of the stomach[J].Am J Surg Pathol,2012,36(1):56-65.
[14]KATAOKA I,FUNATA S,NAGAHAMA K,et al.DNMT3A overexpression is associated with aggressive behavior and enteroblastic differentiation of gastric adenocarcinoma[J].Ann DiagnPathol,2020,44:151456.










