Hh信号通路分子TPX2对口腔鳞癌增殖的作用探讨论文
2024-06-24 11:20:48 来源: 作者:xieshijia
摘要:目的探讨与分析Hedgehog(Hh)信号通路分子TPX2对口腔鳞癌增殖的作用。方法选取2022年1月—2023年7月呼伦贝尔职业技术学院口腔教研室培养的6株CAL-27人口腔鳞癌细胞株为研究对象,将转染Lv-pc3.0 vector的3株CAL-27人口腔鳞癌细胞株作为对照组,将转染Lv-pc3.0-shTPX2的3株CAL-27人口腔鳞癌细胞株作为Lv-shTPX2组,对比两组CAL-27人口腔鳞癌细胞株细胞周期、细胞增殖与目的基因、蛋白表达情况。结果转染后24、48 h,Lv-shTPX2组的TPX
[摘要]目的探讨与分析Hedgehog(Hh)信号通路分子TPX2对口腔鳞癌增殖的作用。方法选取2022年1月—2023年7月呼伦贝尔职业技术学院口腔教研室培养的6株CAL-27人口腔鳞癌细胞株为研究对象,将转染Lv-pc3.0 vector的3株CAL-27人口腔鳞癌细胞株作为对照组,将转染Lv-pc3.0-shTPX2的3株CAL-27人口腔鳞癌细胞株作为Lv-shTPX2组,对比两组CAL-27人口腔鳞癌细胞株细胞周期、细胞增殖与目的基因、蛋白表达情况。结果转染后24、48 h,Lv-shTPX2组的TPX2 mRNA[(5.44±0.17)、(5.18±0.47)]与蛋白相对表达水平[(2.01±0.23)、(1.33±0.16)]低于对照组的TPX2 mRNA[(24.59±0.33)、(24.58±2.76)]与蛋白相对表达水平[(10.47±0.16)、(7.48±0.33)],差异有统计学意义(t=89.352,12.002,52.299,29.045,P均<0.05);Lv-shTPX2组的细胞增殖指数更低,差异有统计学意义(P<0.05)。转染48 h后,Lv-shTPX2组的G2+M期细胞相对比例高于对照组,S期细胞相对比例低于对照组,GLI2、FOXM1蛋白相对表达水平低于对照组,差异有统计学意义(P均<0.05)。结论抑制Hh信号通路分子TPX2的表达可抑制口腔鳞癌细胞增殖,也可抑制GLI2、FOXM1蛋白表达,还可调节细胞周期状况,可为治疗口腔鳞状细胞癌提供新的途径。
[关键词]Hh信号通路;TPX2;口腔鳞癌;细胞增殖;细胞周期;FOXM1
Exploration of the Role of Hh Signaling Pathway Molecule TPX2 on the Proliferation of Oral Squamous Carcinoma
ZHANG Hongrui,SU Benxiang,PANG Yan,SUN Yueru
Oral Teaching and Research Department,Hulunbeier Vocational Technical College,Hulunbeier,Inner Mongolia Au⁃tonomous Region,021000 China
[Abstract]Objective To explore and analyze the role of Hedgehog(Hh)signaling pathway molecule TPX2 on the pro⁃liferation of oral squamous carcinoma.Methods Six lines of human oral squamous carcinoma cell line CAL-27 cul⁃tured in the Oral Teaching and Research Department of Hulunbeier Vocational Technical College from January 2022 to July 2023 were selected as the study objects.Three lines of human oral squamous carcinoma cell line CAL-27 transfected with Lv-pc3.0 vector were set as the control group.Three lines of human oral squamous carcinoma cell line CAL-27 transfected with Lv-pc3.0-shTPX2 were set as the Lv-shTPX2 group.Cell cycle,cell proliferation with target gene and protein expression between the two groups of human oral squamous carcinoma cell line CAL-27 were com⁃pared.Results At 24 h,48h after transfection,the levels of TPX2 mRNA[(5.44±0.17),(5.18±0.47)]and protein rela⁃tive expression[(2.01±0.23),(1.33±0.16)]in the Lv-shTPX2 group were lower than those in the control group with the levels of TPX2 mRNA[(24.59±0.33),(24.58±2.76)],and protein relative expression[(10.47±0.16),(7.48±0.33)],the differences were statistically significant(t=89.352,12.002,52.299,29.045,all P<0.05).And the cell proliferation in⁃dex was lower in the Lv-shTPX2 group,the difference was statistically significant(P<0.05).After 48 h of transfection,the relative proportion of G2+M-phase cell in the Lv-shTPX2 group was higher than that in the control group,the rela⁃tive proportion of S-phase cells was lower than that in the control group,and the relative expression levels of GLI2 and FOXM1 proteins were lower than those of the control group,the differences were statistically significant(all P<0.05).Conclusion Inhibition of the expression of Hh signaling pathway molecule TPX2 can inhibit the proliferation of oral squamous cell carcinoma cells,and also inhibit the expression of GLI2 and FOXM1 proteins,as well as regulate the cell cycle status,which may provide a new way for the treatment of oral squamous cell carcinoma.
[Key words]Hh signaling pathway;TPX2;Oral squamous carcinoma;Cell proliferation;Cell cycle;FOXM1
口腔癌是发生于口腔黏膜的恶性肿瘤,主要包括唇颊黏膜、舌前2/3、硬腭、牙龈以及口底等部位,其中病理类型以鳞癌最常见。印度、东南亚为口腔癌的高发区,男性发病率约为女性的2倍[1]。目前口腔鳞癌的治疗方案多为以手术为主的放化疗等综合治疗,但是很难持续改善患者的预后,并且大多数进展期患者在治疗后仍然复发[2]。因此需要识别促进口腔鳞癌增殖的分子,从而研制有效的靶向治疗药物治疗口腔鳞癌,降低疾病的复发率和病死率[3]。口腔鳞癌发生的分子机制仍然不清楚,有研究表明叉头盒M1(Forkhead Box Protein M1,FOXM1)是癌胚转录因子及细胞周期的调节因子,靶向Xklp2靶蛋白(Targeting Protein for Xenopus Kinesin-like Protein 2,TPX2)是有丝分裂的关键癌基因,但是如何促进口腔鳞癌发生与发展仍不明确[4-5]。本研究选取2022年1月—2023年7月呼伦贝尔职业技术学院口腔教研室培养的6株CAL-27人口腔鳞癌细胞株为研究对象,旨在探讨与分析Hedgehog(Hh)信号通路分子TPX2对口腔鳞癌增殖的作用,以明确TPX2的作用机制。现报道如下。
1材料与方法
1.1材料与试剂
CAL-27人口腔鳞癌细胞株(美国ATCC);DMEM培养基(美国Gibco);GANT61及cyclopamine(美国Sigma-Aldrich);Puromycin(北京Solarbio);转染试剂lipofectamine 2000 transfection reagent和总RNA提取试剂(美国Thermo Fisher Scientific);DMEM细胞培养基(美国Gibco);FOXM1抗体、TPX2抗体(英国Abcam)。
1.2方法
1.2.1 TPX2 shRNA获取及RT-qPCR Genbank数据库确定人TPX2的基因序列,针对TPX2的基因序列设计1条shRNA,shTPX2序列:5'-AGCCAAGTTG-TGCAATGTTC-3',由苏州吉玛基因公司设计合成。采用TRIzol法提取试剂盒对细胞总RNA进行提取,RNA的纯度和浓度的测定应用紫外分光光度计,取2µl RNA,在反转录酶作用下合成cDNA,再取2µl反转录产物PCR扩增,以磷酸甘油醛脱氢酶(Glyc⁃eraldehyde 3-Phosphate Dehydrogenase,GAPDH)为内参照,PCR反应条件:①95℃5 min,②95℃30 s,③60℃30 s,④72℃30 s,⑤72℃5 min;其中②、③、④为40个循环。
1.2.2细胞分组与转染把CAL-27细胞随机分为两组:对照组与Lv-shTPX2组。取对数生长期细胞,待细胞融合度达到70.0%~80.0%后,对照组与Lv-shTPX2组分别用lipofectamine 2000细胞转染试剂转染Lv-pc3.0 vector与Lv-pc3.0-shTPX2,转染终浓度为10 nmol/L,转染后12 h更换培养液。
1.2.3细胞增殖将转染后培养48 h的细胞消化离心,显微镜下计数,以细胞5 000个/孔的密度接种于96孔板,24 h后培养基中加入50µmol/L Edu再孵育1~4 h,每次实验每孔重复3次,只显示1个有代表性的区域。
1.2.4流式细胞仪分析细胞周期将细胞消化、传代、培养24 h后换液,继续培养至72 h,0.25%胰酶消化成单细胞悬液,磷酸缓冲生理盐水(Phosphate Buffer Saline,PBS)洗涤2次,1 000 r/min离心5 min,弃去上清,缓慢加入-20℃预冷的75%乙醇,4℃保存,取细胞悬液,PBS洗涤,2 000 r/min离心5 min后,弃去上清液,碘化丙啶(Propidium Iodide,PI)染液1 mL,染30 min,每样本收集10 000个荧光信号,得出各期细胞数占细胞总数的百分率,每组重复3次。
1.2.5蛋白印迹法检测目的蛋白的表达培养细胞经预冷的PBS漂洗2次,吸净PBS,加入预冷的裂解液置于冰上。将研磨液置于离心管中震荡,间断吹打,共约30 min,反复吹打,超声破碎,置于4℃离心机中,以13 000 r/min的转速离心15 min,取上清液置于新的EP管中,加入蛋白上样缓冲液,反复吹打,利用BCA法定量蛋白,制备10%SDS-PAGE凝胶,上样,转膜,5%牛奶在室温孵育2 h,TBST洗3次,10 min/次,单克隆抗体GLI2、FOXM1以及TPX2(1∶3 000),GAPDH(1∶5 000),在4℃摇床过夜,TBST洗3次,10 min/次。二抗孵育:膜与相应的二抗在室温下孵育2 h。显色剂混合,滴于膜上。
1.3观察指标
比较两组细胞的TPX2表达水平、细胞增殖指数、细胞周期(G1期、S2期、G+M期)相对比例、目的蛋白(GLI2、FOXM1)相对表达水平。
1.4统计方法
使用SPSS 24.0统计学软件进行数据分析。符合正态分布的计量资料(TPX2表达水平、细胞增殖指数、细胞周期相对比例、目的蛋白相对表达水平)用(±s)表示,行t检验。P<0.05为差异有统计学意义。
2结果
2.1两组细胞TPX2表达水平对比
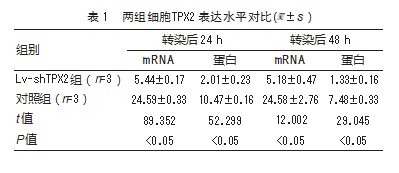
转染后24、48 h,Lv-shTPX2组的TPX2 mRNA与蛋白相对表达水平低于对照组,差异有统计学意义(P均<0.05)。见表1。
2.2两组细胞增殖指数对比
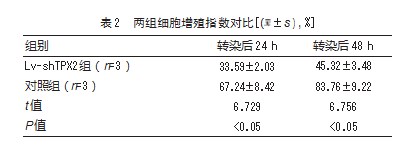
转染后24、48 h,Lv-shTPX2组的细胞增殖指数低于对照组,差异有统计学意义(P均<0.05)。见表2。
2.3两组细胞周期相对比例对比
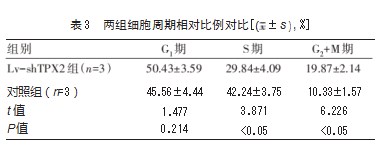
转染48 h后,Lv-shTPX2组的G2+M期细胞相对比例高于对照组,S期细胞相对比例低于对照组,差异有统计学意义(P均<0.05)。见表3。
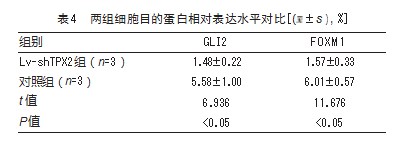
2.4两组细胞目的蛋白相对表达水平对比
转染48 h后,Lv-shTPX2组的GLI2、FOXM1蛋白相对含量低于对照组,差异有统计学意义(P均<0.05)。见表4。
3讨论
口腔鳞癌是头颈部最常见的恶性肿瘤之一,80.0%发生于口腔黏膜的癌症为鳞癌[5]。口腔鳞癌患者的预后比较差,5年生存率不到50.0%[6-7],肿瘤转移和放化疗耐受是口腔鳞癌致死的主要原因,为此需要为治疗口腔鳞癌寻找一条新的途径。有研究证实口腔鳞癌中Hh信号通路处于异常激活状态,但Hh信号通路如何调节肿瘤生长需要进一步研究[8]。同时目前有多种靶向抑制Hh通路的药物,主要为环靶明,但研究报道肿瘤细胞对环靶明产生耐药,因此需要进一步研究Hh信号通路下游分子,寻找直接导致口腔鳞癌细胞增殖和生长的原因,从而针对性研制出靶向治疗药物[9]。
TPX2是一种在多种肿瘤中呈高表达的癌基因,可促进有丝分裂纺锤体的形成,在细胞分裂及肿瘤的形成中也发挥有重要的作用,然而TPX2的表达调节机制仍不清楚[10]。本研究结果显示,转染后24、48 h,Lv-shTPX2组的TPX2 mRNA[(5.44±0.17)、(5.18±0.47)]与蛋白相对表达水平[(2.01±0.23)、(1.33±0.16)]低于对照组的TPX2 mRNA[(24.59±0.33)、(24.58±2.76)]与蛋白相对表达水平[(10.47±0.16)、(7.48±0.33)](P均<0.05);在尹颂豪等[11]的相关研究中显示,在转染TPX2-siRNA后,TPX2 mRNA在48 h后表达下调(F=224.8,P<0.001);TPX2蛋白质在72 h后表达下调(F=10.69,P=0.022)。Lv-shTPX2组的细胞增殖指数低于对照组(P<0.05),表明抑制Hh信号通路分子TPX2的表达可抑制口腔鳞癌细胞增殖。当前也有研究显示,TPX2持续高表达后,Edu染色、细胞增殖曲线及克隆形成实验证实口腔鳞癌细胞生长加速,sonic hedgehog(Shh)信号通路通过TPX2促进口腔鳞癌细胞增殖[12]。
在口腔鳞癌所有异常调节的信号通路中,Hh信号通路对肿瘤的增殖有重要的作用,TPX2是Hh信号通路的下游的靶基因[8]。GLI是重要的转录因子,调控Hh信号由胞质到胞核中,敲除GLI,TPX2的表达下降,GLI异常激活,TPX2的表达升高。激活Hh配体,Shh、TPX2表达亦升高[13]。FOXM1在高度分化和未分化的组织细胞中没有表达,而在增殖的上皮细胞和间充质细胞表现出高度活性,加速细胞周期进程,在正常组织受到损伤后,FOXM1的表达直接参与损伤后修复,为此异常激活的FOXM1作为癌基因而促进癌症的发生发展[14]。本研究结果显示,转染48 h后,Lv-shTPX2组的G2+M期细胞相对比例高于对照组,S期细胞相对比例低于对照组,Lv-shTPX2组的GLI2、FOXM1蛋白相对含量更低,(P均<0.05),表明抑制Hh信号通路分子TPX2的表达可抑制GLI2、FOXM1蛋白表达,还可调节细胞周期状况。
综上所述,抑制Hh信号通路分子TPX2的表达可抑制口腔鳞癌细胞增殖,也可抑制GLI2、FOXM1蛋白表达,还可调节细胞周期状况,可为治疗口腔鳞状细胞癌提供新的途径。
[参考文献]
[1]武艳飞,杨卫平,邵莉.沉默SNAI1对口腔鳞状细胞癌细胞生物活性的影响[J].中国现代医生,2023,61(10):40-44.
[2]李亚萍,谢春,谌东明,等.lncRNA CASC9通过调节miR-125a-3p/VEGF对口腔鳞癌CAL-27细胞增殖、迁移和侵袭的影响[J].实用口腔医学杂志,2023,39(2):166-172.
[3]史乃旭,郝苗,张天夫,等.黄芩素对人舌鳞状细胞癌CAL27细胞增殖的抑制作用及其机制[J].吉林大学学报:医学版,2023,49(4):985-993.
[4]苟秋童,谢强,靳文珂,等.口腔鳞癌中预后相关miRNA的生物信息学分析及实验验证[J].现代肿瘤医学,2023,31(16):2988-2995.
[5]崔颀,江瑾,周娟,等.阿霉素联合维替泊芬通过调节YAP蛋白对人口腔鳞癌HSC-4细胞增殖和周期的作用[J].中国老年学杂志,2023,43(17):4261-4264.
[6]黎凯歌,葛化冰,李博,等.Dickkopf-1基因在头颈部鳞状细胞癌中的表达及对细胞系表型变化的影响[J].北京口腔医学,2023,31(4):235-240.
[7]徐培,王佳,陶冶,等.miR-1271-5p靶向F13A1基因对口腔鳞状细胞癌的调控作用[J].赤峰学院学报:自然科学版,2023,39(7):24-28.
[8]张慧琳,乐曼妮,黄子璇,等.肿瘤干细胞相关信号通路在口腔鳞癌中的研究进展[J].临床口腔医学杂志,2023,39(9):573-575.
[9]汪诗雯,余程,马净植.HnRNP A1-CDK2调控口腔鳞状细胞癌的发生发展[J].临床口腔医学杂志,2023,39(8):456-459.
[10]张湘豫,胡溢洪,韩语诚,等.1-磷酸神经酰胺转运蛋白对人口腔鳞状细胞癌HSC-3细胞生物学行为的影响[J].吉林大学学报:医学版,2023,49(4):875-883.
[11]尹颂豪,郭伟洪.TPX2在舌鳞状细胞癌组织中的表达及其对Cal27细胞增殖和凋亡的影响[J].口腔疾病防治,2018,26(1):31-37.
[12]张伟,叶璞,林旭阳,等.TEAD2在口腔鳞癌中的表达及其对细胞生物学行为的影响[J].口腔生物医学,2022,13(2):96-101.
[13]尹江,唐平,张慧,等.HCG22靶向miR-17-3p对口腔鳞癌细胞生物学行为的影响[J].临床肿瘤学杂志,2023,28(8):693-699.
[14]陈赫,崔子峰,靳琳玉,等.NORAD在口腔鳞状细胞癌组织、癌旁组织及口腔鳞癌细胞系中的表达及作用机制[J].临床和实验医学杂志,2023,22(13):1360-1363.










