DC-CIK细胞过继免疫治疗联合XELOX方案化疗对进展期结直肠癌患者的疗效研究论文
2024-06-24 11:10:27 来源: 作者:xieshijia
摘要:目的探讨对进展期结直肠癌患者采用树突状细胞诱导的杀伤细胞(Dendritic Cell-cytokine-induced Killer,DC-CIK)过继免疫治疗+XELOX方案化疗的临床效果。方法选取苏州明基医院于2019年2月—2022年3月收治的98例进展期结直肠癌患者为研究对象,依据投掷硬币法分为两组,各49例。参照组采取单纯化疗方法,研究组采取DC-CIK细胞过继免疫治疗+XELOX方案化疗,对比两组的治疗结果。结果治疗后,研究组疾病缓解率(63.27%)、疾病控制率(75.51%)优于参照组的
[摘要]目的探讨对进展期结直肠癌患者采用树突状细胞诱导的杀伤细胞(Dendritic Cell-cytokine-induced Killer,DC-CIK)过继免疫治疗+XELOX方案化疗的临床效果。方法选取苏州明基医院于2019年2月—2022年3月收治的98例进展期结直肠癌患者为研究对象,依据投掷硬币法分为两组,各49例。参照组采取单纯化疗方法,研究组采取DC-CIK细胞过继免疫治疗+XELOX方案化疗,对比两组的治疗结果。结果治疗后,研究组疾病缓解率(63.27%)、疾病控制率(75.51%)优于参照组的40.82%、55.10%,差异有统计学意义(χ2=4.947、4.503,P均<0.05);治疗后,研究组自然杀伤细胞、CD3+、CD4+水平高于参照组,CD8+水平低于参照组,差异有统计学意义(P均<0.05);治疗后,研究组白细胞介素-2、肿瘤坏死因子-α以及干扰素-γ水平高于参照组,差异有统计学意义(P均<0.05)。结论对进展期结直肠癌患者采用DC-CIK细胞过继免疫治疗+XELOX方案化疗可获得明显的综合效果。
[关键词]DC-CIK细胞过继免疫;XELOX方案化疗;进展期结直肠癌
Effect of Adoptive Immunotherapy with DC-CIK Cells Combined with XELOX Chemotherapy on Patients with Advanced Colorectal Cancer
ZHANG Jing,YANG Guang
Department of Oncology,Suzhou Benq Hospital,Suzhou,Jiangsu Province,215004 China
[Abstract]Objective To explore the clinical effect of adoptive immunotherapy of dendritic cell-induced killer(DC-CIK)cells and chemotherapy with XELOX regimen in patients with advanced colorectal cancer.Methods A total of 98 patients with advanced colorectal cancer admitted to Suzhou Benq Hospital from February 2019 to March 2022 were selected as the research objects.According to the coin tossing method,they were divided into two groups,49 cases in each group.The reference group was treated with chemotherapy alone,and the study group was treated with DC-CIK cell adoptive immunotherapy+XELOX regimen chemotherapy.The treatment results of the two groups were compared.Results After treatment,the disease remission rate(63.27%)and disease control rate(75.51%)in the study group were better than those in the reference group(40.82%and 55.10%,respectively),and the differences were sta‐tistically significant(χ2=4.947,4.503,both P<0.05).After treatment,the levels of natural killer cell,CD3+and CD4+in the study group were higher than those in the reference group,and the level of CD8+was lower than that in the refer‐ence group,and the differences were statistically significant(all P<0.05).After treatment,the levels of interleukin-2 and tumour necrosis factor-αand interferon-γin the study group were higher than those in the reference group,and the differences were statistically significant(all P<0.05).Conclusion After adopting DC-CIK cell adoptive immuno‐therapy plus XELOX chemotherapy for advanced colorectal cancer patients,the comprehensive effect is obvious.
[Key words]DC-CIK cell adoptive immunity;XELOX regimen chemotherapy;Advanced colorectal cancer
结直肠癌作为常见病的一种,确诊后多发展至疾病进展期,导致手术时机丧失,因此,对其确定有效诊疗方法并展开对应治疗意义显著[1-3]。临床上,化疗已获得广泛应用,在降低肿瘤负荷方面已取得明显效果。但化疗除可有效杀灭肿瘤细胞外,也会使正常细胞受到一定程度的损伤,因此患者表现出的不良反应现象极为明显。近年来,伴随医学的快速发展,树突状细胞诱导的杀伤细胞(Den‐dritic Cell-cytokine-induced Killer,DC-CIK)过继免疫治疗的应用范围明显增加,其对于机体内肿瘤细胞可以获得显著杀伤效果[4-7]。本研究选取苏州明基医院于2019年2月—2022年3月收治的98例进展期结直肠癌患者展作为研究对象,旨在探讨对进展期结直肠癌患者采用DC-CIK细胞过继免疫治疗+XELOX方案化疗方法的临床效果。现报道如下。
1资料与方法
1.1一般资料
选取本院收治的98例进展期结直肠癌患者作为研究对象,依据投掷硬币法分为两组,各49例。参照组中,男29例,女20例;年龄23~70岁,平均(52.62±5.19)岁;病程5个月~2年,平均(1.02±0.23)年。研究组中,男28例,女21例;年龄24~72岁,平均(52.65±5.22)岁;病程6个月~2年,平均(1.03±0.25)年。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究已获得医院医学伦理委员会批准,患者以及家属均知情同意。
1.2纳入与排除标准
纳入标准:①患者可以积极配合病理检查,并且获得有效确诊;②患者接受治疗的时间>2个周期;③患者心脏、肾脏以及肝脏等脏器功能均正常;④患者体力状况评分为1~2分。
排除标准:①伴有心脏、肾脏以及肝脏等系列原发性疾病者;②处于妊娠期以及哺乳期者;③伴有其他肿瘤疾病或者相关免疫性疾病者;④存在激素药物服用史以及免疫抑制剂应用史者;⑤伴有全身感染或者肺炎情况者。
1.3方法
1.3.1参照组采用奥沙利铂+卡培他滨(XELOX方案)展开化疗治疗。奥沙利铂(国药准字H20103184;规格:50 mg)第1天的用药剂量为130 mg/m2;卡培他滨(国药准字H20233900;规格:0.5 g)的用药剂量为1 250 mg/m2,第1~12天;1个周期时间为21 d,共6个周期。
1.3.2研究组在参照组基础上,采用DC-CIK细胞过继免疫方法完成疾病治疗。化疗工作具体开展前,收集外周血,剂量为50 mL,有效分离具体的单核细胞,在实验室合理培养DC-CIK细胞。在完成采血工作后第3天,采用与参照组相同的方案严格开展化疗工作。对患者的细胞培养周期加以控制,时间为15 d。认真检测上清液,观察具体情况,如是否出现真菌及细菌生长的情况,合理开展免疫功能细胞培养物测定工作。获得准确结果后,采用无菌生理盐水进行细胞洗涤。在无菌生理盐水(每100 mL含2%白蛋白)中将细胞溶入,患者输注2次,频率为1次/月。
1.4观察指标
两组疾病缓解率、疾病控制率比较。完全缓解:患者病灶全部消失,持续时间为4周;部分缓解:患者病灶最长径之和减少>30%,持续时间为4周;疾病进展:患者病灶最长径之和增大>20%,持续时间为4周;疾病稳定:其判定结果处于部分缓解与疾病进展范围内。疾病缓解率=(完全缓解例数+部分缓解例数)/总例数×100%;疾病控制率=(完全缓解例数+部分缓解例数+疾病稳定例数)/总例数×100%。
两组T淋巴细胞亚群水平比较。主要包括自然杀伤细胞(Natural Killer Cell,NK)、自然杀伤T细胞(Natural Killer T Cell,NKT)、CD3+、CD4+以及CD8+。
两组血清肿瘤标志物水平比较。主要包括糖类抗原199(Carbohydrate Antigen 199,CA199)、糖类抗原242(Carbohydrate Antigen 242,CA242)、癌胚抗原(Carcinoembryonic Antigen,CEA)。
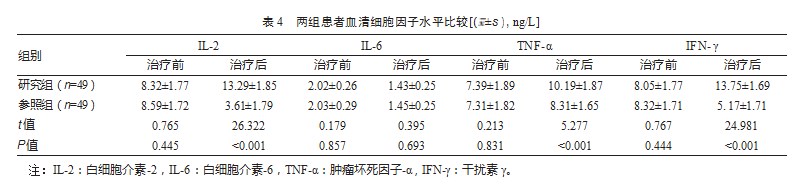
两组血清细胞因子水平比较。主要包括白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-2(In‐terleukin-2,IL-2)、肿瘤坏死因子-α(Tumor Necro‐sis Factor-α,TNF-α)以及干扰素γ(Interferon-γ,IFN-γ)。
1.5统计方法
采用SPSS 23.0统计学软件进行分析。疾病缓解率、疾病控制率为计数资料,以例数(n)和率(%)表示,行χ2检验。T淋巴细胞亚群水平、血清肿瘤标志物水平、血清细胞因子水平为计量资料,且符合正态分布,以(±s)表示,行t检验。P<0.05为差异有统计学意义。
2结果
2.1两组患者疾病缓解率、疾病控制率比较
研究组疾病缓解率为63.27%,高于参照组的40.82%;研究组疾病控制率为75.51%,高于参照组的55.10%,两组疾病缓解率与疾病控制率对比,差异有统计学意义(P均<0.05)。见表1。
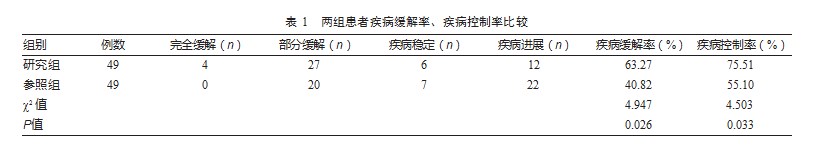
2.2两组患者T淋巴细胞亚群水平比较
治疗前,两组血清NK、NKT、CD3+、CD4+以及CD8+水平对比,差异无统计学意义(P均>0.05)。治疗后,研究组血清NKT、CD3+、CD4+水平均高于参照组,研究组血清CD8+水平低于参照组,差异有统计学意义(P均<0.05);治疗后,两组血清NK水平对比,差异无统计学意义(P>0.05)。见表2。
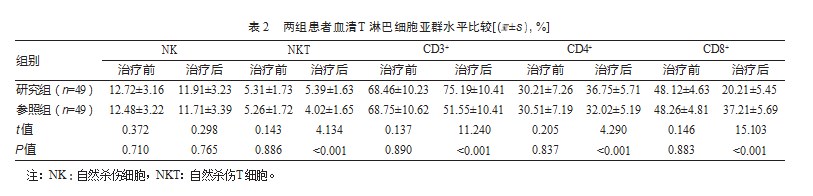
2.3两组患者血清肿瘤标志物水平比较
治疗前与治疗后,研究组与参照组血清CA199、CA242、CEA水平对比,差异无统计学意义(P均>0.05)。见表3。
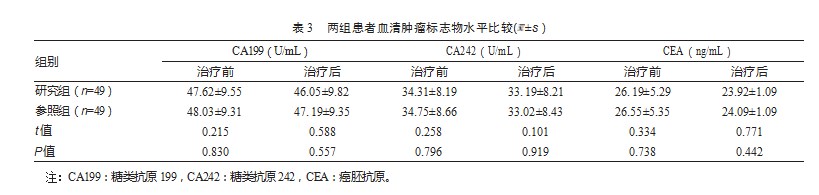
2.4两组患者血清细胞因子水平比较
治疗前,两组血清IL-2、IL-6、TNF-α以及IFN-γ水平对比,差异无统计学意义(P均>0.05);治疗后,两组血清IL-6水平对比,差异无统计学意义(P>0.05);研究组血清IL-2、TNF-α以及IFN-γ水平均高于参照组,差异有统计学意义(P均<0.05)。见表4。
3讨论
临床上,化疗已广泛应用于进展期结直肠癌患者。但化疗在获得显著效果同时,也会对正常细胞造成影响。DC-CIK细胞过继免疫治疗是通过将树突细胞(Dendritic Cell,DC)以及细胞因子诱导的杀伤细胞(Cytokine-induced Killer,CIK)进行充分结合,合理完成针对性治疗[8-9]。此种方法在激活机体内特异性肿瘤免疫应答方面效果极为明显,并且也可显著加强免疫应答,充分清除体内的残留病灶。除此之外,还能提升患者机体内免疫记忆,持续延长抗肿瘤效,作为一种全新治疗方法,表现出有效性及特异性显著的特点[10-12]。
本研究发现,治疗后,研究组血清NKT、CD3+、CD4+水平均高于参照组,CD8+水平低于参照组(P均<0.05);研究组血清IL-2、TNF-α及IFN-γ水平均高于参照组(P均<0.05);研究组疾病缓解率(63.27%)和疾病控制率(75.51%)高于参照组的40.82%、55.10%(P均<0.05,),与王村等[12]的研究结论一致,即治疗后,观察组NKT、CD3+、CD4+高于对照组,CD8+水平低于对照组(P均<0.05);观察组IL-2、TNF-α及IFN-γ水平均高于对照组(P均<0.05);观察组疾病缓解率(61.54%)、疾病控制率(75.00%)高于对照组的40.38%、55.77%(P均<0.05),从而表明DC-CIK细胞过继免疫治疗+XELOX方案化疗方法联合应用,对于免疫抑制的改善以及机体抗肿瘤免疫调整效果明显,进一步表明对进展期结直肠癌患者采用DC-CIK细胞过继免疫治疗+XELOX方案化疗方法治疗的价值所在。
综上所述,对进展期结直肠癌患者采用DC-CIK细胞过继免疫治疗+XELOX方案可获得明显的综合效果。
[参考文献]
[1]杨凯,胡燕,王洪健,等.进展期结直肠癌术中洛铂腹腔灌注化疗的临床疗效及安全性分析[J].海南医学,2021,32(14):1810-1813.
[2]吴曰清,刘莉,杨清波.新辅助化疗联合腹腔镜手术治疗进展期结直肠癌的临床效果[J].临床医学研究与实践,2021,6(33):52-54.
[3]王磊,沈社琴.新辅助化疗联合腹腔镜手术治疗进展期结直肠癌的效果和安全性观察[J].中外医学研究,2019,17(5):63-64.
[4]许汝鑫,崔艳芬,杨晓棠.基于增强CT门静脉期影像组学模型对局部进展期结直肠癌新辅助化疗疗效的预测研究[J].中华解剖与临床杂志,2022,27(7):449-457.
[5]张云飞,骆惠玉,朱虹玉,等.进展期结直肠癌患者化疗相关性腹泻发生状况及影响因素研究[J].中华护理教育,2022,19(5):462-467.
[6]关记飞,杨丽丽,李伦.贝伐珠单抗联合化疗治疗进展期结直肠癌的疗效观察[J].中国肛肠病杂志,2022,42(1):20-22.
[7]雷子颖,关天培,罗嘉莉,等.局部进展期结直肠癌原发肿瘤切除术后5~8周行腹腔热灌注化疗的合理性——基于COLOPEC研究的思考[J].中华胃肠外科杂志,2019,22(12):1115-1117.
[8]王青兵,王雁军,沈志玲,等.进展期结直肠癌术中雷替曲塞腹腔灌注化疗的安全性及临床价值[J].河南外科学杂志,2021,27(5):29-31.
[9]刘帛岩,李松岩,杨宇,等.进展期结直肠癌术后腹腔热灌注化疗对机体免疫功能的影响[J].解放军医学院学报,2019,40(5):412-416.
[10]谷俊杰,孙昭,赵林,等.α-平滑肌肌动蛋白表达在进展期结直肠癌化疗疗效预测及预后中的意义[J].中国医学科学院学报,2019,41(1):63-67.
[11]张月.研究卡培他滨联合奥沙利铂新辅助化疗治疗局部进展期结直肠癌的临床效果与安全性[J].世界最新医学信息文摘,2021,21(100):516-517.
[12]王村,温珍平,梁俊青.DC-CIK细胞过继免疫治疗联合XELOX方案化疗对进展期结直肠癌患者的疗效分析[J].癌症进展,2019,17(8):933-935,938.










