二甲双胍联合SGLT2抑制剂治疗PCOS合并T2DM 患者的研究进展论文
2024-05-28 14:27:32 来源: 作者:xuling
摘要:多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者常合并2型糖尿病(type 2 diabetes mellitus,T2DM),二者在病因及发病机制上相互联系及影响。二甲双胍是T2DM的基础用药,临床上也用于PCOS,但单用的治疗效果有限,联合其他药物成为治疗的重要选择。
【摘要】多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者常合并2型糖尿病(type 2 diabetes mellitus,T2DM),二者在病因及发病机制上相互联系及影响。二甲双胍是T2DM的基础用药,临床上也用于PCOS,但单用的治疗效果有限,联合其他药物成为治疗的重要选择。钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT-2)抑制剂作为一类有其独特的作用机制的药物,具有良好的治疗效果和广阔的应用范围。现在考虑二甲双胍联用SGLT2抑制剂治疗PCOS合并T2DM患者,本文对二甲双胍联用SGLT2抑制剂治疗PCOS合并T2DM患者的研究进展及作用机制进行综述。
【关键词】多囊卵巢综合征,2型糖尿病,二甲双胍,钠-葡萄糖协同转运蛋白2抑制剂
[Abstract]Polycystic ovary syndrome(PCOS)patients are often complicated by type 2 diabetes mellitus(T2DM),and the two are related and influence each other in etiology and pathogenesis.Metformin is the basic drug for T2DM and is also clinically used for PCOS.However,the therapeutic effect of Metformin alone is limited,and the combination with other drugs has become an important treatment choice.Sodium-glucose cotransporter 2(SGLT2)inhibitors,as a class of drugs with a unique mechanism of action,have a good therapeutic effect and abroad application range.Now,considering metformin combined with SGLT2 inhibitors in the treatment of PCOS combined with T2DM patients,this article reviews the research progress and mechanism of metformin combined with SGLT2 inhibitors in the treatment of PCOS combined with T2DM patients.
[Keywords]PCOS T2DM Metformin SGLT2 inhibitors
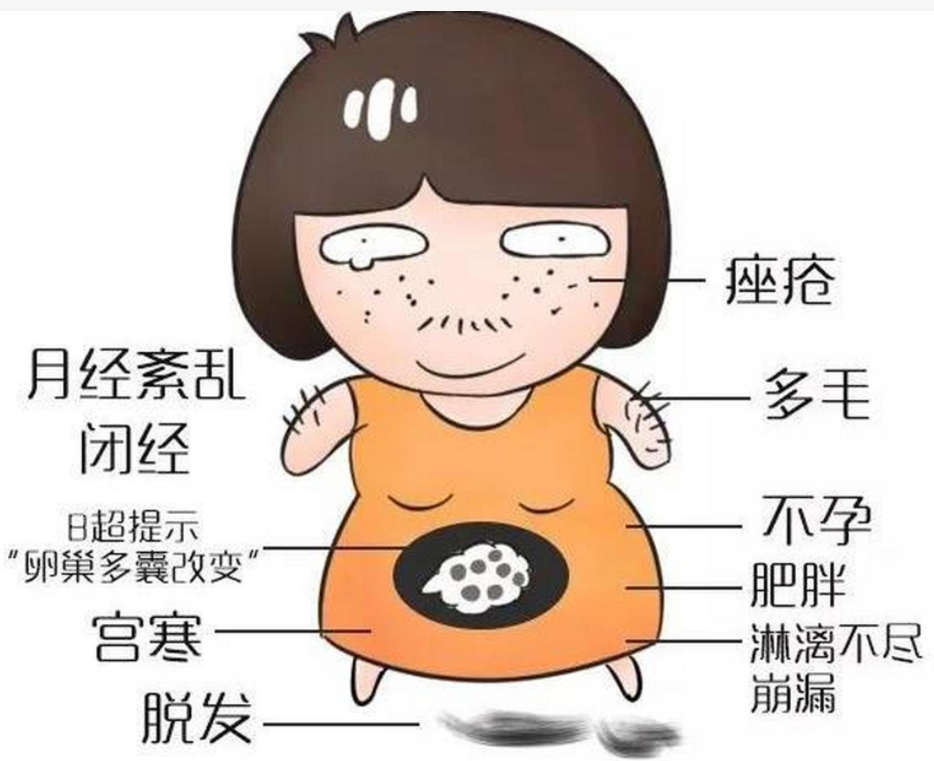
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是与生育、代谢及心理都密切相关的一种内分泌紊乱综合征,在育龄女性中的患病率可高达20%[1]。PCOS临床特征是高雄激素血症(hyperandrogenemia,HA)、高胰岛素血症(hyperinsulinemia,HI)、胰岛素抵抗(insulin resistance,IR)、月经紊乱、不孕等,还会增加其他代谢异常的风险,如2型糖尿病(type 2 diabetes mellitus,T2DM)、高血压、高血脂和心血管疾病等[2],这为育龄期的妇女带来巨大困扰和伤害。T2DM是一种全球性疾病,降低胰岛素敏感性,影响糖脂代谢,并与高尿酸血症、心血管疾病的风险相关,也严重危害患者生命健康。两种疾病在病因、发病机制及治疗等方面相互联系,现PCOS合并T2DM的发病率逐年升高,更多人投入到相关研究中。二甲双胍是临床治疗T2DM的常见降糖药,也可用于治疗PCOS,但单用的治疗效果并不理想,故需要考虑联合用药以进一步提高疗效。钠-葡萄糖协同转运蛋白2(sodium-glucose cotransporter 2,SGLT-2)抑制剂可以抑制肾脏对葡糖糖的重吸收,还具有减重、减脂、保护心肾、保护胰岛β细胞等作用。因此,本文将从两种疾病的病因和发病机制及药物的作用机制和临床疗效等方面进行阐述,探讨二甲双胍联合SGLT-2抑制剂治疗PCOS合并T2DM的有效性和安全性,从而提供理论依据。
1 PCOS与T2DM的病因及发病机制
1.1胰岛素抵抗(insulin resistance,IR)
IR是机体代偿性产生和分泌胰岛素,以此维持血糖的平衡,从而形成高胰岛素血症(hyperinsulinemia,HI)。IR是PCOS和T2DM的共同发病机制,研究表明IR在PCOS的糖尿病前期发生发展中起着重要作用,据报道在患有PCOS的女性中,30%~35%为糖耐量受损的女性,8%~10%患者被发现患有T2DM或者有糖尿病病史[3]。可能是由于机体产生胰岛素抵抗后,磷脂酰肌醇3-激酶/蛋白激酶B信号通路被抑制,减少葡萄糖转运蛋白4从胞内转到胞膜,外周组织减少对葡萄糖的摄取,从而使血糖升高[4]。另外,HI直接促进卵巢中雄激素产生和分泌,同时扰乱下丘脑-垂体-卵巢秩序,使黄体生成素分泌过多,还可以抑制肝脏合成肝脏性激素结合球蛋白,使游离睾酮升高,最终导致排卵障碍及不孕[5]。IR及HI使性激素水平异常,而性激素的紊乱进一步推动IR和代谢功能障碍,形成恶性循环。
1.2肥胖
研究表明PCOS与肥胖相关,约有50%的PCOS女性表现为超重或肥胖,肥胖会增加IR和代偿性HI,促进脂肪生成而降低脂肪分解,还会增加炎性脂肪因子,进而增加脂肪生成,形成了恶性循环[6]。考虑到IR,PCOS会有代谢综合征的风险,而肥胖会加剧这一风险,使糖耐量受损和T2DM的风险升高。另有研究表明,若患者体重过重,不仅使患T2DM的可能性增加,还会加重并发症,严重影响生活质量[7]。另外,脂肪细胞产生瘦素,高浓度的瘦素抑制颗粒细胞中芳香化酶mRNA的表达,从而中断雄激素向雌激素的转化,最终使雄激素水平升高[8]。HI在以月经过少和HA为特征的PCOS的发病机制中起着重要作用,伴随而来的肥胖进一步增加了IR,恶化了代谢和生殖结果。
1.3脂代谢异常
PCOS脂代谢异常的发生机制复杂多样,最为主要的影响因素为肥胖、高雄激素及IR。陈丽等[9]做回顾性分析发现有IR及肥胖的试验组的甘油三酯水平均较高,高密度脂蛋白胆固醇水平较低,PCOS患者患心血管疾病风险增加。涉及的具体机制可能为:(1)肥胖抑制脂蛋白酶,使高密度脂蛋白胆固醇降低,甘油三酯升高;(2)雄激素可加强儿茶酚胺作用,从而释放更多非酯化脂肪酸,使甘油三酯合成增多;(3)由于有IR,HI会抑制甘油三酯脂肪酶活性,促进脂肪动员,使内源性甘油三酯合成增多[10]。这些因素相互作用,因此临床上需更加重视IR改善、纠正糖脂及性激素代谢,从而提高患者的诊疗预后。
2二甲双胍治疗PCOS与T2DM
PCOS治疗原则是调整健康的生活方式、纠正代谢异常,抗雄激素治疗、调整月经周期及监测远期并发症。二甲双胍作为治疗糖尿病的基础用药,可减少肝脏葡萄糖的产生,刺激外周组织对葡萄糖的摄取,增强胰岛素敏感性,降低肝脏P450酶的活性,促进肝脏性激素结合球蛋白的合成,从而降低血糖和睾酮,对月经紊乱、排卵紊乱、代谢异常等有一定益处[11]。虽然人们对二甲双胍的期望很高,但其作用也有一定局限。有研究表明二甲双胍对PCOS患者的空腹血糖或胰岛素抵抗没有影响[12]。另一项评估降糖药物对T2DM患者体重和血压的影响的荟萃分析结果显示,二甲双胍的作用不大[13]。
其他降糖药,如噻唑烷二酮类药物可激活过氧化物酶体增殖活化受体γ,启动胰岛素信号系统,促进外周组织对葡萄糖的利用,还有抗动脉粥样硬化、抗组织纤维化等作用[14]。但会引起水钠潴留、血容量增加,导致体重增加和充血性心力衰竭等严重的不良反应,所以限制了其使用范围。另外,胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂也逐渐被人们所认识。GLP-1刺激胰岛β细胞分泌胰岛素,抑制胰高血糖素分泌,直接抑制食欲中枢增加饱腹感,GLP-1激动剂延长了GLP-1的作用效果,从而发挥降糖和减重的作用[15]。但随着剂量升高胃肠道不良反应会增加,其价格较贵,并且属于注射型药物,患者接受程度和依从性会相对较差,限制了临床应用。
可见单用二甲双胍的治疗效果有限,可考虑联用其他药物,但根据以上关于噻唑烷二酮类和GLP-1抑制剂的研究显示其仍具有局限性,因此联合应用SGLT-2抑制剂治疗PCOS与T2DM成为新的研究方向。
3 SGLT-2抑制剂治疗PCOS与T2DM
3.1降糖
SGLT-2主要位于肾脏近曲小管,几乎完全在近端小管的第一和第二段的上皮细胞的管腔膜中表达,是一种高容量共转运蛋白,依赖于基底膜中Na+-K+-ATP酶泵产生的钠梯度,以1∶1的钠-葡萄糖化学计量作用,介导大部分过滤后的葡萄糖的重吸收,SGLT-2抑制剂可抑制转运蛋白来阻止对葡萄糖的重吸收,促进尿液中葡萄糖的排泄,导致尿糖增加,血糖降低[16]。由于尿糖增加,为微生物的繁殖生长提供了“温床”,导致患者出现生殖道及尿道感染,但研究表明在女性中这种不良反应的发生率为10%,用药期间需多饮水避免出现感染[17]。另外,由于SGLT2抑制剂的作用机制不取决于胰岛素分泌,一旦过滤的葡萄糖负荷降至80 g/d,就会停止降低血糖水平,低血糖发生风险小[18]。这对患者来说更易接受。
3.2减重降脂
PCOS合并T2DM的患者多伴有超重或肥胖,减重不仅可以改善血糖,还可以延缓心肾并发症的发生发展。研究结果显示SGLT2抑制剂增加的尿糖排泄量相当于每天损失60~80 g葡萄糖,其减重效果通常在3 kg左右,并且在6~12个月趋于平稳[19]。一项针对PCOS患者的随机对照试验结果显示,SGLT2抑制剂组可更好地降低体重、体重指数和脂肪量。初始体重减轻归因于与葡萄糖排泄相关的热量损失(200~300 kcal/d),也归因于该药物的轻度利尿作用。但与SGLT2抑制剂治疗相关的稳态体重减轻可能是由脂肪损失引起的。在动物模型中,SGTL2抑制剂已被证明可通过增强脂解、脂肪酸氧化和脂肪组织褐变来降低体重和脂肪量[20]。
3.3心肾保护作用
患者代谢紊乱及血压改变,可能导致心肾功能不全,因此在关注降糖效果的同时也需要关注心肾获益的问题。有许多研究表明SGLT-2抑制剂能显著降低心力衰竭患者的住院率和死亡率[21],机制可能与被称为“超级燃料”的酮体β-羟丁酸有关,其可以为衰弱的心肌细胞提供能量,从而改善心脏功能,有研究显示T2DM患者服用恩格列净后空腹β-羟丁酸上升[22]。还可能由于通过抑制对葡萄糖和Na+重吸收,利钠排水,从而降低前负荷,同时抑制肾素-血管紧张素系统过度激活,进而延缓血管粥样硬化改变,降低血压,降低后负荷。糖尿病肾病是T2DM的主要慢性并发症之一,最终可导致肾功能衰竭,其发生机制复杂,可能与高糖毒性、脂肪毒性、高血压、肾小管-肾小球反馈改变、炎症和钠-氢交换活性增加等有关,最终导致肾小球滤过率下降,而SGLT2抑制剂能改善病理生理紊乱,从而减轻肾脏损害[23]。另外有研究表明,使用SGLT2抑制剂可以通过降低估算的肾小球滤过率(eGFR)的下降率和减少蛋白尿的发作或进展来提供肾脏保护,这在糖尿病患者和非糖尿病患者中都有发现,似乎与慢性肾脏病的分期、蛋白尿的程度、种族、年龄、性别、体重减轻或心血管疾病的存在无关[16]。SGLT-2抑制剂的心肾保护作用被许多研究结果所证明,如著名的卡格列净的CREDENCE试验显示,与对照组相比,卡格列净组的终末期肾病复合终点的相对风险降低了34%,心血管死亡、心肌梗死或中风的次要复合终点减少了20%[24]。
3.4胰岛β细胞保护作用
胰岛β细胞的数量减少和功能下降是疾病发生的重要生理病理机制之一,因此关于恢复胰岛β细胞的数量和功能研究越来越多。有研究表明SGLT2抑制剂可以促进胰岛β细胞再生,改善胰岛β细胞功能,这可能与以下途径相关,包括促进胰岛β细胞增殖、抑制炎症、凋亡、纤维化和去分化,还有激活内分泌前体细胞,并且促进其转化为β细胞。另外SGLT2抑制剂对胰岛β细胞的保护还可能与糖脂毒性的缓解、氧化应激减轻、体重下降、血压降低等间接作用有关[25]。
SGLT-2抑制剂具有降糖、降脂、减重、保护心肾、保护胰岛β细胞等作用,同时由于其不依赖胰岛素的特性,还具有发生低血糖风险比其他药物更低的优势。不论是针对单纯PCOS或T2DM患者,还是PCOS合并T2DM患者,二甲双胍联用SGLT-2抑制剂比单用二甲双胍具有更好的治疗效果。在国内有一项关于达格列净和二甲双胍联合治疗PCOS合并T2DM的研究,试验结果显示达格列净组与对照组相比,在减重、降糖降脂、改善HA及IR方面有更有优势,并且不会增加不良反应的发生[26]。
4小结与展望
PCOS合并T2DM的发病率逐年升高,关于疾病的发病机制和治疗方案的研究也越来越多。目前单用二甲双胍的效果并不理想,因此治疗PCOS与T2DM可以考虑联用其他降糖药物,加强改善胰岛素抵抗、纠正代谢紊乱的作用,保证治疗的有效性,SGLT-2抑制剂可降糖降脂、减轻体重、心肾受益、保护胰岛β细胞,同时发生低血糖风险小。目前国内外相关研究不多,研究也有一定局限性,未来需更多更大样本、多中心的前瞻性研究,进一步评估其安全性和有效性,从而为二甲双胍联用SGLT2抑制剂治疗PCOS合并T2DM患者的治疗提供一种新的依据。
参考文献
[1]JMARINKOVIC-RADOSEVIC J,CIGROVSKI B M,KRUEZI E,et al.Exploring new treatment options for polycystic ovary syndrome:review of a novel antidiabetic agent SGLT2 inhibitor[J].World J Diabetes,2021,12(7):932-938.
[2]SANCHEZ-GARRIDO M A,TENA-SEMPERE M.Metabolic dysfunction in polycystic ovary syndrome:pathogenic role of androgen excess and potential therapeutic strategies[J].Mol Metab,2020,35:100937.
[3]XU Y,QIAO J.Association of insulin resistance and elevated androgen levels with polycystic ovarian syndrome(PCOS):a review of literature[J].J Healthc Eng,2022,2022:9240569.
[4]刘菏婧,张楚楚,刘雪峰,等.基于PI3K/AKT通路研究针药结合治疗PCOS-IR大鼠的作用机制[J].时珍国医国药,2022,33(12):2852-2857.
[5]SADEGHI H M,ADELI I,CALINA D,et al.Polycystic ovary syndrome:a comprehensive review of pathogenesis,management,and drug repurposing[J].IntJ Mol Sci,2022,23(2):583.
[6]付振琳,鲜恩英,谢丽娟.肥胖型多囊卵巢综合症病因及治疗方法的研究进展[J].西藏医药,2022,43(6):151-152.
[7]CHOBOT A,GÓROWSKA-KOWOLIK K,SOKOŁOWSKA M,et al.Obesity and diabetes-not only a simple link between two epidemics[J/OL].Diabetes Metab Res Rev,2018,34(7):e3042.https://pubmed.ncbi.nlm.nih.gov/29931823/.
[8]ZENG X,XIE Y J,LIU Y T,et al.Polycystic ovarian syndrome:correlation between hyperandrogenism,insulin resistance and obesity[J].Clin Chim Acta,2020,502:214-221.
[9]陈丽,郝丽娟.多囊卵巢综合征患者腹型肥胖、高雄、胰岛素抵抗及脂代谢的相关性分析[J].医学信息,2022,35(12):113-117.
[10]曾宇,赵琳.多囊卵巢综合征糖、脂代谢异常的研究进展[J].大连医科大学学报,2022,44(3):263-268.
[11]XING C,ZHAO H,ZHANG J,et al.Effect of Metformin versus Metformin plus Liraglutide on gonadal and metabolic profiles in overweight patients with polycystic ovary syndrome[J].Front Endocrinol(Lausanne),2022,13:945609.
[12]GUAN Y,WANG D,BU H,et al.The Effect of Metformin on polycystic ovary syndrome in overweight women:a systematic review and meta-analysis of randomized controlled trials[J].Int J Endocrinol,2020,2020:5150684.
[13]TSAPAS A,KARAGIANNIS T,KAKOTRICHI P,et al.Comparative efficacy of glucose-lowering medications on body weight and blood pressure in patients with type 2 diabetes:a systematic review and network meta-analysis[J].Diabetes Obes Metab,2021,23(9):2116-2124.
[14]庄会艳.噻唑烷二酮类药物的药理作用研究[J].医学食疗与健康,2019(17):88.
[15]张江南,马旭丹,余舒婷,等.GLP-1/GIP双受体激动剂在2型糖尿病治疗中的应用研究进展[J].浙江医学,2022,44(20):2227-2231.
[16]BAILEY C J,DAY C,BELLARY S.Renal Protection with SGLT2 Inhibitors:effects in acute and chronic kidney disease[J].Curr Diab Rep,2022,22(1):39-52.
[17]COWIE M R,FISHER M.SGLT2 inhibitors:mechanisms of cardiovascular benefit beyond glycaemic control[J].Nat Rev Cardiol,2020,17(12):761-772.
[18]VALLON V,VERMA S.Effects of SGLT2 inhibitors on kidney and cardiovascular function[J].Annu Rev Physiol,2021,83:503-528.
[19]CAI X,YANG W,GAO X,et al.The association between the dosage of SGLT2 inhibitor and weight reduction in type 2 diabetes patients:a Meta-analysis[J].Obesity(Silver Spring),2018,26(1):70-80.
[20]JAVED Z,PAPAGEORGIOU M,DESHMUKH H,et al.Effects of Empagliflozin on metabolic parameters in polycystic ovary syndrome:a randomized controlled study[J].Clin Endocrinol(Oxf),2019,90(6):805-813.
[21]武锋超,蓝庆肃,马兰虎,等.SGLT2抑制剂治疗射血分数降低的心力衰竭的疗效和安全性的Meta分析[J].中国循证心血管医学杂志,2022,14(8):915-919,926.
[22]COSTANZO S,DE CURTIS A,DI CASTELNUOVO A,et al.Serum Vitamin D deficiency and risk of hospitalization for heart failure:prospective results from the Moli-Sani study[J].Nutr Metab Cardiovasc Dis,2018,28(3):298-307.
[23]DEFRONZO R A,REEVES W B,AWAD A S.Pathophysiology of diabetic kidney disease:impact of SGLT2 inhibitors[J].Nat Rev Nephrol,2021,17(5):319-334.
[24]PERKOVIC V,JARDINE M J,NEAL B,et al.Canagliflozin and renal outcomes in type 2 diabetes and nephropathy[J].N Engl J Med,2019,380(24):2295-2306.
[25]王康丽,洪天配,魏蕊.SGLT2抑制剂对胰岛β细胞的保护作用及潜在机制[J].中华内分泌代谢杂志,2021,37(4):297-300.
[26]张玉齐.达格列净联合二甲双胍对T2DM合并PCOS患者胰岛素抵抗及性激素水平影响的研究[D].兰州:兰州大学,2022.










