宁夏银北农村地区肉牛布鲁氏菌病监测与分析论文
2024-05-13 14:34:50 来源: 作者:zhoudanni
摘要:布鲁氏菌病(布病)是一种呈世界流行的人畜共患 病,主要表现为流产、产奶量减少、胎盘滞留、子宫炎、关节炎和睾丸炎等[1] 。根据WOAHWAHIS数据,除 西欧和北欧的部分国家以及加拿大、日本、澳大利亚和 新西兰被认为是布病净化的国家,其余国家布病仍未根除。现阶段布病主要流行于发展中国家如地中海沿岸、 非洲、南美洲、中东和亚洲等地[2-4] 。
摘要:为探讨宁夏银北农村地区肉牛布鲁氏菌病的流行病学情况,试验在该地9个村庄开展,随机选择20个未接种布鲁 氏菌疫苗的肉牛养殖场,每场采集20份全血,共400份样品,采用虎红平板凝集试验(RBPT)和竞争酶联免疫吸附试验 ( cELISA)检测肉牛血清抗体情况,再采取实时荧光定量PCR( RT-qPCR)法对血清阳性样品进行检测,将qPCR结果为 阳性的样品进一步采取AMOS-PCR法进行扩增分型。结果表明, RBPT和cELISA整体血清阳性率分别为为23.5%和27.5% , 2种检测方法之间的Kappa值为0.816 ,一致性较好; RBPT和cELISA检测的群体平均阳性率分别为60%和65% ;qPCR检测显 示,只有5份血清样品布鲁氏菌阳性,经AMOS-PCR鉴定为牛种布鲁氏菌。说明牛种布鲁氏菌是引起该地区牛布鲁氏菌病 的主要病原菌。通过探讨宁夏银北农村地区肉牛布鲁氏菌病的流行病学情况,发现该地肉牛布病具有较高的流行率,且检 测发现感染布病的为牛种布鲁氏菌,为宁夏银北地区控制和预防布鲁氏菌的感染提供流行病学依据。
关键词: 农村地区,布鲁氏菌病,肉牛,监测,分析
0 引言
布鲁氏菌病(布病)是一种呈世界流行的人畜共患 病,主要表现为流产、产奶量减少、胎盘滞留、子宫炎、关节炎和睾丸炎等[1] 。根据WOAHWAHIS数据,除 西欧和北欧的部分国家以及加拿大、日本、澳大利亚和 新西兰被认为是布病净化的国家,其余国家布病仍未根除。现阶段布病主要流行于发展中国家如地中海沿岸、 非洲、南美洲、中东和亚洲等地[2-4] 。《兽医公报》公布 数据显示,布病也已成为我国牛羊最严重的报告疫病, 在2016—2021年,畜间布病报告病例占牛羊所有疾病报 告病例总数的88.2%,在再发阶段,布鲁氏菌病流行范 围持续扩大,发病率呈指数增长,并蔓延32个省,严重 危害人类健康及公共卫生安全[5]。
目前,基于细菌学、致病性和宿主嗜性等方面,结 合分子分型与全基因组测序,将布鲁氏菌分为12个生物 种,包括6种“经典”和6种“新发现”,其中对人类致 病性强的包括羊种、牛种、猪种和犬种[6-8] 。布鲁氏菌的 精确鉴定是控制与根除布病的关键,虽然传统的布鲁氏 菌的分离和鉴定是布病诊断的“金标准”,但是不适用 于大规模的流行病学调查[9] 。为了解宁夏银北农村地区 肉牛感染布病的情况,为布病的预防、控制及净化提供 科学依据,本研究采取血清学及分子生物学方法对宁夏 银北地区9个村庄的肉牛感染布鲁氏菌情况进行监测, 以评估流行病学情况,以期为后期科学防控提供依据。
1 材料
1.1 样本
2022年11月,从宁夏银北地区9个村庄20个养殖场各采集20份肉牛全血共计400份样品。
1.2 主要试剂
虎红平板凝集试验抗原,购自哈药集团生物疫苗 有限公司; c ELISA试剂盒、布鲁氏菌荧光定量PCR 检测试剂盒,购自青岛立见生物科技有限公司;动物 病毒DNA/RNA快速提取试剂盒,购自西安天隆科技 有限公司; AMOS-PCR 引物序列,购自华大基因; 2 ×TransTaq®-T PCR SuperMix,购自北京全式金生物技 术股份有限公司。
1.3 主要仪器
生物安全柜,上海力申科学仪器有限公司生产;酶 标仪、 PCR扩增仪、紫外凝胶成像系统,美国伯乐公司 生产生产;生化培养箱,天津市泰斯特仪器有限公司生 产;全自动核酸提取仪,西安天隆科技有限公司生产; 实时荧光PCR仪,德国耶拿公司生产;电泳仪,北京 六一仪器厂生产。
2 方法
2.1 血清学检测
血液样本经离心分离后取上血清,采取RBPT+cELISA 方法进行检测。 RBPT操作方法及结果判定严格参照国 标GB/T8646—2018规定执行, cELISA按照试剂盒说明 进行操作及结果判定。
2.2 RT-qPCR
对于血清学阳性样本采取RT-qPCR法进行病原学检 测,具体操作方法严格按照试剂盒说明书执行。
2.3 AMOS-PCR
以RT-qPCR判定的阳性样本DNA为模版,用布鲁氏 菌属鉴定引物IS711插入序列为基础设计AMOS-PCR引 物,引物序列见表1.依据文献[10]使用的引物序列和扩增 参数进行扩增,产物经1.5%的琼脂糖凝胶电泳检测。

3 数据的统计分析
本次实验数据用 EXCEL 做基础整理,再使用 SASS27.0进行统计分析。
4 结果
4.1 牛布鲁氏菌的血清学检测
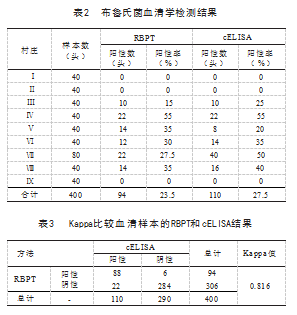
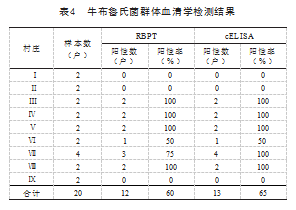
牛布鲁氏菌个体血清学检测结果见表2.结果显 示, 9个村庄RBPT个体平均阳性率为23.5% ,cELISA 平均阳性率为27.5%,其中Ⅳ村RBPT 、cELISA阳性率 均为最高,均达55%。采用Kappa一致性检验比较所有 检测血清样本的RBPT和cELISA结果,见表3.结果表 明, 2项检验之间的Kappa值为0.816 ,一致性较好,其 中RBPT阳性样品cELISA基本也为阳性。牛布鲁氏菌 群体检测结果见表4.结果显示, 9个村庄RBPT群体平 均阳性率为60% ,cELISA平均阳性率为65%,除Ⅶ村 RBPT 、cELISA群体阳性不一致外,其余村庄群体阳性 率均一致。
4.2 RT-qPCR检测
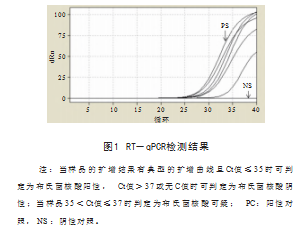
对于血清学阳性样本采取RT-qPCR法进行病原学检 测,结果见图1.结果显示,有5份血清样品布鲁氏菌 阳性, Ct值在26.93 ~ 33.14.其中5份血清样品RBPT和 cELISA检测均为阳性。
4.3 布鲁氏菌的AMOS-PCR鉴定
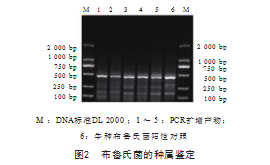
用IS711引物对上述RT-qPCR阳性样品做进一步的 AMOS-PCR扩增, PCR产物经1.5%琼脂凝胶电泳检测, 以DL2000 DNALadder为标准,结果显示,阳性样品均 扩增得到498 bp条带,与牛种布鲁氏菌分子量一致,鉴 定为牛种布鲁氏菌。
5 讨论
畜牧业是宁夏的传统产业,也是当地农村经济的支 柱产业,畜牧养殖已是其经济增长的主要来源。然而, 关于农村地区布病的流行病学调查及病原学研究较少。 本次研究结合血清学和分子生物学方法对宁夏银北地 区9个村庄牛感染布病情况进行分析,血清学调查结果 证实了在宁夏银北农村地区肉牛中布病的流行, 60%以 上的村庄中均有不同程度的感染,此项研究中由于牛 均未接种过布鲁氏菌疫苗,血清呈阳性是由于自然暴 露, RBPT法和cELISA法检测牛血清中布鲁氏菌的总阳 性率分别为23.5%和27.5%。研究报道,宁夏彭阳县未免 疫肉牛布病cELISA结果显示,平均个体阳性率为5% , 最高达24.4%,平均场户表观流行率为11.8%,最高达 53.8%[11] ;新疆某偏远地区3个规模牧场未免疫牛布病感 染情况显示, RBPT阳性率为6.8%[12] ;埃及北部6个村庄 未接种布鲁氏菌疫苗的家牛RBPT和iELISA血清阳性率 为20.7%和23.7%[13] 。数据表明,宁夏银北地区肉牛养殖 量虽然不大,但其布病血清阳性率普遍高于其他地区, 可能是由于该地与内蒙交界,交通发达,活畜交易频 繁,肉牛感染风险变大。
本研究中, RBPT阳性94份, cELISA阳性110份, Kappa值为0.816. 符合率较好。白鸽等[14]研究不同血 清学方法在奶山羊布病诊断中的比较,以试管凝集试 验( SAT )为基准, RBPT 、cELISA的符合率分别为 98.33%和98.75%,敏感性为96.67%和100% ,Kappa值为 0.870和0.902.证实cELISA在符合率、敏感性及Kappa 检验一致性均为最好,此外, RBPT和cELISAKappa值 为0.818.与本次实验结果一致。李展等[15]分析研究了 牛布病的不同检测方法,结果显示, RBPT阳性20份, cELISA阳性46份,得出cELISA敏感性高,适用于养殖 场布病的流行病学调查及净化工作。 RBPT检测的抗体 类型主要为IgG ,cELISA检测的抗体类型为IgM和IgG 。 对于一份早期感染的血清而言,当IgM和IgG的总量达到 50 IU/mL,在cELISA中就会表现为阳性,因此cELISA 相对于其他方法,其敏感性更高,可能会检测出更多的 阳性样品[16]。
对于血清学阳性样本采取RT-qPCR法进行病原学 检测, 结果显示,只有5份血清样品布鲁氏菌阳性或可 疑。 一项在巴基斯坦的研究表明,在SAT和ELISA分别 检测的布病血清阳性率为9.2%( 8/87)和10.3%(9/87)的 情况下,只有1份ELISA阳性样本扩增出流产布鲁氏菌 DNA [17] 。谭勤琴等[18]在调查一起布病聚集性疫情时研 究发现,从16份疑似患者全血标本只分离出5株疑似布 鲁氏菌,从19份疑似病羊全血标分离出1株疑似布鲁氏 菌。 Sankhe S S等[19]在调查绵羊山羊布鲁氏菌发病情况 时发现, 通过IS711/BMPCR ,22.73%阳性全血和14.49%
阳性血清样本可产生731 bp的扩增子,证实存在羊种 布鲁氏菌。 qPCR检测不出血清阳性动物的布鲁氏菌 DNA,可能是由于这些动物曾感染过,但在采集血样时 缺乏菌血症。研究报道,对于血液样本而言,血沉棕黄 层和全血是PCR检测布鲁氏菌的最佳样本,血清样本由 于载菌量低或没有布鲁氏菌DNA而被认为是不合适的 选择[20]。
AMOS-PCR是布鲁氏菌种型鉴定应用最广泛的方法 之一,据报道,该方法根据可变转座子IS71l基因在不 同布鲁氏菌种之间的差异,可鉴定羊种布鲁氏菌( 1 、 2 、3型, 731 bp ),牛种布鲁氏菌( 1 、2 、4型, 498 bp),猪种布鲁氏菌( 1型, 285 bp)和绵羊附睾种布鲁 氏菌( 96l bp )[21-22] 。本实验经AMOS-PCR检测阳性样 品,均得到498 bp,为牛种布鲁氏菌。杨琴等[12]研究发 现,在牛流产胎儿、牛生鲜乳样品阳性中均可鉴定出羊 种布鲁氏菌。黄天鹏等[22]在牛体表采集的寄生蜱样本中 分离到的布鲁氏菌也均为羊种布鲁氏菌。羊种布鲁氏菌 致病力和侵袭力均强,成为世界范围内的流行菌种,但 是本研究只鉴定出牛种布鲁氏菌,未获得其它种型的布 鲁氏菌,但不排除其的存在,这可能与采集的样本等因 素有关,有待进一步研究。
6 结论
本研究揭示了在宁夏银北农村地区未接种疫苗的肉 牛血清中布鲁氏菌抗体阳性率较高,且RBPT和cELISA 检测方法一致性较好,通过AMOS-PCR鉴定,该地多为 牛种布鲁氏菌。下一步,将进行更多的流行病学研究和 基因分型等,为制定适合的布病预防控制措施提供科学 依据。
参考文献
[1] 刘晨芳,翟景波,梁晨,等.布鲁氏菌病新型疫苗研究进展[J] . 中国人兽共患病学报, 2022 ,38( 12 ): 1 141-1 146 .
[2] Liliana C ,Lina A ,Paolo T ,et al . Characterization and evolution of countries affected by bovine brucellosis( 1996—2014 )[J].Transbound EmergDis ,2019 ,66(3): 1280-1290.
[3] 范伟兴,狄栋栋,黄保续.发达国家根除家畜布病的主要措 施[J] . 中国动物检疫, 2013 ,30(4 ):68-70 .
[4] O'grady D ,Kenny K ,Power S ,et al .Detection of Yersinia enterocolitica serotype O :9 in the faeces of cattle with false positive reactions in serological tests for brucellosis in Ireland[J] .Vet J ,2016 ,216 :133-135 .
[5] 华利忠,许玉静,王佳,等. 区域性动物布鲁氏菌根除计划及 对我国的启示[J] . 中国兽医杂志, 2023 ,59(6 ): 153-157 .
[6] Olsen S C ,Tatum FM .Swine brucellosis :current perspectives[J] . Vet Med :Res Rep ,2016 ,8 :1-12 .
[7] 赵若楠,赵世刚 . STING受体在布鲁氏菌感染固有免疫中 的作用机制研究进展[J] . 中国人兽共患病学报, 2023 ,39( 1 ):67-72 .
[8] 文立波,毋艳萍.布鲁氏菌致病机制研究进展[J] .甘肃畜牧 兽医, 2022 ,52( 8 ): 1-4 .
[9] 李林姣,彭小薇,刘铭赫,等 .动物布鲁氏菌病实验室检测 技术研究进展[J] . 中国兽药杂志, 2023 ,57(4 ):78-87 .
[10] 曹小安.我国西北地区羊布鲁氏菌分子流行病学及抗原表位 多肽的筛选[D] .兰州:中国农业科学院, 2018 .
[11] 杨涛, 周小燕. 宁夏彭阳县肉牛布鲁氏菌病空间分析[J] . 中 国动物检疫, 2022 ,39( 1 ):23-28 .
[12] 杨琴,邓肖玉,张欢,等.新疆某地区3个牧场布鲁氏菌病流 行状况调查及分析[J] .动物医学进展, 2021 ,42( 8 ): 126-131 .
[13] Elhaig M M ,Ali W .Seroprevalence ,associated risk factors,and molecular detection of bovine brucellosis in rural areas of Egypt[J] .Comp Immunol Microb ,2023 ,95 :101 971-101 976 .
[14] 白鸽,王国超,陈茹,等 . 不同血清学方法在奶山羊布鲁 氏菌病诊断中的比较分析[J] . 动物医学进展, 2022 ,43( 12 ): 121-124 .
[15] 李展,张爱琼,罗师红.牛布病不同检测方法的结果分析[J] . 畜禽业, 2022 ,33( 10 ): 10-12 .
[16] 蒋卉,冯宇,李筱英,等.布鲁氏菌4种高通量抗体检测方法 的比较研究[J] .畜牧兽医学报, 2021 ,52( 11):3 208-3 214.
[17] Jamil T ,Melzer F ,Khan I ,et al .Serological and Molecular Investigation of Brucella Species in Dogs in Pakistan[J] . Pathogens ,2019 ,8(4 ):294 .
[18] 谭勤琴,王月,刘英,等.贵州省一起布鲁氏菌病聚集性疫 情的病原学调查与分子流行病学分析[J] . 中国病原生物学杂 志, 2022 ,17( 7 ):802-806 .
[19] Sankhe S S ,Thorat V D .Molecular characterization of Brucella melitensis detected in blood and Serum samples of sheep and Goats[J] .Indian Journal of Small Ruminants ( The ),2023 , 29( 1 ):78-83 .
[20] Mitka S ,Anetakis C ,Souliou E ,et al .Evaluation of different PCR assays for early detection of acute and relapsing brucellosis in humans in comparison with conventional methods[J] .J Clin Microbiol ,2007(45 ): 1 211-1 218 .
[21] Ewalt D R ,Bricker B J .Validation of the abbreviated Brucella AMOS PCR as a rapid screening method for differentiation of Brucella abortus field strain isolates and the vaccine strains ,19 and RB51 .J Clin Microbiol ,2000 ,38( 8 ):3 085-3 086 .
[22] 黄天鹏,郭旭,孙长云,等. 呼伦贝尔地区牛体表寄生蜱中 羊种布鲁氏菌的分离与鉴定[J] . 中国农业科学, 2022 ,55(2 ):415-424 .










