马疱疹病毒1型UL56蛋白的原核表达及多克隆抗体的制备论文
2024-05-10 13:41:28 来源: 作者:zhoudanni
摘要:马疱疹病毒1型( EHV-1 )是马鼻肺炎的病原体之一,在马群中广泛流行,大多数马匹在幼年时被感染并在其体内建立终生潜伏。 EHV-1具有很强的传染性,马属动物感染后主要表现为孕马流产、新生马驹死亡、视 网膜脱落、呼吸系统和神经系统等多种临床症状,对马 产业发展造成了巨大的影响[1-2] 。由于EHV-1使用多种机 制逃逸宿主免疫反应,尚未开发出完全保护性疫苗和有 效的抗病毒药物,使其目前仍是世界各地重点防控的马 匹急性传染病[3-4] 。
摘要:为制备马疱疹病毒1型( EHV-1 )UL56蛋白(pUL56)的多克隆抗体。该研究根据GenBank中EHV-1 YM2019株全基 因组序列,采用Ni-NTA亲和层析纯化蛋白,与弗氏佐剂乳化后免疫BALB/c小鼠并制备pUL56多克隆抗体,经Western blot 与间接ELISA试验测定多克隆抗体反应性。结果显示,纯化后的pUL56可以与EHV-1阳性血清发生反应; pUL56多克隆抗体 的效价为1 :128 000.并能与pUL56特异性结合。本研究成功制备具有良好反应性的pUL56多克隆抗体,为pUL56功能特性 及EHV-1致病机制的研究奠定理论基础。
关键词: 马疱疹病毒1型,UL56蛋白,原核表达,多克隆抗体
0 引言
马疱疹病毒1型( EHV-1 )是马鼻肺炎的病原体之一,在马群中广泛流行,大多数马匹在幼年时被感染并在其体内建立终生潜伏。 EHV-1具有很强的传染性,马属动物感染后主要表现为孕马流产、新生马驹死亡、视 网膜脱落、呼吸系统和神经系统等多种临床症状,对马 产业发展造成了巨大的影响[1-2] 。由于EHV-1使用多种机 制逃逸宿主免疫反应,尚未开发出完全保护性疫苗和有 效的抗病毒药物,使其目前仍是世界各地重点防控的马 匹急性传染病[3-4] 。由细胞毒性T淋巴细胞( CTL)介导 的免疫对于防御细胞相关病原体至关重要, CTLs与主 要组织相容性复合物I类( MHC-I )相互作用,继而有 效识别和破坏被病毒感染的细胞[5-6] 。然而,大多数疱疹 病毒已进化出一系列逃逸机制,它们通过下调细胞表面 MHC-I分子的表达以避免CTL识别,实现逃逸宿主免疫 反应, EHV-1同样使用该逃逸策略[7]。
研究发现, EHV-1的UL56蛋白(pUL56)是一种磷 酸化的早期蛋白,由ORF1编码[8] 。该蛋白在MHC-I下 调过程中发挥着主要作用,但是其具体机制尚未明确, 为此pUL56在EHV-1逃逸宿主免疫过程的作用需要进一 步研究。本研究拟以EHV-1本地流行株YM2019株为研 究对象,对pUL56进行原核表达,以纯化的重组蛋白免 疫BALB/c小鼠制备pUL56的多克隆抗体,为深入研究 pUL56的功能奠定基础。
1 材料与方法
1.1 毒株、载体、细胞和试验动物
EHV-1 YM2019株、 pET-32a表达载体和EHV-1阳性 血清均由本研究室保存; Trans5 α和Transetta( DE3 ) 感受态细胞购自北京全式金生物技术有限公司; SPF级6 周龄雄性BALB/c小鼠购自新疆医科大学动物实验中心。
1.2 主要试剂
2 ×Es Taq Master Mix( Dye )购自北京康为世纪 生物科技有限公司;限制性内切酶BamH Ⅰ、EcoR I 、 pMD19-T Vector和T4 DNA Ligase购自宝日医生物技术 (北京)有限公司; DNA胶回收和质粒提取试剂盒购自 OMEGA公司; Ni-NTA纯化树脂购自生工生物工程(上 海)股份有限公司; Goat Anti-Mouse IgG(H+L )-HRP antibody购自biosharp公司;弗氏完全佐剂和不完全佐剂 购自Sigma公司。
1.3 UL56基因的克隆
根据GeneBank中EHV-1 YM2019株全基因组序列 ( GenBank :MT063054),设计UL56全长基因的特异 性引物, UL56-F :5 ′-AAAGGAGTGCATGTA-3 ′, UL56 :5 ′-CCACGCTGGATCCATG-3′,预期扩增片 段大小为609 bp 。PCR扩增反应体系( 50 µL ):2 ×Es Taq Master Mix(Dye)25 µL,上下游引物( 10 μmol/L ) 各2 µL ,DNA模板2 µL ,ddH2O 19 µL。反应程序: 94 ℃预变性2 min;94 ℃变性30 s ,54 ℃退火30 s ,72 ℃ 延伸30 s ,35个循环; 72 ℃延伸10 min。使用胶回收试剂盒回收PCR产物,与pMD19-T载体连接并转化至 Trans5 α感受态细胞中,挑取单克隆,提取质粒鉴定, 将鉴定正确的质粒送至公司测序。
1.4 生物信息学分析
使用DNAstar软件对UL56基因进行同源性分析; MEGA7软件绘制UL56基因遗传进化树; Signal P 5.0 、 TMHMM 2.0和DNAstar软件分析pUL56信号肽、跨膜区和结构特征。
1.5 pET-32a-UL56表达载体的构建
设计扩增UL56基因片段的特异性引物, pUL56-F : 5 ′-CG GGATCCATGAGGAGGCGCATACACG-3 ′ (下划线为BamH Ⅰ酶切位点) ,pUL56-R :5 ′-CG GAATTCTTACTTCCTGCAAAAGGTT-3′(下划线为 EcoR I 酶切位点),预期扩增长度为509 bp 。PCR反应 条件和反应程序参照1.3部分,使用BamH Ⅰ和EcoR I 酶分别对目的片段和pET-32a表达载体进行酶切,经T4 DNA Ligase连接并转化至Trans5α感受态细胞中,提取 质粒进行PCR、双酶切及测序鉴定,将验证正确的重组 质粒命名为pET-32a-UL56.
1.6 pUL56的原核表达
将重组质粒pET-32a-UL56转化至Transetta( DE3 ) 感受态细胞中,挑取单克隆接种至含氨苄抗性的LB液体 培养基中, 37 ℃, 180 r/min条件下过夜培养,再将过夜 培养的菌液按照1 :100比例接种到LB培养基中,培养至 OD600 nm值为0.6 ~ 0.8时,加入IPTG (终浓度0.2 mmol/L ) 诱导表达,分别收集诱导2 、3 、4 、5 、6 h的菌体,超声 破碎菌体并进行SDS-PAGE分析,分析pUL56的最佳诱 导时间和可溶性。
1.7 pUL56的纯化和Western blot鉴定
大体积诱导pET-32a-UL56重组表达菌,离心收集后 加入裂解液,置于冰上超声破碎。按照Ni-NTA琼脂糖 树脂说明书纯化pUL56.完成后将蛋白装入透析袋,依 次在浓度为6 、4 、2 mol/L尿素中复性,时间均为12 h , 经SDS-PAGE电泳验证后, -80 ℃保存备用。
将纯化的pUL56进行SDS-PAGE电泳, 结束后转印 至PVDF膜,加入5%脱脂乳, 37 ℃封闭2 h;PBST洗涤 3次,加入EHV-1阳性血清( 1 :100稀释), 37 ℃孵育 2 h;PBST洗涤3次,加入Goat Anti-Horses IgG(H+L )- HRP antibody( 1 :10 000稀释), 37 ℃孵育1 h;PBST 洗涤3次,使用ECL化学发光溶液显色。
1.8 pUL56多克隆抗体的制备
将纯化后的pUL56与等体积的弗氏完全佐剂乳化 后,免疫6周龄雄性BALB/c小鼠( 100 μg/只);第 14 、28天分别进行二免和三免,蛋白与弗氏不完全佐剂 乳化。每次免疫前采集血液并分离血清, -20 ℃保存备用。
1.9 pUL56多克隆抗体的效价测定
将纯化的pUL56包被ELISA反应板( 5 μg/孔), 4 ℃过夜; PBST 洗涤3 次,加入5% 脱脂乳, 37 ℃ 封闭 1 h ;PBST洗涤3次,加入倍比稀释的小鼠血清 ( 1 ∶ 500 ~ 1 ∶ 512 000 ) ,免疫前的小鼠血清作为阴 性对照; PBST洗涤3次,加入Goat Anti-Mouse IgG (H+L )-HRP antibody ;PBST洗涤3次,加入TMB工作 液避光显色, H2SO4(2 mol/L)终止显色,测定OD450 nm 值。P为阳性血清的OD450 nm值,N为阴性血清的OD450 nm 值, P/N≥2.1时判断为阳性,反之为阴性。
1.10 pUL56多克隆抗体的反应性鉴定
将纯化的pUL56作为抗原, pUL56多克隆抗体作 为一抗,免疫前的小鼠血清作为阴性对照, Goat Anti- Mouse IgG( H+L )-HRP antibody作为二抗,进行 Western Blot试验,鉴定多克隆抗体的反应性。
1.11 pUL56多克隆抗体的应用
培养RK-13细胞,待其密度达到70% ~ 80%后, 将重组质粒pcDNA3.1-UL56和空载体pcDNA3.1转染 分别转染至细胞中, 48 h后收集细胞样品;将pUL56 多克隆抗体作为一抗, Goat Anti-Mouse IgG( H+L )- HRP antibody作为二抗,进行Western Blot试验,以此 判定pUL56多克隆抗体能否检测到RK-13细胞表达的 pUL56.

2 结果
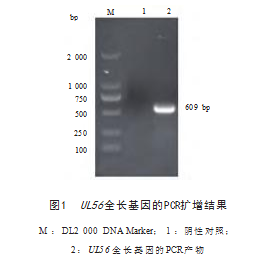
2.1 UL56全长基因的扩增结果
以EHV-1基因组为模板, PCR扩增出大小为609 bp 的片段,与预期大小相符,见图1.
2.2 生物信息学分析
2.2.1 UL56基因分析
测序结果表明, UL56基因的核苷酸序列未发生突 变;遗传进化分析结果显示, UL56基因与26株马源 性毒株的基因相似性为100%;与野驴源毒株5586 、 瞪羚源毒株94-137和斑马源毒株T-616的相似性分别是 98.4% 、95.1% 、95.1% ;该基因在马源性毒株间具有很 高的保守性,其变异主要与宿主进化相关,见图2.
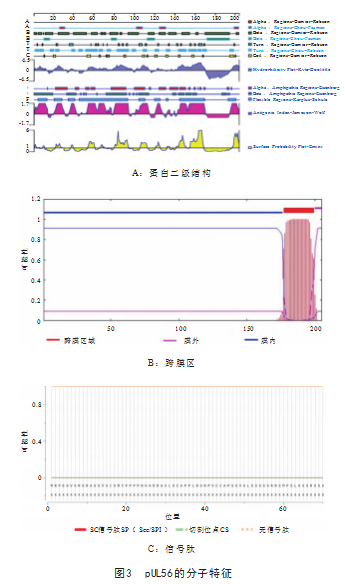
2.2.2 pUL56的二级结构、跨膜区及信号肽分析
氨基酸序列分析表明, pUL56含有203个氨基酸;全 蛋白具有丰富的抗原区域,见图3A;第 1 ~ 168位氨基酸 处亲水性,表面可及性较好,且具有较高的抗原性,第 170 ~ 192位氨基酸处为跨膜螺旋结构域,见图3B;不存 在信号肽位点,见图3C。
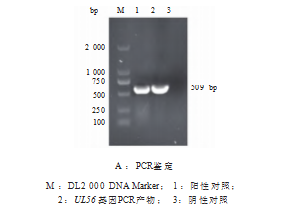
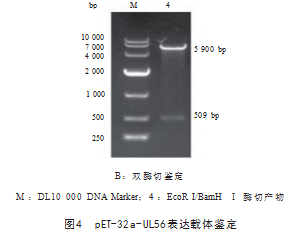
2.3 pET-32a-UL56表达载体的鉴定
以pET-32a-UL56表达载体为模板, PCR扩增得到 509 bp的片段,见图4A;用EcoR I和BamH Ⅰ 酶对pET- 32a-UL56表达载体酶切,获得5 900 bp和509 bp的片段, 见图4B,大小均与预期相符,表明成功构建pET-32a - UL56表达载体。
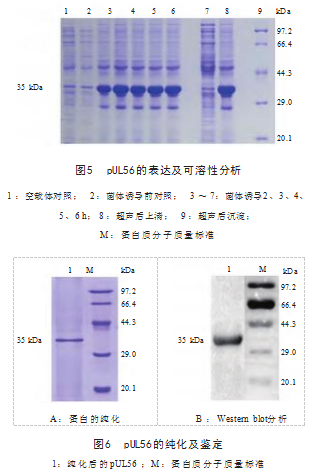
2.4 pUL56的表达、纯化及Western blot鉴定
pUL56 在诱导3 h 时表达量最高,相对分子质量 为35 kDa,与预期一致,并以包涵体形式存在,见图 5 ;通过Ni-NTA纯化树脂获得纯度较高的pUL56.见图 6A,可以与EHV-1阳性血清特异性结合,见图6B,表明 pUL56具有良好的反应原性。
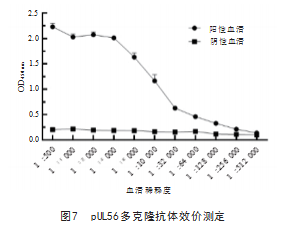
2.5 pUL56多克隆抗体效价及反应性测定
间接ELISA 结果显示,小鼠血清的稀释度超过 1 :128 000时P/N<2.1.表明pUL56多克隆抗体效价为1 :128 000.见图7 ;Western blot结果显示,多克隆抗 体能与纯化的pUL56结合,呈现出单一的蛋白条带,但 不与阴性血清反生反应,见图8.表明pUL56多克隆抗 体具有良好的反应性。
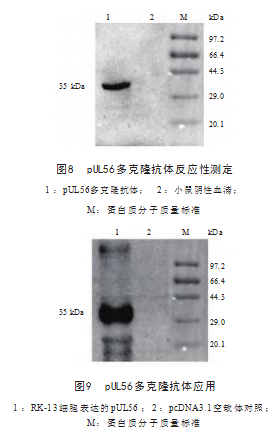
2.6 pUL56多克隆抗体应用
Western blot结果显示, pUL56多克隆抗体能与转 染pcDNA3.1-UL56重组质粒的细胞样品发生反应, 产生特异性的蛋白条带,大小也与预期相符;而转染 pcDNA3.1空载体的细胞样品未检测到该条带,表明 pUL56多克隆抗体可用于检测细胞中表达的pUL56.见 图9.
3 讨论
1936年, Dimock W W和Edwards P R[9]首次从流产 胎儿的肺组织中分离出EHV-1.国内于1982年分离到该 病毒[10] 。随后,罗蔼剑等[11]对我国11个省进行了流行病 学调查,结果显示,血清阳性率最高可达70.83%。目 前尚无特效药物治疗该病,此外,我国的EHV-1疫苗仍 然处于实验室研发阶段,所以只能依赖进口的商品化疫 苗。与大多数疱疹病毒一样, EHV-1利用其基因产物在 多个水平上阻断免疫反应[12-13] ,这为EHV-1有效疫苗的 研发带来阻碍。
EHV-1感染马匹后首先在呼吸道上皮细胞中开始复 制,然后进入血液中的外周血单核细胞,引起细胞相关 的病毒血症[14] 。马匹表现的流产和神经症状的主要原因 是EHV-1在妊娠子宫和中枢神经系统的内皮细胞中形成 血栓[15]。研究发现,pUL56在调节呼吸道上皮的抗原呈 递、细胞因子表达和趋化性中的发挥着重要作用[16] 。将 EHV-1 Ab4神经致病性毒株的UL56基因缺失后,病毒 在细胞内的增殖效价不受影响,但其对马匹的致病力明 显下降,主要表现为马匹的发热症状和鼻腔排毒量均减 少。当野毒感染后,该基因缺失毒株也具有良好的免疫 保护效果[17-18] 。以上研究结果表明, pUL56的功能特性 与EHV-1的传播有着密切的联系,因此, UL56基因具 有潜在的研究价值,可作为基因缺失疫苗研究的候选基因。
研究发现, EHV-1病毒全蛋白抗体可有效抑制T细 胞对有丝分裂原的反应。 pUL56在调节丝裂原活化蛋白 激酶中发挥重要作用,因此该蛋白可能参与该机制[19] 。 本研究所制备的多克隆抗体可用于验证pUL56在抑制T 细胞反应中的发挥的作用,以揭示该蛋白在EHV-1逃逸 宿主免疫过程的功能。
本研究选用高效克隆和表达的pET载体,通过大肠 杆菌表达系统获得重组蛋白,使蛋白的原核表达变得 简单和快捷,同时也降低了成本。但是大肠杆菌表达系 统也存在一些不足之处,例如目的蛋白以包涵体的形式 存在。在本研究的蛋白原核表达过程中通过降低诱导温 度、更换表达载体或调整IPTG的浓度,均未改变蛋白的 表达形式。皮下免疫动物存在最大剂量限制,然而包涵 体蛋白经过多次洗涤和透析复性后损失量较大,使其浓 度严重降低。为此本研究采用超滤离心管浓缩蛋白解决 了蛋白浓度较低的问题。
4 结论
本研究掌握EHV-1 YM2019株UL56基因的生物信息学特性,获得纯化的pUL56并制备出免疫反应强且特异性高的pUL56多克隆抗体,为pUL56的功能特性以及EHV-1致病机制的研究奠定理论基础。
参考文献
[1] Bryant N A ,Wilkie G S ,Russell C A ,et al .Genetic diversity of equine herpesvirus 1 isolated from neurological ,abortigenic and respiratory disease outbreaks[J] . Transboundary and Emerging Diseases ,2018 ,65( 3 ):817-832 .
[2] Holz C L ,Sledge D G ,Kiupel M ,et al .Histopathologic findings following experimental equine herpesvirus 1 infection of horses[J] .Frontiers in Veterinary Science ,2019 ,6( 6 ): 59-65 .
[3] Oladunni F S ,Horohov D W ,Chambers T M .EHV-1 : A constant threat to the horse industry[J] . Frontiers in Microbiology ,2019 ,10( 1 ):2 668-2 672 .
[4] Vis s ani M A ,Thiry E ,D al P ozz o F ,et al . Antiviral agents against equid alphaherpesviruses :Current status and perspectives[J] .The Veterinary Journal ,2016 ,207( 1 ): 38-44 .
[5] Koyanagi N ,Kawaguchi Y .Evasion of the cell-mediatedimmune response by Alphaherpesviruses[J] .Viruses ,2020 ,12(2 ): 1 354-1 360 .
[6] Wang P ,Dong S ,Zhao P ,et al .Direct loading of CTL epitopes onto MHC class I complexes on dendritic cell surface in vivo[J] .Biomaterials ,2018 ,18(2 ):92-103 .
[7] Grabowska K ,Wąchalska M ,Graul M ,et al.Alphaherpesvirus gB homologs are targeted to extracellular vesicles ,but they differentially affect MHC class II molecules[J] .Viruses ,2020.12(4 ):429-434 .
[8] Perkins G ,Babasyan S ,Stout A E ,et al .Intranasal IgG4/7 antibody responses protect horses against equid herpesvirus-1 ( EHV-1 ) infection including nasal virus shedding and cell- associated viremia[J] .Virology ,2019 ,531(4 ):219-232 .
[9] Dimock W W ,Edwards P R .Is there a filterable virus of abortion in mares[J] .Kentucky Agricultural Experiment Station Bulletin ,1933 ,333( 1 ):297-301 .
[10] 刘景华,郝崇,袁肇敏.马疱疹病毒 1 型的分离和初步鉴定[J] .微生物学报, 1982 ,22( 1 ):88-94 .
[11] 罗蔼剑, 张莹, 刁巧虹, 等.我国马鼻肺炎流行现状[J] . 中 国兽医杂志, 2016 ,52( 11 ):84-87 .
[12] Koyanagi N ,Kawaguchi Y .Evasion of the cell-mediated immune response by alphaherpes-viruses[J] .Viruses ,2020 ,12( 12 ): 1 354-1 360 .
[13] Laval K ,Poelaert K C K ,Van Cleemput J ,et al . The pathogenesis and immune evasive mechanisms of equine herpesvirus type 1[J] .Frontiers in Microbiology ,2021 , 12 ( 1 ):662 686 .
[14] Vandenberghe E ,Boshuizen B ,Delesalle C J G ,et al .New Insights into the Management of an EHV-1 ( Equine Hospital) Outbreak[J] .Viruses ,2021 ,13( 8 ): 1 429-1 435 .
[15] Pusterla N ,Barnum S ,Miller J ,et al .Investigation of an EHV-1 outbreak in the United States caused by a new H752 genotype[J] .Pathogens ,2021 ,10( 6 ):747-756 .
[16] Pavulraj S ,Kamel M , Stephanowitz H ,et al .Equine Herpesvirus type 1 modulates cytokine and chemokine profiles of mononuclear cells for efficient dissemination to target organs[J] .Viruses ,2020 ,12( 9 ):999-1 005 .
[17] Wimer C L ,Schnabel C L ,Perkins G ,et al .The deletion of the ORF1 and ORF71 genes reduces virulence of the neuropathogenic EHV-1 strain Ab4 without compromising host immunity in horses[J] .PLoS One ,2018 , 13( 11 ): e0 206 679 .
[18] Hussey G S ,Hussey S B ,Wagner B ,et al .Evaluation of immune responses following infection of ponies with an EHV-1 ORF1/2 deletion mutant[J] .Veterinary Research ,2011 ,42( 1 ):23 .
[19] Watanabe M ,Arii J ,Takeshima K ,et al . Prohibitin-1contributes to cell-to-cell transmission of herpes simplex virus 1 via the MAPK/ERK signaling pathway[J] .Journal of Virology , 2021 ,95( 3 ): 1 413-1 420 .










