不同酶消化法提取猪原代肝细胞的效果比较论文
2024-05-09 14:59:17 来源: 作者:zhoudanni
摘要:猪圆环病毒(PCV)是Circoviridae科Circovirus属的 一种无囊膜的单链环状DNA病毒。在已知的4个血清型 中, PCV2为猪易感的致病性病毒[1] 。PCV2感染会诱导 宿主免疫抑制引起猪圆环病毒病( PCVD ),包括断奶 仔猪多系统衰竭综合征、新生仔猪先天性脑震颤、皮炎 与肾病综合征、猪呼吸道病综合征、母猪繁殖障碍等, 给全世界养猪业带来较大的经济损失,是世界各国的兽 医与养猪业者公认的造成重大影响的猪传染病[2] 。
摘要 :猪肝细胞是猪圆环病毒的靶细胞,简单快速地提取猪原代肝细胞对于研究猪圆环病毒病的致病机制具有重要意义。 该文采用离体酶消化法,比较胰蛋白酶、 II型胶原酶、 IV型胶原酶、 II型和IV型胶原酶混合物提取猪原代肝细胞的效果。结 果显示,这4种酶消化法均能获得有功能的肝细胞,其中胶原酶混合物分离的肝细胞数量最多,胰蛋白酶法分离的肝细胞数量较少, II型、 IV型胶原酶消化法分离的肝细胞排列整齐、边界清晰。
关键词: 猪,原代肝细胞,提取,消化,圆环病毒,圆环病毒病
0 引言
猪圆环病毒(PCV)是Circoviridae科Circovirus属的 一种无囊膜的单链环状DNA病毒。在已知的4个血清型 中, PCV2为猪易感的致病性病毒[1] 。PCV2感染会诱导 宿主免疫抑制引起猪圆环病毒病( PCVD ),包括断奶 仔猪多系统衰竭综合征、新生仔猪先天性脑震颤、皮炎 与肾病综合征、猪呼吸道病综合征、母猪繁殖障碍等, 给全世界养猪业带来较大的经济损失,是世界各国的兽 医与养猪业者公认的造成重大影响的猪传染病[2] 。PCV2 的感染在猪生长发育的不同阶段有不同的组织嗜性。但 无论是胎儿阶段还是出生后,肝细胞都是PCV2感染和 复制的靶细胞。因此, PCV2也被视为一种能够诱导猪 肝炎的病毒[3] 。且PCV2诱导的肝细胞凋亡在PCV2引发的相关病变和疾病的发病机制中具有关键性作用[4] 。因 此,方便、快捷地获取大量有活性的猪肝细胞对于研究 PCVD的致病机制具有重大意义。目前获取肝细胞常用 的方法主要包括机械分离细胞法、非酶分离细胞法、离 体酶消化法和酶灌流法等[5] 。因此,本试验采用简便、 经济、无需特殊设备、仅需部分肝组织的离体酶消化 法,比较不同酶消化分离猪原代肝细胞的效果,为一般 实验室提取分离大量有活性的猪肝细胞提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂
新鲜猪肝组织, Hank's平衡盐溶液( HBSS ), 磷酸盐缓冲液(无菌PBS ), 4%多聚甲醛( PFA ),Percoll分离液, DMEM/F-12培养基, DMEM培养基, 胎牛血清( FBS ),丙酮酸钠( 100 ×),青链霉素 ( 100 ×),地塞米松, ITS细胞培养添加物,Ⅱ型胶原 酶,Ⅳ型胶原酶,胰酶,台盼蓝染色细胞存活率检测试 剂盒,油红O染液试剂盒等。
1.1.2 仪器与耗材
Nikon ECLIPSE TE2000 -U 倒置荧光显微镜, Eppendorf 5424R离心机, JIMBIO iCytal S2全自动流式 细胞计数仪,细胞培养箱, 一次性静脉输液针, 70 μm 细胞筛网, 0.22 μm微孔滤膜,细胞培养皿等。
1.1.3 溶液配制
①0.25%胰蛋白酶消化液:胰蛋白酶0.125 g ,EDTA 0.01 g ,HBSS 50 mL。②单一胶原酶消化液:Ⅱ型胶原 酶200 CDU/mL,Ⅳ型胶原酶200 CDU/ mL。③胶原酶混合 物:Ⅱ型胶原酶100 CDU/mL+Ⅳ型胶原酶100 CDU/mL。
④Percoll纯化液: Percoll分离液16.5 mL , 1 mol/L盐 酸50 μL ,DMEM培养基20 mL 。⑤完全培养基: FBS 10%、青链霉素1%、丙酮酸钠1% 、ITS 1%、地塞米松100 nmol/L 、DMEM/F12培养基50 mL。
1.2 方法
1.2.1 提取猪原代肝细胞
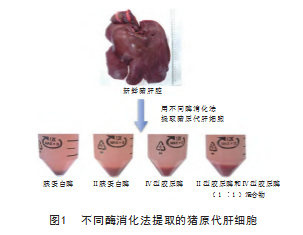
①准备: 采集新鲜离体的猪肝脏, 剪取约2 g的肝 组织块数块,用预冷的HBSS冲洗干净。②消化:将洗 净的肝组织块均匀、随机分为4组,将各组的组织块进 一步剪成大小均一的细小碎块,分别加入胰蛋白酶、 Ⅱ型胶原酶、Ⅳ型胶原酶、胶原酶混合物,在预热的 37 ℃水浴锅中震荡,消化约20 min。③终止:加入完全 培养基,颠倒混匀后用70 μm筛网过滤,得到肝细胞悬 液。 4 ℃, 1 000 r/ min,离心4 min,弃上清,得到肝细 胞。④纯化:加入预冷的HBSS 20 mL,轻轻吹打混匀后 4 ℃, 1 000 r/ min,离心4 min,弃上清,重复清洗2次。 加入Percoll纯化液, 4 ℃, 1 000 r/min,离心10 min,弃 上层细胞及分离液,加入预冷的HBSS 20 mL再次清 洗离心后,沉在管底的细胞为经过纯化的肝细胞,用20 mL完全培养基重悬。
1.2.2 细胞计数及细胞成活率测定
将细胞悬液稀释10倍后,加入台盼蓝染料,室温染 色3 min,用全自动流式细胞计数仪检测总细胞数和细胞 成活率。
1.2.3 猪原代肝细胞的培养和形态学观察
将所得的细胞悬液接种于培养皿中,并置于37 ℃, 5% CO2 ,饱和湿度条件下培养, 6 h后换液。用倒置显微镜观察并拍摄提取的肝细胞形态。
1.2.4 猪原代肝细胞的鉴定
通过油红O染色法鉴定肝细胞,主要步骤:①固 定: PBS润洗细胞,随后加入4 % PFA室温固定10 min,再次用PBS润洗。②染色: 配置试剂一应用液并加入培 养皿中,室温染色10 min,用37 ℃蒸馏水润洗。③核染 色:加入苏木精,染色30 s后用蒸馏水润洗。④镜检: 用显微镜观察并拍照。
1.2.5 统计学分析
以“平均值±标准差”的形式表现试验结果,采用 one-way ANOVA对各组间的试验结果进行显著性差异分 析。其中ns表示无显著性差异, *表示P ≤0.05 ,**表示 P≤0.01 ,***表示P≤0.001 ,****表示P≤0.0001.统计 分析在GraphPad Prism 8软件中进行。
2 结果
2.1 不同酶消化法提取原代猪肝细胞数量和存活率比较
经4 种不同的酶消化后均可获得肝实质细胞。其中,胰蛋白酶消化时间相对短且易形成糜状, 其余3种 胶原酶消化后形成软化的小肝组织块。胰蛋白酶消化提 取的肝细胞在管底的沉淀较为松散,其余3种胶原酶消 化提取的肝细胞沉淀紧实,见图1.
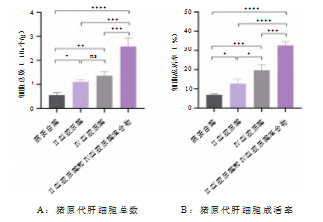
经台盼蓝染色后用全自动流式细胞计数仪进行检测, 结果显示胶原酶混合物消化后提取的肝细胞数量最多且 成活率最高,胰蛋白酶法获取的肝细胞总数最少且成活 率低。使用Ⅱ型、Ⅳ型胶原酶提取的肝细胞总数相近, Ⅳ型胶原酶提取的细胞成活率高于Ⅱ型胶原酶,见图2.
2.2 猪原代肝细胞形态学观察
接种6 h后,可见胰蛋白酶消化提取的肝细胞分布均 匀,但贴壁率较低,细胞显示出皱缩的趋势,见图3A 。 Ⅱ型、Ⅳ型胶原酶提取的肝细胞形态上无明显差异,大 部分细胞呈多边形形态,细胞边界清晰。相较于Ⅱ型胶 原酶,Ⅳ型胶原酶提取的肝细胞贴壁率较高,见图3B 、 3C。胶原酶混合物消化获取的肝细胞分布均匀,大部分 细胞呈较为规则的圆形,见图3D。

2.3 猪原代肝细胞鉴定
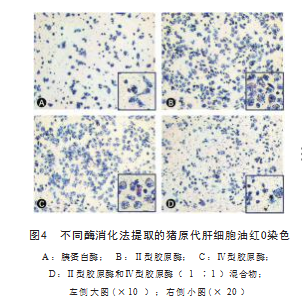
油红O染色结果显示这4种不同的酶消化法均能获得 有功能的肝细胞。肝细胞胞质内可见大量着色为鲜红色 的脂滴,并呈均质或颗粒状分布;细胞核为蓝色,见图 4.胰蛋白酶、胶原酶混合物消化获取的肝细胞胞质空 间小,但仍见脂滴的存在,见图4A 、4D 。使用Ⅱ型、 Ⅳ型胶原酶提取的肝细胞胞质内蓄积大量红色脂滴,见 图4B 、4C。
3 讨论
获取大量形态完整、有活性的猪肝细胞为进一步深 入了解PCV的致病机制,预防和治疗PCVD奠定基本的 生物学基础。国内外研究者经过多年的研究建立了多种 提取原代肝细胞的方法,这些方法各有优劣。本实验采 用简便、快速、经济、无需特殊设备、仅需部分肝组织 的离体酶消化法,比较4种不同的酶消化法提取猪原代 肝细胞的效果。
胰蛋白酶作为一种丝氨酸蛋白水解酶,主要通过水 解细胞间的蛋白质从而离散细胞。胶原蛋白是细胞外基 质的主要成分,然而因其稳定保守的三维螺旋结构而难 以被普通蛋白酶降解。胶原酶则可以通过特异性地水解 胶原蛋白,从而温和地释放单个细胞而不损伤其它蛋白 质和组织。其中,Ⅱ型胶原酶相较于Ⅳ型胶原酶有更高 的胰蛋白酶和梭菌蛋白酶活性。
这4种酶消化法均能获得有功能的肝细胞。胰蛋白 酶提取获得的肝细胞总数最少且存活率最低,肝细胞形 态皱缩,状态不佳。Ⅱ型、Ⅳ型胶原酶提取的肝细胞总 数均为接近1.3 × 106个/g。Ⅳ型胶原酶提取的肝细胞存活 率高于Ⅱ型胶原酶,两者提取的肝细胞排列整齐、边界 清晰。胶原酶混合物消化可获得最多的肝细胞和最高的 存活率,但胞质浓缩,呈较为规则的圆形。在提取过程 中需注意,无论使用何种酶消化,均需要精细地控制酶 的用量、消化时间和温度,避免因消化不充分或过度消 化影响肝细胞的得率和活性。
与使用胰蛋白酶相比,胶原酶消化更容易获取大量 有活性的肝细胞,这可能与酶的作用机制相关。但胰蛋 白酶价格低廉,若能更好的把握消化的时间和程度,也 不失为一种更经济的猪肝细胞获取方案。
参考文献
[1] 吴德铭,曹永长,毕英佐.猪圆环病毒研究进展[J] . 中国预 防兽医学报, 2004( 1 ):79-82 .
[2] 朱新文,高燕,孙超,等.猪圆环病毒的诊断与防控[J] . 山 东畜牧兽医, 2023 ,44( 12 ):53-54 .
[3] Krakowka S ,Ellis J ,Mcneilly F ,et al .Features of cell degeneration and death in hepatic failure and systemic lymphoid depletion characteristic of porcine circovirus-2-associated postweaning multisystemic wasting disease[J] .Veterinary Pathology ,2004 ,41( 5 ):471-482 .
[4] Sinha A ,Schalk S ,Lager K M ,et al . Singular PCV2a or PCV2b infection results in apoptosis of hepatocytes in clinically affected gnotobiotic pigs[J] .Research in Veterinary Science , 2012 ,92( 1 ): 151-156 .
[5] 徐雅玲,黄巨恩,刘华刚.体外原代肝细胞分离培养方法的比较[J] .广西医科大学学报, 2011 ,28( 1 ): 158-160 .










