1株5型副猪格拉菌的分离鉴定及生物学特性研究论文
2024-05-09 14:43:18 来源: 作者:zhoudanni
摘要:副猪格拉菌(Glaesserellaparasuis ,Gps),原名副 猪嗜血杆菌(Haemophilus parasuis ,Hps ),是猪上呼 吸道中的一种共栖菌,常定植在猪的鼻腔、扁桃体和气 管前段,在免疫力降低及应激条件下引起副猪格拉菌病,又称猪格拉瑟病[1] 。副猪格拉菌的血清型很多,根 据目前的血清分型方法可分为15种血清型[2] 。在我国, 通常认为血清4 、5 、12 、13和15型为优势血清型。不同 地区流行的血清型不一,且不同血清型之间缺少良好的 交叉保护[3] 。不同地区分离的菌
摘要: 副猪格拉菌是猪的一种重要病原菌, 给世界养猪业带来较大的危害和经济损失。开展副猪格拉菌的分离鉴定及特性 分析研究工作,有助于为临床诊断治疗及预防提供依据。该试验对临床发病的仔猪病料进行细菌分离培养鉴定,采用革兰 氏染色、生化鉴定、 PCR扩增、测序比对、遗传进化分析、基因分型等方法对分离菌株进行鉴定分析,同时对其进行药敏 试验及致病性研究。结果显示,分离得到副猪格拉菌, 同源性分析结果显示该菌株与副猪格拉菌不同参考菌株之间的相似 性介于92.3% ~ 95.6%,基因分型显示分离株为基因型5型。分离菌株对多西环素、阿莫西林敏感,对新霉素、泰乐菌素、 复方新诺明和头孢噻吩耐药。小鼠致病性试验显示其具有致病性。本试验相关结果为副猪格拉菌临床防控及治疗提供理论依据。
关键词: 副猪格拉菌,分离,鉴定,药敏试验,致病性
0 引言
副猪格拉菌(Glaesserellaparasuis ,Gps),原名副 猪嗜血杆菌(Haemophilus parasuis ,Hps ),是猪上呼 吸道中的一种共栖菌,常定植在猪的鼻腔、扁桃体和气 管前段,在免疫力降低及应激条件下引起副猪格拉菌病,又称猪格拉瑟病[1] 。副猪格拉菌的血清型很多,根 据目前的血清分型方法可分为15种血清型[2] 。在我国, 通常认为血清4 、5 、12 、13和15型为优势血清型。不同 地区流行的血清型不一,且不同血清型之间缺少良好的 交叉保护[3] 。不同地区分离的菌株的耐药性及毒力往往存在差异,增加了副猪格拉菌病治疗与预防的难度。因 此,及时准确了解引起仔猪的发病病原的种类、耐药种 类及致病性,为科学准确的预防及治疗提供依据显得格 外重要。本试验采集某养殖场发病仔猪病料,进行细菌 分离鉴定,并对分离菌株进行药敏试验、进化分析及致病 性研究,以期为副猪格拉菌的治疗及预防提供科学依据。
1 材料与方法
1.1 病料来源
山东某规模化猪场临床疑似副猪格拉菌发病仔猪, 采集肺脏、脾脏、心包液等组织器官,进行细菌分离培养。
1.2 主要试剂
TSA 、TSB培养基购自美国BD公司;无菌脱纤维 绵羊血购自南京森贝伽生物科技有限公司; DNA Maker (DL2000 )、2 ×EasyTaq PCR SuperMix购自北京全式 金生物公司;细菌DNA提取试剂盒购自天生生物公司; 革兰氏染色液购自青岛海博生物技术有限公司;新生牛 血清购自金源康生物工程有限公司;药敏片购自杭州滨 和生物有限公司;引物及测序工作由生工生物工程(上 海)股份有限公司合成。
1.3 主要仪器
二氧化碳恒温培养箱购自赛默飞世尔科技公司;高 压灭菌器购自上海博讯实业公司; PCR扩增仪购自朗基 生物;凝胶成像仪购自伯乐生命医学产品(上海) 有限 公司;普通光学生物显微镜购自江苏舜宇生物公司。
1.4 细菌分离
无菌采集发病猪肺脏组织,用接种环分别三区划线 接种到TSA(含10%新生牛血清和0.002% NAD)培养基 上,37 ℃, 5%二氧化碳培养箱中培养24 h后,观察菌落形态,挑取单菌落纯化培养。对纯化培养的菌落进行革 兰氏染色观察。
1.5 卫星试验及生化鉴定
将金黄色葡萄球菌在5%脱纤绵羊血平板中间做直线 划线,同时挑取纯化单菌落垂直金黄色葡萄球菌划线接 种, 37 ℃ 5%二氧化碳培养箱中培养24 h后,观察靠近 金黄色葡萄球菌菌落生长良好,远离金黄色葡萄球菌无 菌落生长。同时对分离菌株进行生化鉴定。
1.6 细菌16S rRNA比对、同源性分析及进化树构建
用细菌16S rRNA通用引物[4] (见表1 )扩增分离菌 株16s rRNA基因序列,引物由上海生工生物工程有限公 司合成。 PCR体系25 μL ,反应条件: 94 ℃ 预变性 5 min;94 ℃ 1 min ,52 ℃ 30 s ,72 ℃ 1 min ,32个循 环; 72 ℃ 延伸10 min。结束后,取5 μL扩增产物用1% 的琼脂糖凝胶进行电泳检测。扩增产物送上海生工生物 工程有限公司测序。测序结果在NCBI上进行比对。同 时用MegAlign软件,参照文献[5]对分离的菌株进行PCR 扩增, 16S rRNA序列与GenBank上公布的不同血清型菌 株16S rRNA序列进行遗传进化分析,绘制系统进化树。

1.7 血清型鉴定
根据Howell K J等[5]报道提供4型及5型引物进行血 清型分型检测,引物序列见表2 。PCR反应条件如1.6部 分,产物经1%的琼脂糖凝胶进行电泳检测。
1.8 药敏试验
用接种环挑取单个菌落采取密集划线的方法接种于 TSA培养基(含10%新生牛血清和0.002% NAD)。选取 多西环素、阿莫西林、氟苯尼考、新霉素、泰乐菌素、 复方新诺明、头孢噻吩等,用K-B纸片琼脂扩散法[6]进 行药敏试验,于37 ℃、 5%二氧化碳培养箱中培养24 h 后,根据抑菌圈直径判定菌株对所选药物的敏感程度。
1.9 致病性试验
将40只KM小鼠分为4组,每组10只,攻毒菌液分别 为3.0 × 109 、2.0 × 109 、1.0 × 109 CFU/只进行腹腔注射攻毒, 0.2 mL/只,同时设置PBS对照组。连续观察7 d,记 录每组小鼠的死亡情况。
2 试验结果
2.1 病猪剖检结果
对发病仔猪进行剖检,可见腹腔纤维素性渗出并且 与腹腔黏连,肝脏及脾脏纤维素膜包被,腹腔积水,见 图1.
2.2 分离培养观察结果
分离得到疑似菌落,经纯化培养,在TSA平板(含 10%新生牛血清和0.002% NAD)上形成针尖大小、圆润光滑、半透明的菌落。革兰氏染色镜检观察到革兰氏阴 性、短杆状、球状等多形态菌体,见图2、图3.
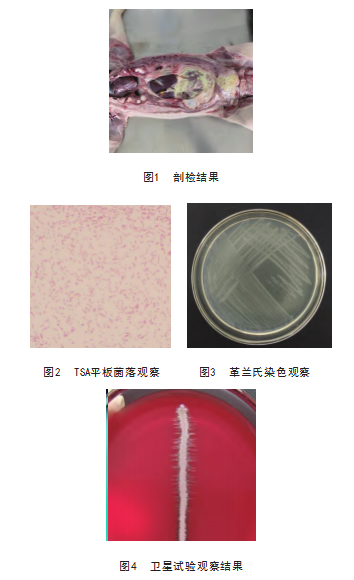
2.3 生化鉴定及卫星试验结果
生化鉴定显示该分离株不溶血;脲酶试验、氧化酶 试验、吼哚试验均阴性,并且接触酶、葡萄糖、麦芽 糖、蔗糖、果糖、核糖、半乳糖、硝酸盐还原均阳性, 符合副猪格拉菌生化特性;卫星试验观察可知靠近金黄 色葡萄球菌菌落较大,远离金黄色葡萄球菌菌落较小, 甚至无菌生长,见图4.
2.4 细菌16S rRNA比对、同源性分析及进化树构建
使用16S rRNA引物, 扩增产物电泳观察到预期条 带1 465 bp,见图5.测序结果运用MegAlign软件分析, 运用Clustal V算法将序列与GeneBank中的参序列进行比 对,并绘制和分析遗传进化树。结果表明,所测得的菌 株序列与参考序列的同源性为92.3% ~ 95.6%,见图6 。 该分离株与2株血清5型菌株构成1个分支,见图7.

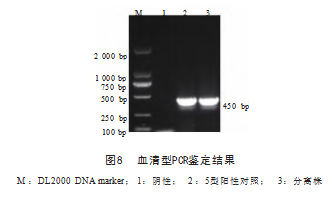
2.5 血清型PCR鉴定结果
运用分型引物进行PCR鉴定,扩增产物经电泳后观 察到450 bp条带(见图8 ),与血清5型菌株条带一致, 说明分离得到5型菌株,与16S rRNA分析结果一致。鉴 定结果与我国副猪格拉菌流行血清型一致[7]。
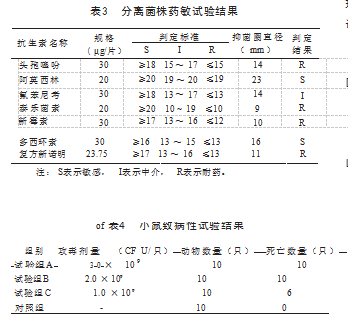
2.6 药敏试验结果
分离菌株药敏结果显示,该菌株对多西环素、阿莫 西林敏感,对新霉素、泰乐菌素、复方新诺明、头孢噻 吩耐药,见表3.
2.7致病性试验结果
小鼠致病性试验结果显示,小鼠攻毒后均出现食欲减退、炸毛等不良症状。其中,该菌最小致死剂量在2.0 x 10°CFU/只:对照组小鼠健康存活,见表4.将死亡的小鼠剖检后进行细菌分离鉴定鉴定,证明为5型副猪格拉菌,说明该前具有致病性.
3 讨论和结论
副猪格拉菌是仔猪呼吸道常在菌,是导致副猪格拉菌病的病原体,主要引起猪的脑膜脑炎、多浆液炎、多关节炎和肺炎的各种组合为特征的全体性疾病".Sun Q等[对我国2017-2021年引起猪呼吸道疾病的病原学调查与分析结果表明。引起猪的呼吸道疾病的主要细菌病原菌之一为副猪格拉菌,且经常与猪圆环病毒及猪繁殖与呼吸道病毒等免疫抑制病混合感染,给疾病预防及治疗增加困难,根据副猪格拉菌现有血清分型方法可分为15种血清型,不同地区血清型流行不同,北美地区主要为1、4.5、13、7型:荷兰地区1、2、4、5、13型:巴西地区主要为4、5、14、13、2型“1:根据相关研究,在我国的主要流行血清型为4、5、12、13型“11.本研究从发病仔猪中分离到1株疑似菌株,通过测序对序列进行同源性及进化分析确定分离到1株5型副猪格拉菌,与相关研究结果一致,说明目前流行的血清型仍主要为4型及5型相关血清型。
不同菌株对抗生素的敏感性不同。本研究对分离菌株进行药敏试验及致病性试验研究。药敏试验显示,该分离株对多西环素、阿莫西林敏感,对新霉素、泰乐菌 素、复方新诺明、头孢噻吩耐药。而徐引弟等[12]研究, 副猪格拉菌对头孢噻吩敏感。提示临床用药需要根据实 验室相关结果选择敏感药物,防止耐药菌株的不断出 现。本研究对该菌株进行小鼠致病性试验,试验结果表明 该菌株具有致病性,可对其进行进一步免疫原性研究。
参考文献
[1] Ma L. Wang L. Chu Y, et al. Characterization of Chinese Haemophilus parasuis Isolates by Traditional Serotyping and Molecular Serotyping Methods[J] Plos One, 2016.11(12):e0 168 903.
[2 Kieistein P. Kapp-Gabrielson V J. Designation of 15 serovars of Hasmophilusparasuis on the basis of immunodiO usion using heat- stable antigen extracts[J].JClin Microbiol. 1992.30 (4):862-865.
[3]张宁, 郭旋,刘德清,等,规模化猪场两种副猪嗜血杆菌瘦苗的免疫效果比较[J]养猪,2013(6),116-117.
[4] Lane DJ. 16S/23 SrRNA Sequencing[M]. New York: NucleicAcid Techniques in Bacterial Systematic.1991.
[5]Howell K J. Peters S E. Wang J . et al . Developmgnt ofa Multiplex PCR Assay for Rapid Molecular Serotyping of Harmophilus parasuis[J]. Journal of Clinical Microbiology,2015.53(12):3812-3 821.
[6]王亚霞。苏振杰,任凤秋,K-B纸片琼脂扩散法检测细菌药物敏感试验的影响因素分析[J],中国医药指南,2009.7(5):41-42.
[7]于江, 吴家强,张玉玉,等、副猪嗜血杆菌的分离与血清型鉴定J]、家畜生态学报,2014.35(4):64-66.96.
[8]Zhang P. Zhang C. Aragon V . et al. Investigation ofHaemophius parasuis from healthy pigs in China[J]-VeterinaryMicrobiology, 2019.231.40-44.
[9]Sun Q・ YuXX. He DX- etal. Investigation and analyais of etialogy associated with porcine respiratory disease complex in Chinafrom 2017 to 2021[J].Front Vet Sci,2022.11(9):960 033.
[10]Macedo N.Goutschalk M.Strutzberg- Minder K . et al.Molecular characterization ofGlaesserelloparasuis strains isolated from North America. Europe and Asia by serotyping PCR and LS-PCR[J].Veterinary Research. 2021.52(1):68










