黄色瘤胃球菌木聚糖酶基因论文
2024-04-29 11:15:04 来源: 作者:zhoudanni
摘要:植物源木质纤维素是自然界中大量存在的可再生资源,其主要由纤维素、半纤维素和木质素构成。由于木植物源木质纤维素是自然界中大量存在的可再生资 质纤维素3种成分之间紧密连接,使得木质纤维素难以被降解,因此如何高效利用木质纤维素一直是研究的热点问题。
摘要:该试验以黄色瘤胃球菌基因组为模板,通过PCR扩增获得目的基因xynB ,将xynB与表达载体PET28a连接,获得重 组载体PET28a-xynB。用IPTG对含有重组载体的大肠杆菌BL21( DE3 )进行诱导表达,镍离子层析柱纯化后检测其酶学性 质。生物信息学分析表明, XynB理论大小为47 kDa,预测等电点为4.49.不含信号肽,含有1个糖苷水解酶11家族结构域 和1个碳水化合物结合结构域。酶学性质研究结果表明, 该酶的最适pH值为5.0 ,最适反应温度为40 ℃, 金属离子Mg2+ 、 Na+ 、K+和Ba2+对木聚糖酶XynB有较好的激活效果。综上可知,黄色瘤胃球菌木聚糖酶XynB属于GH11家族,最适pH值为 5.0.最适温度为40 ℃,酶比活力为62.94 U/mg。
关键词: 黄色瘤胃球菌,木聚糖酶,xynB,异源表达,酶学性质
0 引言
植物源木质纤维素是自然界中大量存在的可再生资源,其主要由纤维素、半纤维素和木质素构成。由于木植物源木质纤维素是自然界中大量存在的可再生资 质纤维素3种成分之间紧密连接,使得木质纤维素难以被降解,因此如何高效利用木质纤维素一直是研究的热 点问题。瘤胃作为反刍动物的消化器官,是迄今已知 的、降解转化木质纤维素效率最高的天然体系。其中, 瘤胃内纤维降解菌及其产生的纤维素酶与半纤维素酶在 木质纤维素降解方面发挥着重要作用[1] 。黄色瘤胃球菌 是瘤胃中最主要的纤维降解菌之一,具有高效的纤维降 解能力[2] 。先前研究发现,黄色瘤胃球菌可以编码产生 多种纤维素酶、半纤维素酶和多功能酶类,这些酶类通 过高度的协同作用能够降解棉花、滤纸等纤维原料[3-4] , 是重要的木质纤维素降解酶来源之一。
木聚糖酶属于糖苷水解酶,主要用于半纤维素木聚 糖主链的降解,其在饲料业、食品工业、造纸行业和纺 织行业均具有广泛的应用前景。目前,已经探明有超过 300多种生物可以产生木聚糖酶,这些酶类在作用底物 范围、最适pH值、最适温度、稳定性等方面均有其独特 性,并具有一定的潜在应用价值[5] 。黄色瘤胃球菌拥有 较为丰富的木聚糖酶基因资源,其中黄色瘤胃球菌FD-1 基因组中含有12个编码木聚糖酶的基因[6] ,黄色瘤胃球 菌17含有至少4个编码木聚糖酶的基因[7]。
为进一步拓展木聚糖酶资源,了解黄色瘤胃球菌半 纤维素酶系特性,本研究拟对黄色瘤胃球菌中的木聚糖 酶基因xynB进行生物信息学分析,并将其在大肠杆菌 BL21中进行异源表达与酶学性质研究。
1 材料与方法
1.1 菌株与质粒
黄色瘤胃球菌为本实验室先前保存菌株,载体 PET28a、大肠杆菌DH5α和BL21( DE3 )均购自北纳创 联生物技术有限公司。
1.2 基因序列分析与重组载体构建
利用在线分析网站RA ST( https: / / ra st . n mpdr . org/ )进行全基因组注释,根据注释结果选取木聚糖 酶基因xynB作为异源表达对象。利用Expasy( https:// web.expasy.org/)预测木聚糖酶XynB的等电点以及蛋 白理论分子质量。利用SignalP 4.1 ( https://services. healthtech.dtu.dk/services/SignalP-4.1/)分析XynB的 信号肽编码序列。利用NetOGlyc-4.0( https://services. healthtech.dtu.dk/services/NetOGlyc-4.0/)预测XynB 的O-糖基化位点。利用NetNGlyc-1.0( https://services. healthtech.dtu.dk/services/NetNGlyc-1.0/)预测XynB 的N-糖基化位点。利用Group-based prediction system ( https://gps.biocuckoo.cn/ )预测XynB的磷酸化位点。 利用PSIPRED( http://bioinf.cs.ucl.ac.uk/psipred )预测 XynB的蛋白二级结构。利用SWISS-MODEL( https:// swissmodel.expasy.org/)预测XynB的蛋白三级结构。 以黄色瘤胃球菌基因组为模板,用引物对( xy n BF:CGGAATTCATGAGAAAAGGCATATTCAAGAAA和xynBR: CCGCGGCCGCGCCTGCTTCCTTTTCGGCAGC- TAC)进行扩增获得基因片段xynB。对基因片段xynB和 载体PET28a分别进行双酶切(EcoRI与NotI),将酶切 后的产物进行连接转化,获得重组载体PET28a-xynB。
1.3 木聚糖酶在大肠杆菌中的诱导表达与纯化
将1 L诱导后的大肠杆菌菌液离心,收集菌体, 将 菌体沉淀重悬于50 mL预冷Tris-NaCl缓冲液中,用超声 波破碎菌体。超声破碎条件:振幅50%,工作2 s,间隔 4 s,工作总时间为15 min。将破碎后的菌体12 000 r/min 离心30 min, 收集上清。将上清液过0.22 μm 水系微孔滤 膜,用镍离子预装层析柱(HisTrap HP ,GE公司)进行 纯化。将收集的洗脱液透析过夜,获得纯化酶液,并用 Nanodrop 2000进行蛋白浓度测定。吸取上清液与纯化酶 液制备蛋白样品,进行SDS-PAGE检测。
1.4 木聚糖酶酶学性质分析
1.4.1 木聚糖酶XynB最适pH值及pH值稳定性
将纯化后的木聚糖酶XynB与不同pH值的缓冲液 (pH值 3.0 ~ 5.0的0.2 mol/L 醋酸—醋酸钠缓冲液, pH值6.0 ~ 8.0的0.2 mol/L 磷酸氢二钠—磷酸二氢钠 缓冲液, pH值 9.0的0.2 mol/L Tris-HCl缓冲液 ,pH值 10.0~ 11.0的NaHCO3-NaOH缓冲液)稀释后,与1%的 桦木木聚糖底物溶液混合, 在40 ℃条件下反应30 min , 反应结束后,以DNS法检测还原糖的产量。酶活性单位 定义为每分钟催化产生1 µmol还原糖的酶量。将酶活性 最高值设为100%,以相对酶活力来判断木聚糖酶XynB 最适pH值。木聚糖酶XynB的pH值稳定性检测方法为将 纯化后的酶液分别置于不同pH值的缓冲液中, 在40 ℃ 条件下温育60 min,取出酶液,测定其剩余木聚糖酶活 力。其中,未处理酶液酶活设为100%,以相对酶活力 判定木聚糖酶XynB的pH值稳定性。
1.4.2 木聚糖酶XynB最适温度与温度稳定性
将纯化后的木聚糖酶XynB在30~ 60 ℃条件下(温 度间隔为5 ℃ )于pH值6.0缓冲液中反应30 min,将酶 活性最高值设为100%,以相对酶活力来判断木聚糖酶 XynB最适反应温度。木聚糖酶XynB的温度稳定性检测 方法:将纯化后的酶液分别置于20 ~90 ℃ (温度间隔为 10 ℃ ) 条件下温育60 min, 取出酶液, 测定其剩余木聚 糖酶活力。其中未处理酶液酶活设为100%,以相对酶 活力判定木聚糖酶XynB的温度稳定性。
1.4.3 木聚糖酶XynB底物特异性
将纯化后的木聚糖酶XynB,分别以CMC-Na、滤 纸、对硝基苯 - β -D-木糖苷、对硝基苯 - β -D-葡萄糖 苷、对硝基苯- β-D-半乳糖苷、对硝基苯-α-D-甘露糖 苷、对硝基苯-α-L-岩藻糖苷、对硝基苯-α-L-阿拉伯糖苷为底物,测定木聚糖酶XynB酶活性。其中,以桦木 木聚糖为底物测出的酶活力定义为100%。
1.4.4 金属离子对木聚糖酶XynB的影响
在木聚糖酶反应体系中分别加入金属离子溶液 ( CaCl2 、MgCl2 、MnCl2 、ZnCl2 、FeCl 3 、CuSO4 、 BaCl2 、NiCl2 、CoCl2 、KCl 、NaCl 、EDTA),使其终 浓度为1 mmol/L和10 mmol/L,最适温度下孵育60 min 后,测定酶活力。其中,不加金属离子的反应体系为对 照,其酶活力设为100%。

2 结果
2.1 木聚糖酶XynB的生物信息学分析
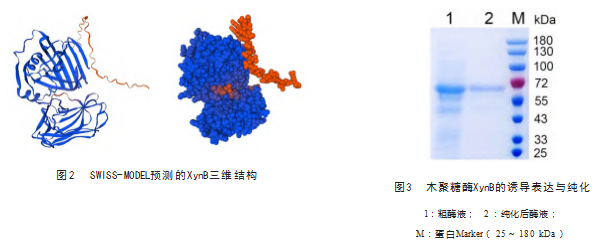
木聚糖酶XynB( Sequence ID: WP_082316660.1 )共由425个氨基酸组成,预测等电点为4.49.不含信 号肽,蛋白理论大小为47 kDa。使用NCBI Conserved Domains 分析发现, XynB含有一个糖苷水解酶11家族 结构域(氨基酸残基48-236)和一个碳水化合物结合结 构域( Carbohydrate-binding modules ,CBM,氨基酸残 基276-409 )。 SIPRED分析结果显示,该蛋白二级结果 中,α-螺旋占比最少, 为8.94%(粉色),β-折叠占比 为39.06% (黄色),无规则卷曲占比为52% (灰色), 见图1 。SWISS-MODEL预测的XynB三维结构由3个α - 螺旋(红色)和26个β-折叠(蓝色)组成,见图2.其 中, N段α-螺旋位于蛋白主体结构外侧,另外2段α-螺 旋则位于蛋白主体中间凹陷处。
2.2 木聚糖酶XynB的诱导表达与纯化
将含有重组质粒的大肠杆菌BL21进行诱导,收集 菌体后破碎,获得粗酶液。将粗酶液过滤,经镍柱纯化 后,透析获得木聚糖酶XynB纯蛋白。经SDS-PAGE电 泳发现,粗酶液与纯化后酶液在70 kDa大小处有蛋白条 带,其条带大小比理论值( 47 kDa) 偏大, 见图3.糖 基化修饰预测结果表明,蛋白序列在第269 、271 、275 位苏氨酸( Thr)和272位丝氨酸( Ser),存在O-糖基 化位点,在42位和101位天冬酰胺(Asn)存在N-糖基化 位点。磷酸化修饰预测结果表明, XynB存在35个潜在的 磷酸化位点( 8个丝氨酸位点, 11个苏氨酸位点和16个 酪氨酸位点)。这些潜在糖基化和磷酸化位点的存在, 可能导致木聚糖酶XynB理论大小与实际大小间的差异。
2.3 木聚糖酶XynB酶学性质分析
2.3.1 木聚糖酶XynB最适pH值及pH值稳定性
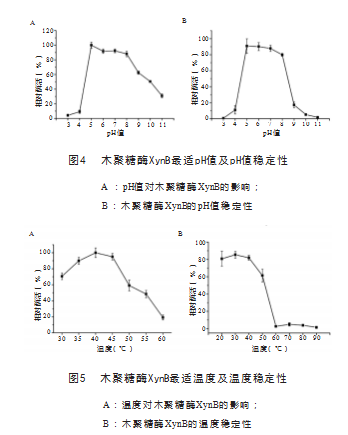
首先,测定木聚糖酶XynB在不同pH值条件下的酶 活力变化,并绘制变化曲线,见图4A。结果表明,木 聚糖酶XynB的最适反应pH值为5.0.并在pH值6.0~ 8.0 的条件下有较好的酶活性( >80%)。图4B展示了木聚 糖酶XynB在不同pH值条件下的稳定性,当pH值<5.0 或pH值>8.0时,残余酶活力均降至20%以下; 在pH值 5.0~ 8.0弱酸或弱碱条件下, 木聚糖酶XynB仍保持80% 以上的酶活力。
2.3.2 木聚糖酶XynB最适温度及温度稳定性
如图5A所示,在30~ 60 ℃条件下,木聚糖酶XynB 最适温度为40 ℃。温度稳定性方面,木聚糖酶XynB在 20 ~40 ℃条件下孵育60 min,仍可以保留80%以上的酶 活力;在50 ℃条件下可以保留61.38%的酶活力;当温 度达到60 ℃或以上时,酶活力迅速下降,剩余酶活力均 在10%以下,见图5B。
2.3.3 金属离子对木聚糖酶XynB的影响
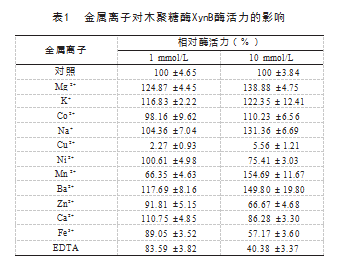
金属离子影响试验表明,低浓度( 1 mmol/L ) 的 Mg 2+ 、 K + 和 Ba 2+ 对木聚糖酶 XynB 的激活效果比 较明显,为 116.83% ~ 124.87%,而低浓度的Cu2+ 、 Mn 2+ 、 Fe 3+ 和EDTA 则对XynB 有较明显的抑制作用 ( 2.27%~ 89.05% )。高浓度( 10 mmol/L )金属离子 对XynB酶活力影响结果表明, Mg2+ 、K+ 、Co2+ 、Na+ 、 Mn 2+ 和Ba2+对木聚糖酶XynB有较明显的激活作用, Cu2+ 、Ni2+ 、Zn2+ 、Ca2+ 、Fe3+和EDTA则有较明显的抑制 效果,见表1.
2.3.4 木聚糖酶XynB底物特异性
底物特异性试验结果表明,除木聚糖外, XynB 对CMC-Na、滤纸、对硝基苯 - β -D-木糖苷、对硝基 苯- β-D-葡萄糖苷、对硝基苯- β-D-半乳糖苷、对硝基 苯-α-D-甘露糖苷、对硝基苯-α-L-岩藻糖苷、对硝基 苯-α-L-阿拉伯糖苷均没有酶活力。其中,以木聚糖为 底物,在最适温度与pH值条件下,木聚糖酶XynB的比活力为62.94 U/mg。
3 讨论
木聚糖酶属于糖苷水解酶( GH )家族,其大部 分成员集中于GH10和GH11家族[8-9] ,少量成员分布于 GH5 、7 、 8 、 16 、43 、52和62家族[10] 。本研究异源表 达的黄色瘤胃球菌木聚糖酶XynB属于GH11家族,该酶 的理论等电点为4.49.蛋白理论大小为47 kDa,共含有 2段特殊结构域( G11家族结构域和CBM结构域),仅 对木聚糖具有降解能力。该酶的这些特点符合GH11家 族木聚糖酶的底物特异性高、蛋白分子量较低、等电 点一般位于3.0~ 7.0.蛋白结构相对简单的特点 [11] 。此 外, SDS-PAGE电泳结果显示,木聚糖酶XynB的实际大 小( 70 kDa)比理论值( 47 kDa)偏大,这可能是由于 XynB在表达之后发生糖基化、磷酸化等修饰,导致蛋 白迁移率下降。
酶分子的温度与pH值特征对于其今后的应用十分 重要。在温度对酶活力影响方面, XynB的最适酶活力 为40 ℃,同时,温度耐受性试验结果表明XynB在40 ℃ 及以下时,剩余酶活力在80%以上,而当温度超过60 ℃ 时,其剩余酶活力则迅速降至10%以下。以上特征与 先前报道的低温酶的经典特征相一致[12] 。在pH值适应 性方面, XynB的最适pH值为5.0.在pH值6.0~ 8.0的区 间内,可以维持80%以上的最大酶活力。与GH11家族 多数木聚糖酶最适pH值为6.5~ 7.5相比, XynB的最适 pH值偏低,但与GH11家族中枯草芽孢杆菌( Bacillus subtilis )木聚糖酶MxynA[13]和Penicillium funiculosum木 聚糖酶XynC[14]相一致。在pH值稳定性方面, XynB在 pH值5.0~ 8.0的区间内,保持80%以上的酶活力,说明 该酶具有一定的耐酸、耐弱碱的能力。 XynB的酶学特 征揭示其非常适合在40 ℃ 、pH值5.0~ 8.0的环境下发挥 功能。如此的使用场景,常见于反刍动物瘤胃以及动物 消化道,以及食品行业中面制品的发酵。这些特性的研究, 对于今后该酶在饲料中以及食品加工中的应用奠定 了一定的基础。
金属离子的不同会影响酶活性的变化。 Yang Y等[15] 发现Penicillium chrysogenum P33来源的Xyl2的木聚糖 酶活性被K+ 、Na+激活,被Cu2+和Fe3+抑制,王蕾等[16]发 现黄色瘤胃球菌双功能酶XynD的酶活性被Co2+和Ba2+激 活,但被Fe3+ 和Mn2+抑制。本试验中,木聚糖酶XynB 的酶活性可被Mg2+ 、K+和Ba2+激活,并且高金属离子浓 度( 10 mmol)比低金属离子浓度( 1 mmol)的激活效 果更好,这些金属离子的存在可能促进了酶与底物的结 合;而Cu2+ 、Fe3+和EDTA则均有较明显的抑制效果,其 中Cu2+对XynB抑制效果最为明显(2.27%~5.56%),这些金 属离子可能影响木聚糖酶的空间结构进而使酶活力下降。
4 结论
本试验将黄色瘤胃球菌来源的木聚糖酶基因xynB进 行异源表达并进行酶学性质研究,研究发现, XynB最 适pH值为5.0.最适反应温度为40 ℃,金属离子Mg2+ 、 Na+ 、K+和Ba2+对木聚糖酶XynB有较好的激活效果,而 Cu2+ 、Zn2+ 、Fe3+和EDTA则对XynB有较明显的抑制作 用,是一株酸性低温木聚糖酶,在饲料以及食品加工领 域有一定的应用前景。
参考文献
[1] Bule P ,Alves V D , Israeli-Ruimy V , et al. Assembly of Ruminococcus flavefaciens cellulosome revealed by structures of two cohesin-dockerin complexes[J]. Scientific Reports ,2017.7 :759 .
[2] Dass a B , Borov ok I , Ruimy-Israeli V , et al. Rumen cellulosomics :divergent fiber-degrading strategies revealed by comparative genome-wide analysis of six ruminococcal strains[J] .PLoS One ,2014 ,9( 7 ):e99 221 .
[3] Krause D O ,Bunch R J , Smith W J M ,et al. Diversity of Ruminococcus strains :A survey of genetic polymorphisms and plant digestibility[J]. Journal Applied Microbiology , 1999 , 86( 3 ):487-495 .
[4] 刘玉承,侯先志,刘占英,等. 2 株瘤胃纤维降解细菌的分 离鉴定[J]. 微生物学杂志, 2007 ,27( 6 ): 1-4 .
[5] 叶世超,薛婷,何文锦,等.木聚糖酶的应用及其研究进展[J] . 中国酿造, 2013 ,32( 7 ): 8-10 .
[6] Berg Miller M E ,Antonopoulos D A ,Rincon M T ,et al .Diversity and strain specificity of plant cell wall degrading enzymes revealed by the draft genome of Ruminococcus flavefaciensFD-1[J]. PLoS One ,2009 ,4( 8 ):e6 650 .
[7] Flint H J ,Martin J ,McPherson C A ,et al. A bifunctional enzyme , with separate xy lana s e and beta( 1 , 3 - 1 ,4 )-glucan as e domains , encoded by the xynD gene of Ruminococcus flavefaciens[J]. Journal of Bacteriology , 1993.175( 10 ):2 943-2 951 .
[8] Hu X , Cui Y ,Lu X , et al. Maize WI5 encodes an endo-1 ,4-beta-xylanase required for secondary cell wall synthesis and water transport in xylem[J]. Integr Plant Biol ,2020 , 62 ( 10 ): 1 607-1 624 .
[9] Monica P , Kapoor M. Alkali-stable GH11 endo- β -1 , 4 xylanase( XynB )from Bacillus subtilis strain CAM 21 : application in hydrolysis of agro-industrial wastes , fruit/ vegetable peels and weeds[J]. Preparative Biochemistry & Biotechnology ,2021 ,51( 5 ):475-487 .
[10] Kumar V ,Dangi A K , Shukla P. Engineering Thermostable Microbial Xylanases Toward its Industrial Applications[J] . Molecular Biotechnology ,2018 ,60( 3 ):226-235 .
[11] Henrissat B ,Bairoch A. New families in the classification of glycosyl hydrolases based on amino acid sequence similarities[J] .Biochemical journal , 1993 ,293( Pt3 ):781-788 .
[12] Santiago M ,Ramfrez-Sarmiento C A ,Zamora R A ,et al . Discovery ,molecular mechanisms ,and industrial applications of cold-active enzymes [J]. Front Microbiol ,2016 ,7: 1 408 .
[13] Polsa N , Suyotha W , Suebsan S ,et al. Increasing xylanase activity of Bacillus subtilis by atmospheric pressure plasma jet for biomass hydrolysis[J]. 3 Biotech ,2020 , 10( 1 ): 1-9 .
[14] Furniss C S ,Belshaw N J ,Alcocer M J ,et al. A family 11 xylanase from Penicillium funiculosum is strongly inhibited by three wheat xylanase inhibitors[J]. Biochimica et Biophysica Acta ,2002 , 1 598( 1/2 ):24-29 .
[15] Yang Y , Yang J S , Wang R N , et al. Cooperation of hydrolysis modes among xylanases reveals the mechanism of hemicellulose hydrolysis by Penicillium chrysogenum P33[J] .Microbial Cell Factories ,2019 , 18( 1 ): 159 .
[16] 王蕾,李文菁,杨东林,等. 黄色瘤胃球菌双功能酶xynD 基因在毕赤酵母中的表达及其酶学特征[J]. 南京农业大学学 报, 2023 ,46( 5 ):922-932 .










