小鼠不同泌乳期的乳腺组织形态学观察与分析论文
2025-09-10 17:45:58 来源: 作者:xuling
摘要:该研究旨在揭示FVB小鼠不同泌乳期乳腺组织的形态学变化。试验选取FVB小鼠不同泌乳期乳腺组织,运用HE和Masson染色观察和测量乳腺组织的形态组织学差异。
摘要:该研究旨在揭示FVB小鼠不同泌乳期乳腺组织的形态学变化。试验选取FVB小鼠不同泌乳期乳腺组织,运用HE和Masson染色观察和测量乳腺组织的形态组织学差异。结果显示,HE染色观察泌乳前期乳腺组织由大量的结缔组织和稀疏的乳腺导管构成,泌乳期腺泡结构清晰并有大量的乳汁,泌乳末期乳腺腺泡数量明显减少且管腔变小。Masson染色观察泌乳前期和末期胶原纤维大量分布于血管壁和乳腺导管壁,而泌乳期脂肪细胞也有少量分布。泌乳前期乳腺导管数量平均为5.61个/mm2,泌乳期导管数量增加至63.43个/mm2,泌乳末期导管数目减少为23.82个/mm2。乳腺导管直径在泌乳期平均达到39.89μm,泌乳前期和末期平均直径分别为25.58μm和8.52μm。小鼠乳腺随着妊娠和泌乳生理功能的改变,乳腺导管数量和直径呈周期性变化为深入研究乳腺生理功能和形态变化提供了重要的基础数据。
关键词:小鼠;乳腺;染色;测量分析
0引言
乳腺是雌性小鼠体内独有的组织器官,具有产生和分泌乳汁、哺乳幼崽并提供营养的重要功能[1]。乳腺腺泡细胞数量是判定小鼠乳腺发育水平的重要指标。小鼠发育至青春期乳腺组织中有一些萎缩或塌陷的腺泡及实心细胞索;且腺泡和小导管大多呈现为单层细胞结构,远未达到成熟的多层结构状态;该阶段乳腺维持在一种相对静止的生长状态,与机体其他器官生长和发育保持一致[2]。研究还发现腺泡细胞的成熟以及乳汁分泌的启动,主要发生在小鼠的妊娠期和哺乳期。妊娠期乳腺腺泡结构发育日臻成熟,内部细胞发生极化,为乳汁的合成和分泌做准备;而导管系统也伴随腺泡的成熟开始发育,其直径扩张与纵深分枝共同构建起一个复杂的网络,以便将合成的乳汁高效地传输至乳头供幼鼠吸食[3]。退化期腺泡开始萎缩,细胞进入静止状态,导管系统会跟随腺泡的衰退而收缩甚至闭锁,导致乳汁分泌量降低,导管可能会出现收缩现象甚至是部分闭塞。除此以外,乳腺组织的生长发育也受许多因素的调节,包括激素、生长因子、饮食等据报道,如添加油酸可以促进小鼠乳腺细胞增殖和乳腺发育,如赖氨酸和蛋氨酸可促进青春期小鼠乳腺发育[4-5]。
1材料与方法
1.1试验动物和材料
试验动物来自于新疆和田学院采购的SPF小鼠,共24只小鼠分为3组(8只泌乳前期、8只泌乳期和8只泌乳后期),取不同泌乳期小鼠乳腺组织,切割成为大小体积约为0.8 cm3,浸放于4%的多聚甲醛溶液,进行3~4 d的组织固定,制作石蜡块并保存。
1.2切片HE染色和Masson染色
HE(Hematoxylin-eosin staining)染色,二甲苯对组织切片样品进行脱蜡,下行梯度酒精逐步完成水的脱出,苏木精对细胞核着色,1%盐酸乙醇进行分化,酒精及二甲苯进行组织脱水和透明,中性树胶封片。Masson染色即丽春红酸性品红—苯胺蓝染色,按照正常操作步骤完成脱水、染色、透明和封片。上述制作的HE染色和Masson染色切片,在正置光学显微镜完成组织形态学观察并拍照。
1.3乳腺导管数量和导管直径测量
选取小鼠乳腺组织HE染色图片,随机选取大小相同的区域作为测量点,每个测量区域叠加一个矩形测量框,依据科学计数原则。将测量框内分为a和b 2个区域,只计数右侧或顶部相交的乳腺导管,具体如图1-Ⅰ(A、B和C)所示;而不计算与测量框架的左侧、底部相交的乳腺导管,如图1-Ⅰ(A、B和C)所示。此外,乳腺导管直径测量,选定测量区域方法如上,测量时每个乳腺导管测量2次,且测量轨迹相互垂直,如图1-Ⅱ(D、E和F)所示。
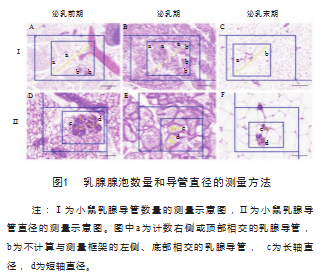
1.4数据统计与分析
测量数据采用SPSS 21.0软件进行统计并分析,结果呈现用“平均数±标准差”表示,样本之间的差异性采用统计学独立样本t检验;不同样本组间的相互差异分析用,采用单因素方差分析法(one-way ANOVA,LSD)。差异极显著标记P<0.01;差异显著标记P<0.05;差异不显著标记P>0.05。
2结果
2.1 HE染色观察
HE染色观察小鼠泌乳前期、泌乳期和泌乳末期乳腺形态组织学的变化。泌乳前期乳腺组织由大量的结缔组织和稀疏的乳腺导管构成,结缔组织主要是脂肪组织和细胞;并未观察到明显的乳腺小叶和腺泡结构(图2泌乳前期)。泌乳期腺泡结构清晰并有大量的乳汁,部分单层上皮细胞中有空泡,且少数上皮细胞呈现类似鞋钉的形状,腔内观察到大量的分泌物(图2泌乳期)。泌乳末期,乳腺腺泡数量明显减少、管腔变小,上皮细胞染色变浅,呈现出大量的脂肪细胞填充乳腺组织(图2泌乳末期)。
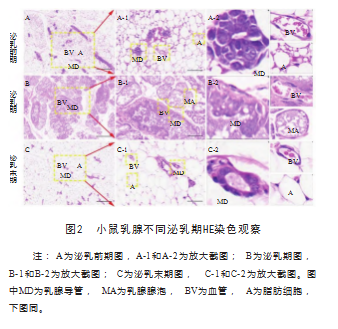
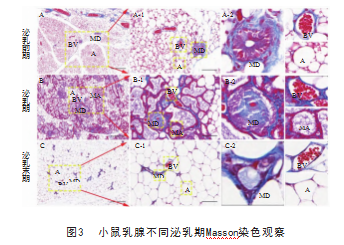
2.2 Masson染色观察
Masson染色观察小鼠泌乳前期、泌乳期和泌乳末期乳腺组织中胶原纤维的变化。泌乳前期胶原纤维大量分布于血管壁和乳腺导管壁,脂肪组织和细胞未见染色(图3泌乳前期)。泌乳期腺泡管壁、血管壁有大量的胶原纤维分布,且脂肪细胞也有少量分布(图3泌乳期)。泌乳末期胶原纤维分布和泌乳前期相似,主要分布在血管壁和乳腺导管壁(图3泌乳末期),脂肪细胞未见分布。
2.3乳腺导管数量和导管直径测量
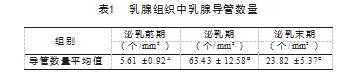
乳腺导管数量和导管直径测量按照图1-Ⅰ所示,根据引用文献计算方式进行科学统计。泌乳期乳腺导管数量明显多于泌乳前期和泌乳末期,平均数量为63.43个/mm2;泌乳前期乳腺导管平均数量为5.61个/mm2;泌乳末期乳腺导管平均数量为23.82个/mm2,相互之间均呈极显著差异(P<0.01),见表1。
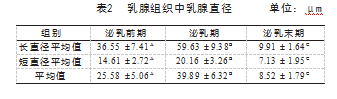
乳腺导管直径测量按照图1-Ⅱ所示,根据引用文献计算方式进行科学统计。泌乳期乳腺导管直径明显明显多于泌乳前期和泌乳末期,长直径和短直径分别为59.63μm和20.16μm;泌乳前期乳腺长直径和短直径分别为36.55μm和14.61μm;泌乳末期乳腺长直径和短直径分别为9.91μm和7.13μm;相互之间呈极显著性差异(P<0.01),见表2。
3讨论与结论
3.1乳腺导管HE染色和Masson染色组织学观察
乳腺发育和泌乳的不同阶段,小鼠乳腺导管的数量和形态呈现出显著的差异性。泌乳前期(青春期)为乳腺发育的起始阶段,乳腺组织伴随着乳腺干细胞的增殖和分化,促使乳腺导管数量逐渐增多且出现分支,上皮细胞形态由简单向复杂逐渐演化[6]。泌乳期由于催乳素、生乳素和皮质醇等相关激素的刺激,乳腺导管系统进一步发育,腺泡数量显著增加,腺泡上皮细胞处于高度活跃状态;导管数量增多、直径增大;但是如果被有毒物质侵袭,会导致泌乳期乳腺导管系统异常和紊乱,严重影响乳汁的分泌[7]。试验研究表明,FVB小鼠泌乳前期、泌乳期、泌乳末期乳腺导管结构的数量和形态展现出不同的特点,尤其是泌乳期腺泡结构清晰,部分单层上皮细胞中有空泡,且少数上皮细胞呈现类似鞋钉的形状,腔内观察到大量的分泌物。此外,泌乳前期和泌乳末期,胶原纤维大量分布于血管壁和乳腺导管壁,脂肪组织和细胞未见染色;而泌乳期腺泡管壁、血管壁有大量的胶原纤维分布,且脂肪细胞也有少量分布。已有研究报道泌乳前期导管周围的纤维组织较少,以利于乳腺腔的扩张与乳汁积累;而泌乳中后期,乳腺周期纤维组织会渐渐增多并逐渐增厚,为乳腺导管提供更好的支持与保护作用,同时也利于乳汁的持续分泌和乳腺的回缩[8]。因此,小鼠乳腺的发育与妊娠周期和次数密切相关,多次妊娠的乳腺腺泡系统相对较为发达,呈现雌激素及多种因素协同调控现象。
3.2乳腺导管数量及直径测量分析
乳腺是雌性动物体内一个重要的动态器官,在妊娠和哺乳循环过程中具有丰富的生理功能,如乳腺导管系统变化、腺泡的改变、上皮细胞的分泌等。该研究发现泌乳前期,乳腺导管数量偏少处于静息状态;泌乳期乳腺导管数量增多功能活跃;泌乳末期导管数量减少。Gabriela D T等[9]研究证实,人和小鼠的乳腺导管,未成年青春期乳腺处于静止状态,随着妊娠和泌乳功能越是旺盛其导管腺泡系统越发达,且与泌乳周期呈规律性变化。研究发现,泌乳前期乳腺导管直径较小,泌乳期乳腺导管直径增大且含有大量分泌的乳汁,泌乳后期乳腺导管直径显著收缩,周围被大量的脂肪细胞填充。泌乳期乳腺小叶明显增生,腺泡直径增大且处于极度扩张状态,腺上皮细胞成扁平状,腺泡内和导管内有大量的分泌乳汁存在[10]。小鼠乳腺随着妊娠和泌乳生理功能的改变,乳腺导管数量和直径呈周期性变化,分泌能力越是旺盛其数量越多直径越大,保障了幼崽的营养需求和生长发育。
参考文献
[1]Musumeci G,Castrogiovanni P,Szychlinska M A,et al.Mammary gland:From embryo-genesis to adult life[J].Acta Histochem,2015,117(4/5):379-385.
[2]Macias H,Hinck L.Mammary gland development[J].Wiley Interdiscip Rev Dev Biol,2012,1(4):533-557.
[3]Richert M M,Schwertfeger K L,Ryder J W,et al.An atlas of mouse mammary gland development[J].J Mammary Gland Biol Neoplasia,2000,5(2):227-241.
[4]Zhang J,Bu L J,liu Y P,et al.Dietary supplementation of sodium butyrate enhances lactation performance by promoting nutrient digestion and mammary gland development in dairy cows[J].Anim Nutr,2023,15:137-148.
[5]李峰,杨占清,周博文,等.蛋氨酸对青春期小鼠乳腺发育的影响及机制[J].中国兽医学报,2022,42(5):933-938,946.
[6]Plante I,Stewart M K G,Laird D W.Evaluation of mammary gland development and function in mouse models[J].Journal of Visualized Experiments Jove,2011(53):1-6.
[7]Gonzalo S M,Gabriela A A,Sofia O,et al.Branching morphogenesis of the mouse mammary gland after exposure to benzophenone-3[J].ToxicolAppl Pharmacol,2024,484:1-7.
[8]黄心河,李浩楠,周潇,等.植物雌激素大豆黄酮对小鼠乳腺上皮细胞乳成分合成和细胞增殖的影响及机制[J].畜牧兽医学报,2025,56(1):417-429.
[9]Gabriela D T,Tan A I.Of Mice and Women:A Comparative Tissue Biology Perspective of Breast Stem Cells and Differentiation[J].Journal of Mammary Gland Biology and Neoplasia,2015,20(1-2):51-62.
[10]李建国,孙庆元.“药味乳康罩”抑制小白鼠乳腺小叶增生病理组织学观察研究[J].河南中医,1993,13(3):111-112.










