鸡源奇异变形杆菌的分离鉴定、耐药性及生物被膜形成能力分析论文
2025-09-04 17:20:47 来源: 作者:xuling
摘要:为探究新乡地区某养殖场雏鸡腹泻病原菌,试验采集177份患腹泻雏鸡泄殖腔拭子样品,经细菌分离培养等方法,鉴定出21株奇异变形杆菌。
摘要:为探究新乡地区某养殖场雏鸡腹泻病原菌,试验采集177份患腹泻雏鸡泄殖腔拭子样品,经细菌分离培养等方法,鉴定出21株奇异变形杆菌。采用PCR及微量肉汤稀释法检测其毒力基因、耐药基因与耐药性,发现ucaA、ureC、rsbA、pmfA、atfA、zapA、hpmA和hpmB等毒力基因检出率在38.09%~100%;21株菌对多西环素等多种药物耐药严重,均为多重耐药菌株;喹诺酮类、β-内酰胺类及大环内酯类等多类耐药基因检出率在42.86%~76.19%,除多粘菌素类和四环素类外,耐药表型与基因型基本正相关,同时这些菌株生物被膜阳性率达100%。该研究成果为雏鸡腹泻奇异变形杆菌病的防控提供关键参考。
关键词:雏鸡;奇异变形杆菌;毒力基因;耐药性;生物被膜
0引言
奇异变形杆菌属革兰氏阴性肠杆菌科,为人兽共患病原菌,广泛分布于水源、土壤等自然环境,可感染猪、鸡、犬、羊等动物[1-3]。该菌作为条件致病菌,存在于人和动物肠道,是肠源性泌尿系统感染、腹膜炎等疾病的主要病原菌之一[4-6],污染鸡蛋后可穿透蛋壳引发卵黄感染致鸡胚死亡[7-8]。近年,鸡感染该菌的报道增多,给养鸡业造成巨大经济损失[9-10]。奇异变形杆菌宿主嗜性广泛,可感染多种动物,携带多种毒力基因,包括菌毛相关的fliL、zapA,溶血素相关的rpoA、mrpA,金属蛋白酶相关的ureC,以及迁徙相关的rsbA等。研究表明,这些毒力基因与该菌致病性密切相关,在致病过程中发挥关键作用[11]。近年,奇异变形杆菌感染动物的报道逐年增多,给我国畜牧养殖业造成严重经济损失。抗生素滥用和其基因组多样性,导致耐药基因与毒力基因频繁转移,极大增加了奇异变形杆菌病防控难度[8]。
本研究从新乡地区腹泻雏鸡中分离到奇异变形杆菌,经细菌分离培养、形态学观察及16S rRNA、特异性基因ureR基因PCR检测鉴定后,通过药敏试验、耐药基因与毒力基因检测及生物膜形成能力评估,系统分析菌株生物学特性,为防控该菌在鸡群中的传播及临床科学用药提供了参考依据。
1材料与方法
1.1样品来源
腹泻雏鸡/病鸡泄殖腔拭子样品共177份(编号1~177),新乡市某养殖场提供。
1.2仪器与试剂
麦康凯培养基LB液体培养基和SS培养基,北京奥博星生物技术有限责任公司;2×PCR Mix、DL2000 Marker,南京诺唯赞生物科技股份有限公司;革兰氏染液,北京博奥拓达科技有限公司;用于PCR扩增的PCR仪为ABI公司产品;全自动凝胶成像仪,上海天能科技有限公司。
1.3细菌的分离与鉴定
对采集患腹泻雏鸡泄殖腔拭子样品经常规处理后,在无菌条件下按照1:100接种比例将其接种至LB肉汤培养基中,随后将培养基放置在37℃的恒温条件下进行震荡培养18~24 h后,将培养物接种到SS培养基上进行选择性培养,同样在37℃下培养16~18 h。培养完成后,从SS培养基上挑选出带有黑色特征的典型单个菌落,对其进行革兰氏染色操作,最后在显微镜下观察分离菌的形态特征。
1.4 16S rDNA的PCR扩增与测序
根据参考文献[12]设计细菌16S rDNA通用引物,序列为F:5'-AGAGTTTGATCCTGGCTCAG-3',R:5'-AGAGTTTGATCCTGGCTCAG-3',预期扩增片段大小为1 500 bp。引物由生工生物工程(上海)股份有限公司合成。以分离菌的基因组DNA为模板,使用上述16S rDNA通用引物进行PCR扩增。将扩增产物通过1.5%琼脂糖凝胶电泳检测,并利用凝胶成像仪观察结果。随后,将检测后的PCR产物送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI数据库中进行BLAST比对,通过比对同源性最高的菌株来确定样本菌株的种属。
1.5奇异变形杆菌特异性基因ureR的PCR检测
查阅GenBank中ureR(AM942759)基因序号,应用BioXM2.6软件设计奇异变形杆菌特异性引物,序列为F:5'-CAAACTATCACAGTCACCAC-3',R:5'-AGGCTCTGTTGCATAAACAG-3',扩增的目的片段长度为314 bp。引物由生工生物工程(上海)股份有限公司合成。以分离菌的基因组DNA为模板,使用ureR基因鉴定引物进行PCR扩增,将PCR扩增产物通过1.5%琼脂糖凝胶电泳进行分析,并利用凝胶成像仪观察结果。
1.6分离菌毒力基因检测
参照文献[1],由生工生物工程(上海)股份有限公司合成了8种奇异变形杆菌的毒力基因引物,涵盖以下几类:溶血素相关毒力基因(hpmA和hpmB),菌毛相关毒力基因(zapA、pmfA、atfA),金属蛋白酶相关毒力基因(ureC),迁徙相关毒力基因(rsbA),以及尿道上皮粘附毒力基因(ucaA)见表1,以各分离菌株的DNA为模板,利用上述引物通过PCR方法分别扩增各菌株的相应毒力基因。
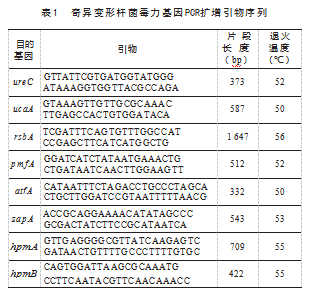
1.7分离菌耐药谱检测
采用微量肉汤稀释法检测抗菌药对奇异变形杆菌分离株的最小抑菌浓度(MIC)检测的13种抗菌药包括多黏菌素B、替加环素、多西环素、环丙沙星、恩诺沙星、庆大霉素、头孢噻肟、氨苄西林、阿莫西林、阿奇霉素、头孢曲松、氟苯尼考和氯霉素,药敏试验结果根据美国临床实验室标准协会(CLSl)2021年M100标准进行判读[13]。
1.8分离菌耐药基因检测
鉴于分离菌株对临床常用抗生素均产生耐药,为研究细菌耐药表型与耐药基因之间的关系,本研究设计了相关耐药基因的特异性引物,见表2,以分离菌株的DNA为模板,对其耐药基因进行PCR扩增。扩增产物经1.0%琼脂糖凝胶电泳检测,并观察结果。

1.9体外生物被膜形成能力测定
用改良微量板定量检测法[14]对分离株进行生物被膜形成能力测定。判定标准:将阴性对照的平均OD590nm值加上其3倍的标准差定义为临界值(cut-off值,ODC).基于临界值ODG首株生物被膜形成能力可以分为4类:OD590nm≤ODc为非生物膜形成菌株。ODc<OD590nm≤2O DC为弱生物膜形成菌株,2ODC<ODs90nm≤40DC值为中等生物膜形成菌株,OD590>40Dc为强生物膜形成菌株。
2结果
2.1奇异变形杆菌的分离纯化结果
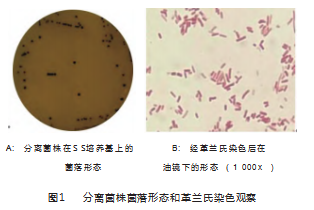
用SS琼脂培养基对鸡源未鉴定细菌样本中的奇异变形杆菌进行选择性培养,可见表面光滑,边缘整齐,呈圆形扁平状且中心部位呈现黑色的菌落,见图1A。对该菌落进行革兰氏染色后,镜检可见为杆状、阴性细菌,见图1B。
2.2 16S rRNA和ureR基因PCR结果
对分离菌通过PCR扩增16s rRNA,结果显示,部分样本在1 514 bp处出现扩增片段,与预期大小相符,见图2A;用特异性识别奇异变形杆菌ureR基因的引物,对分离出的菌株进行PCR扩增,结果显示,部分样本在314 bp处出现清晰的条带,初步判断为奇异变形杆菌,见图2B。对PCR产物进行胶回收并进行测序,测序结果在NC BIB LAST上进行同源性对比分析,最终从177只鸡泄殖腔拭子样本中分离获得21株鸡源奇异变形杆菌,分离率是11.86%(21/177)。

2.3分离菌毒力基因的PCR检测结果
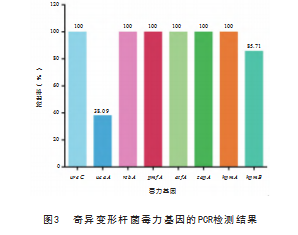
采用PCR方法对21株奇异变形杆菌进行毒力基因(5类8种)检测,结果显示,21株奇异变形杆菌中urec、rsbA、pmfA、atfA、zapA和hpmA的检出率最高(100%,21/21),其次为hpmB(85.71%,18/21),ucaA检出率为38.09%,见图3。此外,本研究中,90.48%(19/21)的奇异变形杆菌同时携带7种及以上毒力基因,其中携带ureC+rsbA+pmfA+atfA+zapA+hpmA 6种毒力基因的菌株较多(100%,21/21),表明21株奇异变形杆菌携带多种不同类型的毒力基因。
2.4分离菌对抗生素的耐药性分析
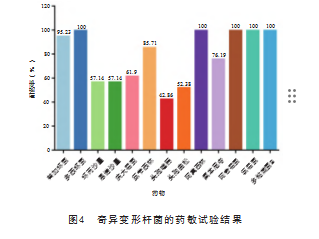
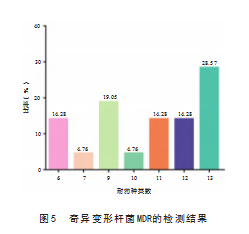
药物敏感性试验结果显示,21株奇异变形杆菌分离株对阿莫西林、多西环素、氯霉素、阿奇霉素和多粘素B的耐药性最为严重,耐药率均为100%;对四环素类药物(替加环素)的耐药率为95.23%;对β-内酰胺类药物(氨苄西林、头孢噻肟和头孢曲松)的耐药率在42.86%~85.71%;对氨基糖苷类药物(庆大霉素)的耐药率为61.9%;对氟喹诺酮类药物(环丙沙星和恩诺沙星)的耐药率为57.14%;对氟苯尼考耐药率为76.19%,见图4。多重耐药性检测结果显示,21株奇异变形杆菌分离株均多重耐药菌株,且表现出不同的多重耐药性(6耐~13耐)。其中13耐菌株最多,占28.57%(6/21),其次为9耐,占19.05%(4/21),6耐、11耐和12耐菌株均占14.28%(3/21),见图5。表明21株分离的奇异变形杆菌对临床常用抗生素耐药程度不一,且都为多重耐药。
2.5分离菌耐药基因的检测结果
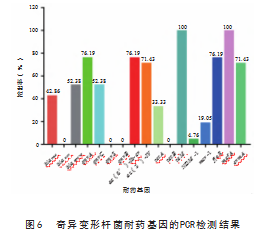
采用PCR方法对2 1株奇异变形杆菌分离株进行耐药基因(8类17种)检测,其中,大环内酯类耐药基因mefA和四环素类耐药基因tetM的检出率最高(100%,21/21),氨基糖苷类耐药基因aac(3)-IV和ac(6’)-Ib-cr的检出率分别为71.43%和76.19%,喹诺酮类耐药基因qnrA和qnrC的检出率分别为76.19%和52.38%,四环素类耐药基因tetA的检出率为33.33%,β-内酰胺类耐药基因blaCTX-M和blaTEM的检出率分别为52.38%和42.86%,大环内酯类耐药基因ermA的检出率71.43%,氟苯尼考类耐药基因floR的检出率为76.19%,多粘菌素类耐药基因mcr-1的检出率为19.05%,碳青霉烯类耐药基因NDM-1的检出率为4.76%。喹诺酮类耐药基因qnrB、qnrS、β-内酰胺类耐药基因blaSHV、四环素类耐药基因tetB均未检出,见图6。
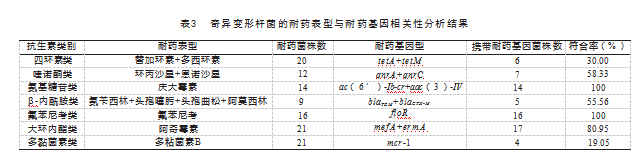
对分离的21株奇异变形杆菌进行耐药表型与耐药基因型的相关性分析,见表3。结果表明,氟苯尼考类、大环内酯类、氨基糖苷类、喹诺酮类以及β-内酰胺类的耐药表型与相应耐药基因型之间基本呈现正相关关系,二者的一致率在55.56%~100%。综上所述,21株奇异变形杆菌携带多种不同类型的耐药基因,且在绝大多数情况下(多粘菌素类和四环素类除外),其耐药表型与耐药基因之间存在基本正相关关系。
2.6生物被膜形成能力试验
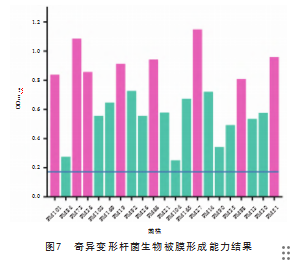
在改良微量板定量检测中,21株奇异变形杆菌均能形成生物被膜。其中,生物被膜形成能力强的菌株占比为38.09%(8株),形成能力中等的菌株占比为47.62%(10株),形成能力弱的菌株占比为14.29%(3株),见图7。经卡方检验分析,生物被膜形成能力的强弱与菌株的耐药性之间并无显著相关性(P>0.05)。
3讨论
奇异变形杆菌是一种常见的人畜共患致病菌,广泛存在于临床环境中,但在家畜养殖过程中常被忽视。近年,该菌在家畜中的感染率和致死率呈上升趋势,给养殖业带来显著的经济损失[15-17]。然而,国内关于奇异变形杆菌在家禽(如鸡)中感染的研究相对较少。本研究在新乡地区某养殖场开展调查,从出现腹泻症状的雏鸡体内成功分离出21株奇异变形杆菌,分离率为11.86%。这一结果表明,奇异变形杆菌是该养殖场雏鸡腹泻的重要病原菌之一,其在鸡群中的存在不容忽视,可能对养鸡业造成较大危害。
在毒力基因检测方面,21株奇异变形杆菌携带多种毒力基因,其中ureC、rsbA、pmfA、atfA、zapA和hpmA的检出率高达100%,90.48%的菌株同时携带7种及以上毒力基因。这些毒力基因在细菌的致病过程中发挥着关键作用,如ureC编码的脲酶可分解尿素产氨,有助于细菌在宿主体内的生存和定植;rsbA参与细菌的迁徙运动,利于细菌在宿主体内扩散;zapA等菌毛相关基因与细菌的黏附能力密切相关,使细菌能够更好地附着在宿主细胞表面,进而侵入宿主组织引发感染[18-19]。高毒力基因携带率意味着这些分离株可能具有较强的致病性,这为深入了解奇异变形杆菌在雏鸡腹泻中的致病机制提供重要依据。
耐药性检测结果显示,21株分离株对多种临床常用抗生素表现出严重耐药性,且均为多重耐药菌株。对多西环素、阿莫西林、阿奇霉素、氯霉素和多粘素B的耐药率高达100%,对其他各类抗生素也有不同程度的耐药。与已有研究[20-21]相比,在本研究中,21株奇异变形杆菌的耐药性均呈现不同程度的上升趋势,其中10重耐药以上的菌株占比高达61.89%。这种现象可能与畜牧养殖过程中抗生素的不合理使用密切相关。这种广泛的耐药现象给临床治疗带来了极大挑战。抗生素的不合理使用是导致细菌耐药性产生的重要原因之一,在养鸡业中,长期、大量使用抗生素进行疾病预防和治疗,使得细菌在药物选择压力下逐渐产生耐药机制。多重耐药菌株的出现,意味着在治疗鸡群感染时,可供选择的有效药物越来越少,不仅增加了治疗成本,还可能导致治疗失败,造成鸡死亡,给养殖业带来巨大经济损失。
在耐药基因检测中,发现不同耐药基因的检出率各有不同,且耐药表型与耐药基因型之间基本呈正相关,但多粘菌素类和四环素类除外。例如β-内酰胺类耐药基因blaTEM和blaCTX-M、喹诺酮类耐药基因qnrC和qnrA等的检出率与相应药物的耐药表型相符。这表明可以通过检测耐药基因来在一定程度上预测细菌的耐药性,为临床合理用药提供参考。但是,四环素类和多粘菌素类的耐药表型与基因型的一致性较低,这可能是由于这2类药物的耐药机制较为复杂,除检测的耐药基因外,还可能存在其他未知的耐药机制,或者受到环境因素、基因调控等多种因素的影响。
21株奇异变形杆菌均具备生物被膜形成能力,其中强形成能力菌株占比38.09%,中等形成能力菌株占比47.62%。生物被膜的形成有助于细菌抵御外界环境压力,如抗生素的作用和宿主免疫系统的攻击[22]。一般耐药性较强的细菌更容易形成生物被膜,而处于生物被膜中的细菌也更容易获得耐药性,其对药物的耐受能力可提升10~1 000倍,这一特性极大地增加了相关感染性疾病的治疗难度,给临床治疗工作带来严峻挑战[23]。虽然本研究中生物被膜形成能力与菌株耐药性之间不存在相关性,但这并不意味着在其他情况下二者也无关联,后续还需进一步研究生物被膜与耐药性之间的潜在关系。
综上所述,本研究分离鉴定的鸡源奇异变形杆菌具有较强的致病性和广泛的耐药性,给养鸡业带来了严重威胁。为有效防控奇异变形杆菌病,养鸡场应加强卫生管理,减少细菌传播,合理使用抗生素,避免滥用,以减缓耐药性的产生,进一步深入研究奇异变形杆菌的耐药机制和致病机制,开发新的治疗方法和防控策略,从而保障养鸡业的健康发展。
参考文献
[1]李欣南,韩镌竹,宁宜宝.鸡源奇异变形杆菌的分离鉴定及耐药性研究[J].黑龙江畜牧兽医,2015(11):165-167,289.
[2]衣菲,于申业,田秋丰,等.禽源奇异变形杆菌的分离鉴定及耐药性分析[J].黑龙江畜牧兽医,2015(1):121-122,126,216.
[3]Schaffer J N,Pearson M M.Proteus mirabilis and Urinary Tract Infections[J].Microbiol Spectr,2015,3(5).
[4]Gong Z,Shi X,Bai F,et al.Characterization of a Novel Diarrheagenic Strain of Proteus mirabilis Associated With Food Poisoning in China[J].Front Microbiol,2019,10:2 810.
[5]Chen C M,Lai C H,Wu H J,et al.Genetic characteristic of class 1 integrons in Proteus mirabilis isolates from urine samples[J].Biomedicine(Taipei),2017,7(2):9.
[6]Ma S,Shen J,Xu Y,et al.Epidemic characteristics of the SXT/R391 integrated conjugative elements in multidrug-resistant Proteus mirabilis isolated from chicken farm[J].Poult Sci,2023,102(6):102 640.
[7]王涛,马轲,张建刚,等.长春地区鸡源奇异变形杆菌的分离鉴定及毒力分析[J].微生物学通报,2022,49(12):4 987-4 998.
[8]刘燕云,柴家前.奇异变形杆菌研究进展[J].中国兽医学报,2017,37(1):196-200.
[9]刘盼盼,贺泂杰,徐国伟,等.一株种鸡源奇异变形杆菌的分离鉴定及毒力基因分析[J].中国兽医科学,2021,51(10):1 287-1 294.
[10]熊菊萍,肖滢宇,张诚,等.1株鸡源奇异变形杆菌的分离鉴定及药敏试验[J].畜牧与饲料科学,2022,43(5):106-111,116.
[11]刘圣,郑维超,黄虹秀,等.大熊猫源奇异变形杆菌、肺炎克雷伯菌、大肠杆菌多重PCR检测方法的建立及应用[J].中国预防兽医学报,2023,45(6):598-603.
[12]但蕊桐,谢沐含,邱羊羊,等.5株牛源奇异变形杆菌致病性及药物敏感性分析[J].西南大学学报(自然科学版),2025,47(2):26-40.
[13]Humphries R,Bobenchik A M,Hindler J A,et al.Overview of Changes to the Clinical and Laboratory Standards Institute Performance Standards for Antimicrobial Susceptibility Testing,M100,31st Edition[J].J Clin Microbiol,2021,59(12):e0 021 321.
[14]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].J Microbiol Methods,2000,40(2):175-179.
[15]何雯雯.致仔猪腹泻奇异变形杆菌的分离鉴定与耐药性分析[J].中国动物保健,2024,26(8):14-15.
[16]杨睿,王婷婷,王孝友,等.腹泻仔猪中奇异变形杆菌分离鉴定与耐药基因分析[J].中国兽医学报,2019,39(11):2 146-2 151.
[17]贾沅铮,胡剑刚,王志豪,等.鸡源奇异变形杆菌分离鉴定及生物学特性[J].微生物学通报,2021,48(9):3 013-3 024.
[18]Sun Y,Wen S,Zhao L,et al.Association among biofilm formation,virulence gene expression,and antibiotic resistance in Proteus mirabilis isolates from diarrhetic animals in Northeast China[J].BMC Vet Res,2020,16(1):176.
[19]Shi X,Hu Q,Lin Y,et al.Etiological and molecular characteristics of diarrhea caused Proteus mirabilis[J].Chinese Journal of Epidemiology,2014,35(6):724-728.
[20]陆玉婷,王胜奎,乔昀.2015—2017年奇异变形杆菌耐药情况分析[J].标记免疫分析与临床,2019,26(1):143-146.
[21]何欣怡,徐睿,任丽,等.鸡源致病性奇异变形杆菌分离鉴定及药敏试验[J].现代畜牧兽医,2018(7):10-15.
[22]Moryl M,Torzewska A,Jałmuzna P,et al.Analysis of Proteus mirabilis distribution in multi-species biofilms on urinary catheters and determination of bacteria resistance to antimicrobial agents[J].Pol J Microbiol,2013,62(4):377-384.
[23]吕小龙.禽致病性大肠杆菌生物被膜形成及其相关调控基因研究[D].合肥:安徽农业大学,2017.










