多重耐药猪源类肺炎克雷伯菌的全基因组测序分析论文
2025-09-04 15:34:59 来源: 作者:xuling
摘要:为明确吉林地区1例猪肺炎感染的主要病原及其耐药特征,该研究采集患呼吸道疾病猪的鼻拭子样本进行细菌培养。通过16S rRNA基因测序鉴定优势菌株,采用最低抑菌浓度(MIC)法评估药物敏感性,并结合全基因组测序(WGS)和生物信息学分析耐药基因与机制。
摘要:为明确吉林地区1例猪肺炎感染的主要病原及其耐药特征,该研究采集患呼吸道疾病猪的鼻拭子样本进行细菌培养。通过16S rRNA基因测序鉴定优势菌株,采用最低抑菌浓度(MIC)法评估药物敏感性,并结合全基因组测序(WGS)和生物信息学分析耐药基因与机制。结果显示,分离菌株Yan-10经鉴定为类肺炎克雷伯菌(Klebsiella quasipneumoniae),与参考序列同源性最高为99.86%。药敏试验表明,该菌对氯霉素、喹诺酮类、头孢菌素类等抗生素耐药。全基因组分析揭示其携带18个耐药基因,主要机制包括主动外排泵(9个基因)、靶位点修饰(7个基因)、膜通透性降低(3个基因)及灭活酶生成(1个基因)。结果表明,Yan-10为多重耐药菌株,其复杂的耐药机制加剧了猪场肺炎防控的难度。
关键词:多重耐药;类肺炎克雷伯菌;全基因组测序
0引言
根据临床菌株核苷酸的相关研究,肺炎克雷伯菌可分为3种系统群:肺炎克雷伯菌与类肺炎克雷伯菌、变栖克雷伯菌[1-2]。类肺炎克雷伯菌是一类革兰阴性、兼性厌氧、不动杆菌属,为重要的致病菌[3]。近年,陆续有变栖克雷伯菌、类肺炎克雷伯菌高毒力耐药菌株报道,且部分菌株的毒力高于肺炎克雷伯菌,变栖克雷伯菌、类肺炎克雷伯菌也开始受到关注。我国养殖业不断发展,目前有很多报道关于家禽、家畜和野生动物感染类肺炎克雷伯菌的病例[4],具有较高的病死率。大规模和高密度情况下养殖户在预防治疗中滥用抗生素,但随之而来是多重耐药菌株的分离越来越多,治疗克雷伯菌感染的药物选择逐渐减少,使临床治疗愈发困难。但类肺炎克雷伯菌引发的感染还未引起足够重视。本次试验研究类肺炎克雷伯菌试验菌株耐药情况及相关耐药基因,为类肺炎克雷伯菌的防治和合理用药提供参考。
1材料与方法
1.1菌株来源
使用灭菌采样管采集的1份来自吉林某猪场患有呼吸道疾病的猪源鼻拭子样本。
1.2细菌的培养与镜检
得到的菌接种于TSA平板,置于恒温箱需氧培养,每隔12 h进行1次纯化培养,直至菌落形态单一,命名为Yan-10,挑取单菌落于TSB液体培养基中,过夜培养备用。取出纯化后的单菌落于洁净载玻片上,使用无菌生理盐水稀释并在火焰上加热固定,按照革兰染色说明书进行革兰染色,使用显微镜观察菌体形态。
1.3分离菌株16S rRNA基因序列测定
取1 mL过夜培养菌液,严格按照细菌基因组DNA提取试剂盒说明书步骤提取基因组DNA。将PCR反应体系(50μL)中各个试剂混合均匀,根据文献[5]进行聚合酶链式反应。PCR产物通过1%琼脂糖凝胶电泳进行检测,合格后PCR产物送往吉林省库美生物科技有限公司测序。
1.4药敏试验
采用琼脂扩散法测定Yan-10的最低抑菌浓度(MIC),该方法依据不同文献,选用了15种抗生素,具体包括氯霉素、氟苯尼考、环丙沙星、磷霉素、阿奇霉素、甲氧苄啶、杆菌肽、多粘菌素B、丁胺卡那、庆大霉素、头孢唑林、林可霉素、克林霉素、多西环素、四环素。采用MIC测定单一菌株Yan-10的最小抑菌浓度,分析其药物敏感性。标准参考2023年第33版CLSI指南。
1.5全基因组测序分析
纯化菌株TSB液体37℃培养,24 h后取出。4℃、6 000 r/min离心15 min,去上清液保留菌体,提取高质量DNA,测序任务由杭州开泰生物技术有限公司进行全基因组测序分析。
使用下机基因序列预测菌株Yan-10的氨基酸序列,采用Comprehensive Antibiotic Research Database(CARD)数据库提供的Resistance Gene Identifier(RGI)软件将菌株的氨基酸序列与CARD数据库进行比对(RGI内置blastp,默认evalue≤1e-30),根据RGI的比对结果,统计注释到数据库的抗性基因信息,最终得到Yan-10的所有耐药基因。
2结果
2.1鉴定结果
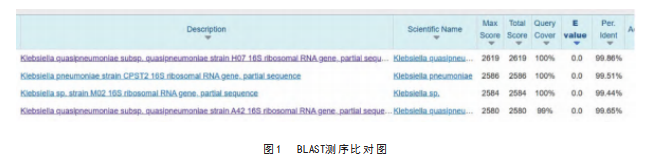
经吉林省库美生物科技有限公司测序得到拼接序列,将序列进行BLAST比对,发现Yan-10与类肺炎克雷伯菌的同源性最高为99.86%,见图1。
2.2药敏试验结果
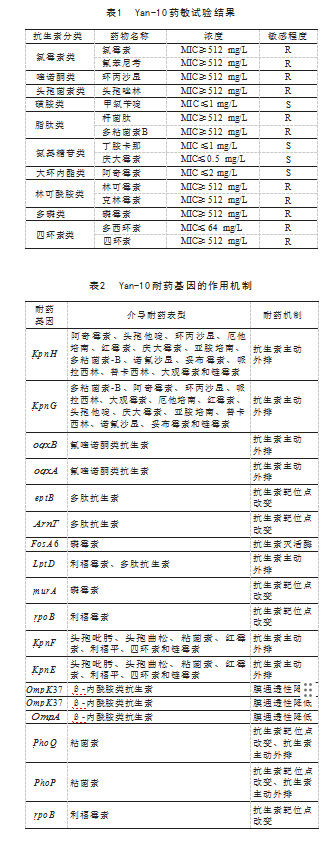
药敏试验结果发现Yan-10对15种抗生素中的氯霉素类抗生素、喹诺酮类抗生素、脂肽类抗生素、头孢菌素类抗生素、林可酰胺类抗生素、四环素类抗生素耐药(MIC≥512 mg/L),对大环内酯类抗生素、磺胺类抗生素、氨基糖苷类抗生素敏感(MIC≤2 mg/L),见表1。
2.3全基因组测序分析
Yan-10的全基因组序列的大小为8 633 238 bp,G+C含量达到57.22%,分析所得的编码基因为5 717个,其基因编码长度为5 945 224 bp,平均长度为1 040 bp。
使用BLAST将Yan-10蛋白序列与CARD数据库进行比对,后将全基因组序列与耐药性信息比对,得到18个耐药基因。其中耐药机制及数量主要是9个抗生素主动外排机制基因、7个作用靶位点改变机制基因、3个膜通透性降低机制基因、1个产生抗生素灭活酶机制基因。其中,被显著降低敏感性的抗生素类型是四环素类抗生素,其次是氟喹诺酮类抗生素和氯霉素类抗生素,见表2。
3讨论
本研究从吉林地区患呼吸道疾病的猪体内成功分离出1株多重耐药类肺炎克雷伯菌Yan-10,其广泛耐药性及分子机制揭示了当前猪场细菌性肺炎防控的严峻挑战。使用15种有抑菌效果的抗生素进行药敏试验,得出类肺炎克雷伯菌对其中11种药物耐药,与近年报道的高耐药克雷伯菌趋势一致。全基因组测序进一步发现,该菌耐药基因高度多样化,尤其以主动外排泵基因(如oqxA/B、KpnG/H)占比最高,表明外排机制是其对抗菌药物耐受的核心策略。此外,靶位点突变(如rpoB)和膜孔蛋白缺失(OmpK37、OmpA)可能协同降低了β-内酰胺类药物的渗透与结合效率,而磷霉素灭活酶(FosA6)的存在则直接削弱了特定抗生素的活性。这些机制的综合作用导致Yan-10对多类药物交叉耐药,提示单一用药策略难以奏效。鉴于养殖业抗生素不合理使用与耐药菌扩散的恶性循环,建议推行精准用药指南,以遏制多重耐药菌的蔓延。本研究为类肺炎克雷伯菌的耐药进化研究提供了关键数据支撑,也为动物源性耐药菌的跨物种传播预警奠定了理论基础。
参考文献
[1]Rodriguez M N,Barrios C,Duranbedolla J,et al.Klebsiella variicola:an emerging pathogen in humans[J].Emerg Microbes Infect,2019,8(1):973-988.
[2]朱昱蓉,刘荣华.肺炎克雷伯菌、类肺炎克雷伯菌和变栖克雷伯菌的研究进展[J].中国感染控制杂志,2023,22(8):983-989.
[3]Hoashi K,Harada S,Ishii Y,et al.Klebsiella pneumoniae Community-acquired liver abscess caused by capsular genotype K2ST375 hypervirulent isolates[J].IDCases,2019,17:e00 577.
[4]蒋佳能,王娟,杨增岐.朱鹮源大肠埃希菌、肺炎克雷伯菌和产气荚膜梭菌的分离鉴定及药敏检测[J].动物医学进展,2023,44(4):72-78.
[5]He J,Orcid I D,Bao S,et al.A chromosome-level genome assembly of Artocarpus nanchuanensis(Moraceae),an extremely endangered fruit tree[J].GigaScience,2022,11:42.










