多重耐药四川克吕沃尔氏菌LHN-g4的全基因组测序分析论文
2025-09-04 15:21:22 来源: 作者:xuling
摘要:通过16S rRNA基因测序鉴定该菌株为四川克吕沃尔氏菌,最低抑菌浓度(MIC)测定结果显示,该菌株对多种抗生素具有耐药性,尤其对β-内酰胺类、氨基糖苷类和大环内酯类抗生素表现出显著耐药性。
摘要:该研究旨在阐明从中国吉林省猪源分离的1株四川克吕沃尔氏菌LHN-g4的耐药机制。通过16S rRNA基因测序鉴定该菌株为四川克吕沃尔氏菌,最低抑菌浓度(MIC)测定结果显示,该菌株对多种抗生素具有耐药性,尤其对β-内酰胺类、氨基糖苷类和大环内酯类抗生素表现出显著耐药性。全基因组测序分析表明,该菌株染色体长度为5 096 378 bp,共携带18个耐药基因,其中8个连续外排泵基因与耐药基因相邻分布,这些遗传元件共同介导了LHN-g4的耐药表型。值得注意的是,CTX-M-95型广谱β-内酰胺酶的存在进一步增强了菌株的耐药性。此外,在质粒N-1上检测到与IV型分泌系统相关的基因、2个耐药基因以及1个复合转座子,这些遗传因子也参与了LHN-g4的耐药机制。综上所述,LHN-g4的耐药性是由染色体上的耐药基因、IV型分泌系统以及N-1质粒上的转座子共同决定的。
关键词:四川克吕沃尔氏菌;CTX-M-95;全基因组测序
0引言
四川克吕沃尔氏菌是一种罕见的革兰氏阴性菌,曾在水、土壤、医疗环境、动物源性食品中发现[1]。LHN-g4有可能引起腹泻、腹膜炎、肺炎和新生儿脑膜炎。这些并发症严重可以致命[2],该属的细菌主要分为4个已知物种,抗坏血克吕沃尔氏菌、中间克吕沃尔氏菌、栖冷克吕沃尔氏菌和土生克吕沃尔氏。在这项研究中,本文的主要目的是介绍最近发现的物种四川克吕沃尔氏菌的详细研究。
四川克吕沃尔氏菌的感染很少见,但近年报告的病例显著增加。据报道,克吕沃尔氏菌对某些碳青霉烯类、β-内酰胺类药物表现出耐药性,并且自然对大多数氨基糖苷类药物敏感,如庆大霉素和卡那霉素。产生CTX-M的菌株不仅在人类中普遍存在,而且在动物中也普遍存在。已鉴定出编码在克吕沃尔氏菌属染色体中的CTX-M型β-内酰胺酶,包括c-CTX-M-2、c-CTX-M-3、c-CTX-M-37、c-CTX-M-76、c-CTX-M-77和c-CTX-M-78。在抗坏血克吕沃尔氏菌中曾发现了CTX-M-1和CTX-M-2;土生克吕沃尔氏菌中发现了CTX-M-8和CTX-M-9。CTX-M-95已从LHN-g4中分离出来,对β内酰胺类抗生素药物具有高度耐药性。
1材料与方法
1.1菌株来源
指示菌:大肠杆菌(ATCC 25922)由吉林农业科技学院动物科技学院动物微生物与免疫研究室保藏。四川克吕沃尔氏菌LHN-g4由来自吉林省某猪场中患有呼吸系统疾病的仔猪样品中分离纯化得到。
1.2试验方法
1.2.1菌株的分离纯化
取猪鼻拭子样品,在无菌条件下分别涂布于BHI固体培养基上,37℃恒温培养箱中培养24 h;在平板上挑取不同形态单菌落进行划线纯化,革兰氏染色观察纯化后的分离菌株并进行增殖培养,甘油保菌并在-80℃冻存。
1.2.2菌株的鉴定
使用细菌D N A提取试剂盒提取菌株基因组D N A;使用细菌1 6 S rRNA通用上下游引物27F(5′-A GAG TTT GAT CC TG GC TC AG-3′)和1492R(5′-GGTTACCTTG TTACGACTT-3′)进行聚合酶链式反应(PCR)[3],扩增条件为94℃5 min,94℃1 min,55℃1 min,72℃1 min,30个循环,72℃1 min;扩增产物经1%琼脂糖凝胶电泳检测后送至安徽通用生物科技有限公司测序,测序菌株基因序列在NCBI数据库中进行同源性比对。
1.2.3菌株的药敏试验
采用琼脂扩散法测定LHN-g4的最低抑菌浓度,该方法依据不同文献,选用了10种抗生素,包括阿奇霉素、青霉素G、氨苄西林、替米考星、恩诺沙星、四环素、氟苯尼考、磺胺甲噁唑、甲氧苄啶和阿米卡星。具体操作主要步骤如下:首先,将细菌溶液浓度调整为1×107 CFU/mL,把药剂的最终浓度调整至0.03~512 mg/L范围。后续步骤主要参照2023年第33版CLSI指南中的相关内容。完成接种后,将接种培养基放入恒温器中孵育16 h,然后记录数据。试验过程中,以大肠杆菌作为质控菌。
1.2.4菌株的全基因组测序分析
首先要将细菌溶液培养至对数生长期,随后将溶液以7 000 r/min离心15 min,以此制备细胞培养基。从四川克吕沃尔氏菌LHN-g4中提取高质量的DNA,交由北京百迈克生物科技有限公司按需测序。测序完成后,使用Canu v1.5软件进行组装。利用Prodigal v2.6.3软件预测编码基因。
2结果与分析
2.1菌株的鉴定
16S rRNA测序分析显示,LHN-g4与四川克吕沃尔氏菌的同源性准确率为99.99%。
2.2 LHN-g4的药敏试验结果
LH N-g4对多种药物具有高度耐药性,以大肠杆菌的MIC折点为参考,本研究结果显示,LHN-g4对氟苯尼考≥512 mg/L,替米考星≥512 mg/L,恩诺沙星≥5 1 2 mg/L,青霉素G≥5 1 2 mg/L,氨苄西林≥5 1 2 mg/L,磺胺甲噁唑≥5 1 2 mg/L,阿米卡星≥512 mg/L,阿奇霉素≥512 mg/L,四环素≥512 mg/L,甲氧苄啶≥5 1 2 mg/L,上述10种药物均表现出显著耐药性。
2.3 LHN-g4的全基因组测序分析
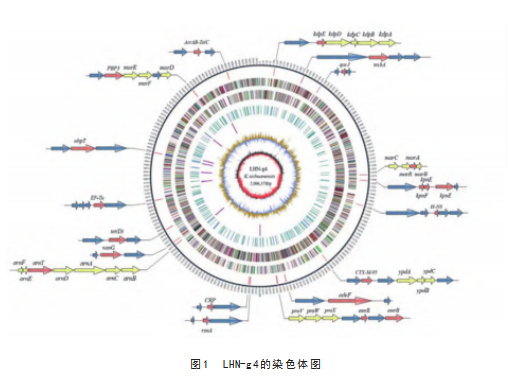
LHN-g4全基因组测序分析表明,LHN-g4的染色体基因组大小为5 096 378 bp,基因组平均GC含量为54.9%,编码4 816个基因,含有16个基因岛,具体内容见图1、图2。
3讨论
近年,细菌耐药性问题对人类和动物健康构成重大威胁。本研究从猪鼻拭子中分离出克吕沃尔氏菌属的一个新物种——四川克吕沃尔氏菌LHN-g4,并对其进行了全基因组分析和最低抑菌浓度分析。通过全基因组测序和药敏试验,发现LHN-g4携带β-内酰胺酶抗性基因CTX-M-95,该基因对β-内酰胺类药物表现出极高的抗性。
在四川克吕沃尔氏菌中已鉴定出blaCTX M 8、blaCTX M 9和blaCTX M 25基因,而在抗坏血酸克吕沃尔氏菌中观察到blaCTX M 1和blaCTX M 2基因。这些基因的多样性表明,克吕沃尔氏菌属在进化过程中可能通过基因的水平转移获得了多种耐药性基因。此外,LHN-g4基因组中还鉴定出多个与耐药性和毒力相关的基因,包括marA、marC、marR(与喹诺酮类耐药相关)[4]、KdpA-KdpE(与Kdp-ATP功能相关)[5]以及murE、murF、murD(参与肽聚糖合成)[6]。这些基因的存在进一步证实了LHN-g4的多重耐药性。
值得注意的是,LHN-g4携带细菌IV型分泌系统(T4SS),其结构包括外膜核心复合物、内膜蛋白基因TraL、TraE以及周质成分基因TraU、TraH和TraN。T4SS系统可能通过促进DNA转移,在毒力基因和耐药基因的水平转移中发挥关键作用[7]。这一发现为理解细菌耐药性和毒力基因的传播机制提供了新的线索。T4SS系统的存在不仅可能增强LHN-g4的毒力,还可能促进其在环境中的适应性。
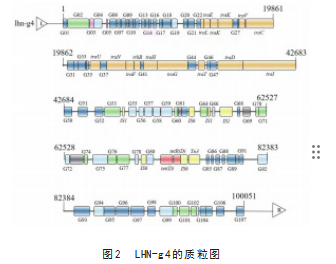
在本研究中,从猪身上分离出一株罕见的四川克吕沃尔氏菌菌株。研究结果鉴定出多个连续的外排泵基因、多个T4SS系统和复合型转座子,它们可能相互作用以促进基因的水平转移。这些基因在耐药性的产生和传播中发挥着重要作用。复合型转座子的存在表明,LHN-g4可能通过转座子介导的基因重组事件获得新的耐药性基因。此外,外排泵基因的连续排列可能增强了LHN-g4对多种抗生素的耐受性。
4结论
本研究首次报道了四川克吕沃尔氏菌LHN-g4的基因组特征及其多重耐药性机制,为进一步研究其致病性和耐药基因传播提供了重要依据。未来需进一步探讨T4SS系统在其毒力和耐药性传播中的作用,以及复合型转座子和外排泵基因在耐药性产生和传播中的具体机制。这些研究将有助于开发新的策略来控制细菌耐药性的传播,保护人类和动物的健康。
参考文献
[1]Sarria J C,Vidal A M,Kimbrough III R C.Infections Caused by Kluyvera Species in Human[J].Clin Infect Dis,2001,33(7):69-74.
[2]Liu L,Feng Y,Wei L,et al.Precise species identification and taxonomy update for the Genus Kluyvera with reporting Kluyvera sichuanensis sp[J].Front Microbiol,2020,11:579 306.
[3]Moreno C,Romero J,Espejo R T.Polymorphism in repeated 16S rRNA genes is a common property of type strains and environmental isolates of the genus Vibrio[J].Nat Microbiol,2002,148(4):1 233-1 239.
[4]Alekshun M N,Levy S B.Regulation of chromosomally mediated multiple antibiotic resistance:the mar regulon[J].Antimicrob Agents Chemother,1997,41(10):2 067-2 075.
[5]Ballal A,Basu B,Apte S K.The Kdp-ATPase system and its regulation[J].J Biosci,2007,32:559-568.
[6]TomašićT,Šink R,Zidar N,et al.Dual Inhibitor of MurD and MurE Ligases from Escherichia coli and Staphylococcus aureus[J].Acs Med Chem Lett,2012,3(8):626-630.
[7]Lawley T D,Klimke W A,Gubbins M J,et al.F factor conjugation is a true type IV secretion system[J].Fem s Microbiol Lett,2003,224(1):11-15.










