十足目虹彩病毒1的检测与诊断研究进展论文
2025-02-06 11:46:48 来源: 作者:dingchenxi
摘要:十足目虹彩病毒1(Decapoda iridovirus 1,DIV1)是一种新兴的传染性病毒,属于虹彩病毒科十足目虹彩病毒属,主要感染虾类和其他甲壳类动物的造血组织和血细胞,致死率高达100%,DIV1的有效诊断是防控DIV1的重要手段。该文主要介绍DIV1诊断方法的最新研究进展。
摘要:十足目虹彩病毒1(Decapoda iridovirus 1,DIV1)是一种新兴的传染性病毒,属于虹彩病毒科十足目虹彩病毒属,主要感染虾类和其他甲壳类动物的造血组织和血细胞,致死率高达100%,DIV1的有效诊断是防控DIV1的重要手段。该文主要介绍DIV1诊断方法的最新研究进展。
关键词:核酸检测;DIV1;水产养殖;虹彩病毒
0引言
2000—2017年,水产养殖行业为全球供应超8 000万t的鱼类和贝类及超3 200万t的藻类,其中涵盖约425个养殖品种[1]。甲壳类养殖业是水产养殖业的重要组成部分,2018年甲壳类水产的全球供应总量达到940万t[2],年增长速度达到9.9%。凡纳滨对虾、克氏原鳌虾与中华绒螯蟹为主要的甲壳类养殖品类,虾类产业是甲壳类水产的主要收入来源[3]。虾类养殖业主要分布在亚洲国家,中国是世界上最大的对虾生产与消费国家。据统计,2019年中国虾类水产产量为570万t,占全球总产量的30%[4]。水产业迅速发展,导致真菌、细菌与病毒等微生物引起疾病大规模暴发,水产品产量及质量下降[5]。过去15年间,虾类养殖动物疾病暴发造成全球水产养殖户约100亿美元的损失,主要影响亚洲地区[6],占比约80%。白斑综合征(white spot syndrome virus,WSSV)、对虾急性肝胰腺坏死病(acute hepatopancreatic necrosis disease,AHPND)、黄头病(yellow head disease,YHD)、陶拉综合征(taura syndrome,Ts)以及肝胰腺细小病(hepatopancreatic parvo virus disease,HPVD)等都属于虾类疾病,由相应病原体引发。近年,一种针对虾类动物的虹彩病毒—十足目虹彩病毒1(decapod iridescent virus 1,DIV1)进入大众视野。DIV1于1993年首次被发现,2019年被正式命名以来,DIV1的爆发及感染原因、病理学及临床特征、潜在治疗及预防手段、DIV1的分子和生物学诊断技术备受关注[7-8]。
1十足目虹彩病毒1(DIV1)
1.1 DIV1的发现
在DIV1被归类于虹彩病毒科之前,虹彩病毒科被分类为5种属与2种亚科,其中蛙病毒属(Ranavirus)、淋巴囊肿病毒属(Lymphocystivirus)和肿大细胞病毒属(Megalocytivirus)属于Alphairidovirinae亚科,虹彩病毒属(Iridovirus)、绿虹彩病毒属(Chloriridovirus)属于Betairidovirinae亚科[9]。DIV1于1993年首次被发现,Montanie H等[10]在巨爪蟹组织中观察到一种病毒,通过形态学与推测DNA含量认为该病毒与虹彩病毒科相关,这是首次在甲壳类生物中发现虹彩状病毒。同年Lightner D V等[11]在厄瓜多尔的对虾养殖场中也发现虹彩状病毒。2014年,Qiu L等[12]在中国浙江养殖的凡纳滨对虾中发现虹彩病毒并暂时命名为虾血细胞虹彩病毒(shrimp hemocyte iridescent virus,SHIV),研究团队利用主要衣壳蛋白与三磷酸腺苷酶的氨基酸序列进行系统发育分析,发现该病毒不属于虹彩病毒科已知的任何属。2016年,Xu L等[13]在中国福建养殖场中的红鳌螯虾中发现一种新的虹彩病毒并暂时命名为红螯螯虾虹彩病毒(cherax quadricarinatus iridovirus,CQIV)。2019年国际病毒分类委员会(international committee on taxonomy of viruses,ICTV)正式将SHIV与CQ IV归类为虹彩病毒科新属十足目虹彩病毒属(Decapodiridovirus),确认2种病毒为同种不同株,即为十足目虹彩病毒1型(DIV1)。
1.2 DIV1感染的临床表现
DIV1的感染多见于虾类成虫期,致死率可达100%。在感染DIV1后,虾类动物的一般临床症状包括个体嗜睡和停止进食,机体内表现为胃和肠道中空、肝胰腺苍白等[14],具体的DIV1患病表型在各种虾类动物中有所差异,Qiu L等[15]观察到患病罗氏沼虾体表的虾喙部甲壳下呈现白色三角区域,感染早期出现“白头”和“黄鳃”症状,濒死虾出现肌肉泛白与触角残缺等特征。使用病毒制剂攻毒的凡纳滨对虾[12]表现出相似症状,除一般临床症状外,个别患病虾外壳柔软或身体出现泛红等。DIV1感染虾类动物,进入机体内通过靶器官进一步侵染,靶器官通常位于机体的淋巴、造血组织、鳃与肝胰腺等,一些散发性感染则位于上皮细胞[12-13,16]。
2十足目虹彩病毒1(DIV1)的检测方法
2.1传统检测
组织病理学是虾类病原体检测的传统病理诊断方法之一[17],通过从虾类活体或尸体中取得组织样本,将样本经过切片、固定、脱水和透明化等步骤处理后进行观察,根据具体染病特征及症状进行疾病诊断,组织病理学检测已经被应用于虾类疾病的诊断,其中就包括AHPND、WSSV、YHD和DIV1等。组织病理学检测具有准确性高、应用范围广等优点。Chen X等[18]通过组织病理学方法对感染DIV1死亡对虾进行观察与诊断,死亡对虾的肝胰腺血细胞、造血组织、血细胞与角质层上皮存在核固缩与嗜酸性包涵体,健康对虾则显示正常。在造血组织细胞、血细胞和上皮细胞细胞核旁可见典型深色嗜酸性包涵体,部分包涵体周围或含有微小的嗜碱性染色区域。在检测虾类疾病时,组织病理学检测能提供疾病的详细信息,缺点是诊断周期长、成本较高。
2.2核酸检测
除组织病理学外,分子生物学相关技术也被应用于DIV1检测。最常见的分子生物学方法是基于核酸的检测方法。相较于传统检测,核酸检测技术应用更广、灵敏度高、检测时间更短,已经被广泛应用于各类病原体的检测。核酸检测主要包括基于聚合酶链式反应(polymerase chain reaction,PCR)的检测技术、实时荧光定量PCR技术(quantitative real-time PCR,qPCR)、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)等。
2.2.1基于PCR的检测方法
聚合酶链式反应广泛应用于核酸检测,在临床诊断、基因突变检测、法医鉴定等方面有重要用途。PCR需要反复热变性以解开DNA双链,然后特异性引物结合单链并在dNTPs与DNA聚合酶的作用下延伸从而达到扩增DNA片段的作用,见图1,优点包括应用范围广、操作简便以及特异性强等[19-20]。已经有PCR相关检测方案被提出并应用于DIV1的检测,Xu L等[13]根据虹彩病毒科保守MCP序列设计兼并引物成功扩增103 bp的目的基因片段,证明研究人员发现的CQIV病毒属于虹彩病毒科。Qiu L等[12]根据SHIV高保守的ATPase基因序列设计2组引物,建立了巢式PCR体系,第一步扩增出457 bp的扩增子,第二步扩增出129 bp的扩增子,对感染WSSV、IHHNV、HPV、VPAHPND和EHP的虾提取的DNA样本进行特异性分析,结果表明,巢式PCR对SHIV具有特异性,可检测低至36 fg的DNA样本。
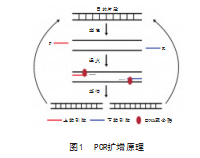
实时荧光定量PCR(quantitative real-time PCR,qPCR),是在PCR基础上,实现目的片段扩增过程实时监测的技术[21],在常规PCR体系中加入特定荧光染料或探针,随后将其放入荧光定量PCR仪器中进行扩增,根据荧光强度变化实时监测扩增进程。相比较于传统PCR,qPCR不需要依赖凝胶电泳技术对扩增结果进行判读,通过仪器化实现实时检测,能实现对于实际样本的定量分析及诊断,更具有应用潜力。Qiu L等[22-23]建立2种基于TaqMan探针的qPCR方法,目的基因分别为MCP片段和ATPase片段,2种检测方法均对DIV1具有特异性,不与其他常见虾病原体或健康虾DNA发生,反应检测限最低分别为1.2 copies/μL和4 copies/μL。由于Taqman探针造价较高,基于Taqman探针的检测方案在单次检测上没有价格优势,基于嵌合染料的qPCR检测技术更受开发商青睐,其中基于荧光染料SYBR GreenⅠ的实时PCR方法已经被成功开发[24],该方法在检测DIV1目的片段6.2×101~6.2×108 copies/μL范围内具有良好的线性关系(R2=1.000),能实现对检测样本的精准定量需求,重复性好,成本更低。需要提出的是,qPCR技术精确度高,检测过程简单,特异性好,但是整个反应进行依赖精密的仪器和具备专业操作技能的实验人员,且整个过程需要较长的时间,这限制其在现场检测的应用,如何实现仪器小型化、检测时间更短、实验结果更易判断是检测开发工作需要重点关注并解决的问题。
2.2.2环介导等温扩增(LAMP)
PCR扩增过程中的变温循环仍是其应用于现场检测的限制因素,恒温核酸扩增方法的提出能够解决这一技术壁垒。恒温扩增过程温度恒定,在环境物资匮乏的情况下仍能够进行。其中LAMP因其扩增效率高、检测灵敏度高受到更多关注,已被开发用于各类病原体的检测,包括新冠病毒的检测[25]。LAMP扩增需要具有链置换活性的Bst DNA聚合酶参与反应,在65℃条件下反应,反应开始时,内引物与目的DNA的相应区域互补结合,DNA聚合酶开始扩增这些区域,生成具有环状结构的DNA产物,生成的环状DNA产物成为新的模板,内引物继续结合并启动新的扩增循环,这个过程迅速产生大量的环状DNA,随着反应的进行是生产大量具有互补序列的DNA扩增产物,并具有交替的重复结构[26],见图2。
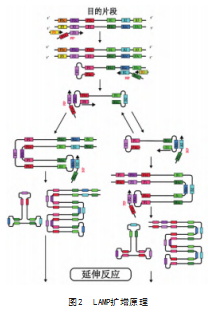
Chen X等[18]开发了靶向DIV1的RNA聚合酶Ⅱ的LAMP检测方法,通过凝胶电泳实现对于结果的判读,结果表明该方法对感染DIV1虾具有特异性。Zou Y等[27]建立了实时荧光LAMP(real-time quantitative LAMP,qLAMP)定量检测DIV1方法,选择高保守的MCP基因序列作为靶标,在50 min内可以完成整个反应,检测时间大幅缩短,相较于探针检测方法更具有成本优势,检测灵敏度为102 copies/μL。Li C等[28]开发2种可视化LAMP方法(LAMP-dye和LAMP-LFD)检测DIV1,检测限低至103 copies/μL的样本,反应时间在40 min以内,可用于现场快速检测。LAMP检测技术有扩增速度快、效率高以及温度恒定等特点[29],这些特点使其可以在环境物资匮乏的情况下实现检测,相关研究表明LAMP可检测出病毒拷贝数极低的样本,检测限可低PCR检测2个数量级[30],但LAMP存在更易出现模板污染与体系非特异性扩增等问题,可能会影响检测结果的可靠性与准确性,成功解决这些关键问题是LAMP检测技术能否继续开发并最终应用于现场检测的前提。
2.2.3重组酶聚合酶扩增(RPA)
等温扩增技术中的RP A具有更低的反应温度(37~42℃),是一种高度敏感和选择性的扩增技术。RPA反应只需少量的样品制备,在20 min以内可扩增1~10个目标DNA拷贝,在检测条件、反应时间等方面颇具优势,RPA已被应用于各种病原体检测,检测靶标包括RNA、miRNA、ssDNA和dsDNA。RPA扩增开始时,重组酶蛋白uvsX在ATP和拥挤试剂存在下与引物结合,形成重组酶-引物复合物,该复合体在双链DNA进一步寻找同源序列并通过同源位点的引物促进链入侵,为防止引物解离,互补的DNA链被单链结合蛋白稳定,最后引物与重组酶分离,在DNA聚合酶和dNTPs的存在下延长引物,循环重复该过程来实现产物指数放大[31-32](见图3)。
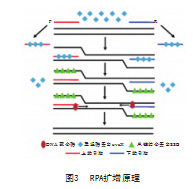
已经有相关RPA技术应用于DIV1的检测。Tong G等[33]选择ATPase作为靶标建立RPA扩增检测体系,在15 min内完成检测,检测限达200 copies/μL,研究团队该方法与巢式PCR进行临床样本测试比较,结果显示该RPA检测技术检测到弱阳性样本比巢式PCR更有效。Huang Q J等[34]开发了一种实时荧光RPA(qPRA)技术应用于DIV1的检测,通过实验优化可在39℃条件下反应20 min完成检测,检测限稳定在23 copies/μL,与其他水生病原体无交叉反应,该检测技术能够最大限度地减少样品操作程序,降低残留污染风险。RPA反应温度37~42℃,这一特点与CRISPR-Cas系统工作温度接近,CRISPR-Cas系统是识别并切割特定核酸序列的一种基因工程工具,其可以结合上游核酸扩增技术(如RPA等),再通过该系统进行产物识别切割实现对低拷贝样本的检测[35]。Xuyu Z等[36]基于DIV1中MCP基因设计RPA与CRISPR-Cas12a结合的快速检测技术,可在40 min内实现对虾样本中的DIV1进行检测,最终检测限达10 copies/μL。与传统的PCR技术和其他核酸等温扩增方法相比,RPA技术具有不需要昂贵设备、温度要求低、反应速度快等优点,使其成为资源受限地区进行快速检测的理想技术选择,但在现场快速检测中的应用仍然较少,主要原因是目前大多数RPA反应依赖于市售试剂盒,这在成本上构成了较大的障碍,在未来开发出更经济高效的相应试剂可以极大改善RPA的实际应用情况[37]。
2.2.4微流控芯片
微流控芯片技术(Microfluidic chip)是利用芯片内部流体构建微升甚至纳升级别的反应体系,最终实现后续分析自动化、微型化、集成化的一种方法技术。数平方厘米的微流控芯片集样品前处理、分离及检测等全部过程,该技术优点包括检测高通量、高效率,以及分析过程简便快速等[38-39]。基于核酸的技术在病原体检测灵敏度及特异性较传统检测方法更有优势,微流控芯片结合核酸检测技术能实现多个反应同时进行,在单一区室中进行微反应,弥补核酸多重检测在应用上的不足。虾类疾病病原体在同一个体或区域中可以同时存在,虾类疾病的多重检测是具有应用前景的研究方向之一,有人提出将LAMP联合微流控芯片建立新的检测体系用于对虾类病原体检测[40]。虽然微流控芯片技术在实验室环境中表现出色,但将其适应于现场检测仍面临挑战,包括需要便携式读取设备、环境条件的影响(如温度、湿度)以及操作人员的培训需求。
3总结与展望
十足目虹彩病毒1(DIV1)是一种新型的传染性病毒,自其被正式命名以来仅发现2种毒株,对全球的虾类养殖产业造成重大经济损失。本文主要介绍DIV1检测方法的研究进展,其中核酸检测方法主要包括PCR、LAMP、RPA及微流控芯片等。目前大多的检测技术只停留在实验室研究阶段,还未被真正应用于实际检测,未来还可能出现新的DIV1毒株,相关检测技术的特异性和灵敏性还需优化,研发出成本更低、检测更加灵敏、操作更加便利的检测方法仍是主要方向。
参考文献
[1]Naylor R L,Hardy R W,Buschmann A H,et al.A 20-year retrospective review of global aquaculture[J].Nature,2021,591(7851):551-563.
[2]Stankus A.State of world aquaculture 2020 and regional reviews:FAO webin ar series[J].FAO Aquaculture Newsletter,2021(63):17-18.
[3]Lakshmi B,Viswanath B,Sai Gopal D.Probiotics as antiviral agents in shrimp aquaculture[J].Journal of Pathogens,2013,2013:424 123.
[4]罗茵.《2020中国渔业统计年鉴》出版广东水产品总产量首次全国第一[J].海洋与渔业,2020(6):12-13.
[5]Zorriehzahra M J,Banaederakhshan R.Early mortality syndrome(EMS)as new emerging threat in shrimp industry[J].Adv Anim Vet Sci,2015,3(2S):64-72.
[6]Flegel T W.Historic emergence,impact and current status of shrimp pathogens in Asia[J].Journal of Invertebrate Pathology,2012,110(2):166-173.
[7]Liao X,He J,Li C.Decapod iridescent virus 1:An emerging viral pathogen in aquaculture[J].Reviews in Aquaculture,2022,14(4):1 779-1 789.
[8]Arulmoorthy M,Vijayan R,Sinduja K,et al.Infection with Decapod iridescent virus 1:an emerging disease in shrimp culture[J].Archives of Microbiology,2022,204(11):685.
[9]Chinchar V G,Hick P,Ince I A,et al.ICTV virus taxonomy profile:Iridoviridae[J].Journal of General Virology,2017,98(5):890-891.
[10]Montanie H,Bonami J-R,Comps M.Irido-like virus infection in the crab Macropipus depurator L.(Crustacea,Decapoda)[J].Journal of Invertebrate Pathology,1993,61(3):320-322.
[11]Lightner D V,Redman R M.A putative iridovirus from the penaeid shrimp Protrachypene precipua Burkenroad(Crustacea:Decapoda)[J].Journal of Invertebrate Pathology,1993,62(1):107-109.
[12]Qiu L,Chen M M,Wan X Y,et al.Characterization of a new member of Iridoviridae,Shrimp hemocyte iridescent virus(SHIV),found in white leg shrimp(Litopenaeus vannamei)[J].Scientific Reports,2017,7(1):11 834.
[13]Xu L,Wang T,Li F,et al.Isolation and preliminary characterization of a new pathogenic iridovirus from redclaw crayfish Cherax quadricarinatus[J].Diseases of Aquatic Organisms,2016,120(1):17-26.
[14]He Z,Chen X,Zhao J,et al.Establishment of infection mode and Penaeus monodon hemocytes transcriptomics analysis under decapod iridescent virus 1(DIV1)challenge[J].Aquaculture,2021,542:736 816.
[15]Qiu L,Chen X,Zhao R H,et al.Description of a natural infection with decapod iridescent virus 1 in farmed giant freshwater prawn,Macrobrachium rosenbergii[J].Viruses,2019,11(4):354.
[16]Sanguanrut P,Thaiue D,Thawonsuwan J,et al.The lymphoid organ(LO)is an additional,prime target for decapod iridescent virus 1(DIV1)in Penaeus vannamei[J].Aquaculture,2022,547:737 482.
[17]Lightner D.Epizootiology,distribution and the impact on international trade of two penaeid shrimp viruses in the Americas[J].Revue Scientifique et Technique(International Office of Epizootics),1996,15(2):579-601.
[18]Chen X,Qiu L,Wang H,et al.Susceptibility of Exopalaemon carinicauda to the infection with shrimp hemocyte iridescent virus(SHIV 20141215),a strain of decapod iridescent virus 1(DIV1)[J].Viruses,2019,11(4):387.
[19]何艳,蒋涛.基于链置换反应的DNA等温扩增技术应用进展[J].医学综述,2010,26(1):24-27.
[20]Kadri K.Polymerase chain reaction(PCR):Principle and applications[J].Synthetic Biology-New Interdisciplinary Science,2019:1-17.
[21]Singh C,Roy-chowdhuri S.Quantitative real-time PCR:recent advances[J].Clinical Applications of PCR,2016:161-176.
[22]Qiu L,Chen M M,Wan X Y,et al.Detection and quantification of shrimp hemocyte iridescent virus by TaqMan probe based real-time PCR[J].Journal of Invertebrate Pathology,2018,154:95-101.
[23]Qiu L,Chen X,Guo X M,et al.A TaqMan probe based real-time PCR for the detection of Decapod iridescent virus 1[J].Journal of Invertebrate Pathology,2020,173:107 367.
[24]Xu T,Tan R,Zhu Y,et al.Establishment of a SYBR Green I-based real-time PCR for the detection of decapod iridescent virus 1[J].Journal of Invertebrate Pathology,2023,201:107 998.
[25]周振杰,王冬梅,欧阳松应.环介导等温扩增技术在新型冠状病毒检测中的应用研究进展[J].福建师范大学学报(自然科学版),2022,38(5):69-78.
[26]Notomi T,Mori Y,Tomit a N,et al.Loop-mediated isothermal amplification(LAMP):principle,features,and future prospects[J].Journal of Microbiology,2015,53(1):1-5.
[27]Zou Y,Guo X,Wan X,et al.Establishment and application of the LAMP detection method for decapod iridescent virus 1(DIV1)[J].Progress in Fishery Sciences,2020,41(6):156-164.
[28]Li C,Jiang K,Qiu L,et al.Establishment of two visual interpretation methods of DIV1 LAMP amplification products[J].Journal of Virological Methods,2023,322:114 806.
[29]Shirato K.Detecting amplicons of loop‐mediated isothermal amplification[J].Microbiology and Immunology,2019,63(10):407-412.
[30]唐毕锋,马立业,曹广文.环介导等温扩增技术的应用和发展[J].实用医学杂志,2008,24(22):3 972-3 974.
[31]许淑莹,王冬梅,欧阳松应.基于RPA的病原体快速诊断策略[J].福建师范大学学报(自然科学版),2024,40(1):34-44.
[32]Lobato I M,O'sullivan C K.Recombinase polymerase amplification:Basics,applications and recent advances[J].Trac Trends in Analytical Chemistry,2018,98:19-35.
[33]Tong G,Yin W,Wu X,et al.Rapid detection of Decapod iridescent virus 1(DIV1)by re combin as e polymerase amplification[J].Journal of Virological Methods,2022,300:114 362.
[34]Huang Q J,Chen Y,Liu H,et al.Establishment of a real-time Recombinase Polymerase Amplification(RPA)for the detection of decapod iridescent virus 1(DIV1)[J].Journal of Virological Methods,2022,300:114 377.
[35]Li S Y,Cheng Q X,Wang J M,et al.CRISPR-Cas12a-assisted nucleic acid detection[J].Cell Discovery,2018,4(1):20.
[36]Xuyu Z,Jun H,Wen Y,et al.Rapid detection of decapod iridescent virus 1 by recombinase polymerase amplification combined with CRISPR-Cas12a[J].Bull Microbiol,2021,48:4 980-4 988.
[37]Gong H Y,Li Q Y,Zhang H,et al.Development and comparison of qPCR and qLAMP for rapid detection of the decapod iridescent virus 1(DIV1)[J].Journal of Invertebrate Pathology,2021,182:107 567.
[38]Gorkin R,Park J,Siegrist J,et al.Centrifugal microfluidics for biomedical applications[J].Lab on a Chip,2010,10(14):1 758-1 773.
[39]Mark D,Haeberle S,Roth G,et al.Microfluidic lab-on-a-chip platforms:requirements,characteristics and applications[J].Microfluidics Based Microsystems:Fundamentals and Applications,2010:305-376.
[40]Chang W H,Yang S Y,Wang C H,et al.Rapid isolation and detection of aquaculture pathogens in an integrated microfluidic system using loop-mediated isothermal amplification[J].Sensors and Actuators B:Chemical,2013,180:96-106.










