牛源大肠埃希菌的分离鉴定及主要毒力因子检测论文
2025-01-21 14:05:13 来源: 作者:dingchenxi
摘要:为监测某规模化奶牛场奶牛乳房炎大肠埃希菌的流行情况及携带的毒力基因,对该场进行患病乳样采集,先进行病原的分离培养,再进行PCR鉴定和同源性比较。
摘要:为监测某规模化奶牛场奶牛乳房炎大肠埃希菌的流行情况及携带的毒力基因,对该场进行患病乳样采集,先进行病原的分离培养,再进行PCR鉴定和同源性比较。结果显示,从奶牛的乳样中分离得到病细菌,分离菌株在麦康凯培养基菌落形态均与大肠埃希菌一致;扩增16S rDNA结果与预期相符,得到大小约为544 bp的目的条带。研究结果证实,引起奶牛乳房炎的病原为大肠埃希菌,为该病的临床治疗和防控提供科学依据。
关键词:大肠埃希菌;乳房炎;病原分离鉴定;毒力因子
0引言
大肠杆菌属于大肠埃希菌属,Escheri于1885年第一次分离得到,其作为人和动物肠道正常菌系的主要成员,是自然界分布较为广泛的革兰氏阴性菌,也是检测水质是否被污染的重要指标[1-2]。大肠埃希菌是一类重要的条件致病菌,其在奶牛体内常表现为无症状定植,但在某些条件下可导致严重的感染,如乳腺炎、腹泻等,给乳业造成重大经济损失[3]。本研究对牛源大肠埃希菌进行快速分离鉴定,并对其毒力特性进行系统分析,为牛源大肠埃希菌引发的疾病防控提供科学依据,制定符合现阶段临床乳房炎特征的针对性防控和治疗方案,减少经济损失并保障公共卫生安全。
1材料与方法
1.1试验材料
1.1.1试验样本
蚌埠某奶牛场采集患乳房炎奶牛乳样。
1.1.2主要试剂
ddH2O;DNA提取试剂盒购于天根生化科技(北京)有限公司;哥伦比亚血琼脂培养基、PCR试剂购于南京全隆生物技术有限公司;相关测序由上海生工完成。
1.2试验方法
1.2.1细菌的分离培养与染色
将采集的奶样涂布于哥伦比亚血琼脂培养基,37℃培养18~24 h。选取单菌落接种于哥伦比亚血琼脂培养基37℃培养18~24 h进行细菌纯化。再转接至营养肉汤培养基于37℃,培养18 h。其后制作细菌抹片,进行革兰氏染色镜检。
1.2.2 16S rDNA测序与比对
细菌基因组DNA的提取后采用16S rDNA通用引物进行PCR扩增。PCR反应总体系(25μL)包括模板DNA 2μL、premixTag酶12.5μL、去离子水8.5μL、上、下游引物各1μL。PCR扩增条件:94℃5 min;94℃30 s 30个循环;60℃30 s 35个循环,72℃1 min 35个循环;最后72℃延伸10 min。扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果于NCBI网站中进行Blast序列比对。
1.2.3大肠埃希菌的毒力基因检测
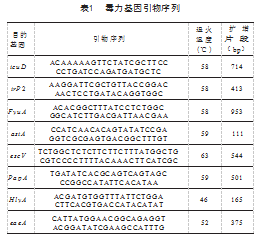
参照文献[4-8]中报道的引物序列,合成大肠埃希氏菌毒力基因escV、icuD、PapA、eaeA、irP2、astA、HlyA、FyuA共8对特异性引物,并送上海生工生物工程技术服务有限公司合成,见表1。
2结果
2.1细菌的培养结果
乳液样品在哥伦比亚血琼脂培养基上37℃培养24 h后,观察结果显示,菌落呈现出中等大小、圆形且凸起的形态,表面光滑湿润、边缘整齐,同时呈现出半透明状带有灰白色的色泽,见图1A。
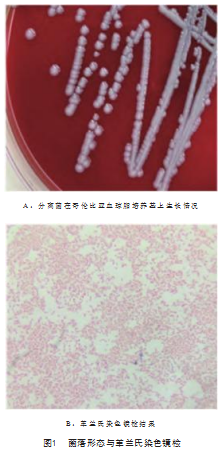
病原菌进行革兰氏染色后观察可见:革兰氏阴性菌,无芽孢,菌体成短杆状,两端钝圆,菌体较小,常成单个或成对排列,见图1B。
2.2 16S rDNA比对及进化树构建
经细菌16S rDNA通用引物扩增后测序,将测序结果进行BLAST比对可知,本次分离的细菌16S rDNA序列与大肠埃希菌一致。
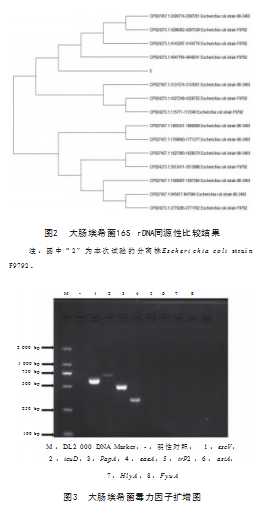
用DNAstar软件包,与GenBank上公布的大肠杆菌16S rDNA序列进行核苷酸同源性比较,根据GenBank上序结果通过MEGA11软件分析,大肠杆菌16S rDNA同源性比较结果构建系统发育树,见图2。
2.3大肠埃希菌毒力因子扩增
经测序,得出escV、PapA毒力因子检测率最高,icuD、eaeA毒力因子相继次之,irP2、astA、H lyA和FyuA毒力因子在本次试验中未被检出,结果与预期目标片段条带大小相符。大肠埃希菌8种毒力因子经过PCR扩增结果,见图3。
3讨论
奶牛乳房炎是发生在奶牛乳腺组织的炎症,在奶牛养殖业中,是极为关键且普遍的病症,其已成为阻碍行业健康、持续发展的重要因素之一,对于奶牛养殖业的稳健发展构成了显著的威胁。
本研究先将大肠杆菌从牛乳中培养分离出来,进行革兰氏染色镜检,并开展PCR扩增检测,能真实的反映奶牛乳房炎中大肠埃希菌分离率和危害性。本试验通过对大肠埃希菌escV、icuD、PapA、eaeA、irP2、astA、HlyA以及FyuA 8种毒力基因进行PCR检测。均检出escV、icuD、PapA、eaeA4株大肠埃希氏菌携带的毒力基因。剩余的irP2、astA、HlyA、FyuA 4株毒力基因未检出。基于16S rDNA基因序列进行同源性分析发现,表明分离株Escherichia coli strain F9792与Escherichia coli strain 88-3493为一族亲缘关系更近,与其他分离株序列关系较远。
本试验通过对该地区牛群乳房炎病原菌进行分离鉴定、毒力基因检测,得到了该地区牛源大肠埃希菌毒力基因携带情况,对该地区牛群大肠埃希菌病的治疗预防和提供用药指导,避免产生更多更广泛的耐药菌株。
参考文献
[1]Sokolova E,Ivarsson O,Lillieström A,et al.Data-driven models for predicting microbial water quality in the drinking water source using E.coli monitoring and hydrometeorological data[J].
Science of the Total Environment,2022,802:149 798.
[2]Rahman M T,Sobur M A,Islam M S,et al.Zoonotic diseases:etiology,impact,and control[J].Microorganisms,2020,8(9):1 405.
[3]石田,韩生义,李淑萍,等.青海牧区犊牛腹泻大肠埃希氏菌毒力基因及血清型分布特征研究[J].动物医学进展,2024(6):20-25.
[4]余佳.猪源大肠杆菌的分离鉴定、毒力基因检测及敏感药物筛选[D].福州:福建农林大学,2019.
[5]张金宝.宁夏地区牛源大肠杆菌优势血清型和毒力基因检测及耐药性分析[D].银川:宁夏大学,2016.
[6]马超.奶牛乳腺炎大肠杆菌优势血清型相关毒力基因与耐药基因的检测与序列分析[D].银川:宁夏大学,2014.
[7]张桃,苏战强,夏利宁,等.牛源大肠杆菌O157∶H7分离与鉴定及其毒力基因检测[J].中国人兽共患病学报,2015,31(12):1 136-1 141.
[8]Ewers C,Janßen T,Kießling S,et al.Rapid detection of virulence-associated genes in avian pathogenic Escherichia coli by multiplex polymerase chain reaction[J].Avian Diseases,2005,49(2):269-273.










