不同标记二抗在免疫组化检测CD3和CD21的比较研究论文
2025-01-14 11:27:04 来源: 作者:dingchenxi
摘要:免疫组化技术在动物疾病诊断和治疗中有重要的作用。试验使用仔猪肠系膜淋巴结和小鼠脾脏石蜡切片,选择3种不同标记物的二抗
摘要:免疫组化技术在动物疾病诊断和治疗中有重要的作用。试验使用仔猪肠系膜淋巴结和小鼠脾脏石蜡切片,选择3种不同标记物的二抗,即HRP、Polymer-HRP和AIexa FIuorTM 488标记物,观察CD3和CD21蛋白的表达情况,并分析结果中CD3和CD21蛋白的平均光密度值。结果显示,3种不同标记二抗的免疫组化方法染色后,都能在淋巴结和脾脏中显示CD3和CD21阳性信号,在酶标二抗中,Polymer-HRP组的平均光密度值比HRP组显著增高,且使用AIexa FIuorTM 488标记的二抗也能获得较高的阳性信号,这表明免疫组化检测中使用不同标记的二抗对组织抗原的检测结果有影响。
关键词:免疫;第二抗体;免疫酶法;免疫荧光法
0引言
免疫细胞在动物机体内发挥杀灭、吞噬和限制病原微生物等多种作用,对于维持动物健康和抵制疾病至关重要。在动物体内,当遭遇病原体如细菌或病毒感染时,T淋巴细胞迅速响应分化,细胞毒性T细胞能够特异性识别并直接杀伤被病原体感染的细胞,有效清除体内的病原体,辅助性T细胞通过激活其他免疫细胞而介导免疫反应[1]。B淋巴细胞能在抗原的刺激下分化为浆细胞,浆细胞进一步合成和分泌抗体,发挥体液免疫功能[2],因此T细胞和B细胞的变化在动物免疫功能检测中尤为重要。CD3和CD21是T细胞和B细胞的主要标志物之一[3-4],采用免疫组化方法可以直观观察到CD3和CD21的变化,常用于淋巴细胞的检测,但免疫组化的检测容易受抗原、抗体、显色等多种因素的影响[5]。为探讨不同标记的二抗在免疫组化试验中的影响,选取普通辣根过氧化物酶(HRP)标记、多聚化辣根过氧化物酶(Polymer-HRP)标记和AIexa FIuorTM 488标记的3种不同二抗进行比较,以期为免疫组化中二抗的选择提供参考。
1材料与方法
1.1石蜡切片
组织蜡块,来自28日龄健康仔猪肠系膜淋巴结和30日龄小鼠脾脏,连续切片18张,分为HRP组、Polymer-HRP组和荧光组,每组6张切片。
1.2主要试剂
HRP标记的二抗、封闭血清和CD3单克隆抗体购自武汉塞维尔生物科技有限公司;Polymer-HRP标记的二抗和CD21单克隆抗体购自湖南艾方生物科技有限公司;AIexa FIuorTM 488标记的二抗购自赛默飞世尔科技有限公司;柠檬酸钠抗原修复液和DAB显色试剂盒购自北京酷来博科技有限公司。
1.3试验方法
1.3.1免疫酶组织化学染色
取石蜡切片常规脱蜡入水,柠檬酸钠抗原修复,血清封闭,试验组滴加CD3或CD21抗体(1∶100稀释),对照组滴加TBST,4℃孵育过夜;次日滴加HRP或者Polymer-HRP标记二抗,DAB显色,苏木精复染,封片备存。利用LAS 4.9采图软件对光镜下观察的阳性细胞拍照,图片采用image pro plus(IPP)图像分析软件进行单位面积阳性信号的平均光密度分析[6]。
1.3.2免疫荧光组织化学染色
取石蜡切片常规脱蜡入水,柠檬酸钠抗原修复,血清封闭,试验组加CD3或CD21抗体(1∶100稀释),对照组加TBST,4℃孵育过夜,然后加AIexa FIuorTM 488标记的荧光二抗,室温避光孵育1 h,DAPI染色5min,甘油封片后立即在倒置荧光显微镜下观察,阳性淋巴细胞呈现明亮的绿色荧光,用软件观察阳性细胞并拍照,计算平均光密度值。
1.4统计学方法
数据采用Graphpad Prism 8.0软件和Image Pro Plus软件进行分析,试验结果以5次重复数据计算。
2结果
2.1免疫酶组织化学染色结果
免疫酶组织化学染色结果显示,CD3和CD21阳性淋巴细胞呈现棕色或棕褐色,见图1。仔猪肠系膜淋巴结可见CD3阳性细胞集中于淋巴小结边缘区呈现棕褐色,CD21阳性细胞集中于淋巴小结等区域呈现棕褐色。小鼠脾脏CD3阳性细胞集中于脾小结等区域,CD21阳性细胞散在分布于脾小结等区域。其中HRP组中可见仔猪肠系膜淋巴结和小鼠脾脏呈现部分棕色或棕黄色,而Polymer-HRP组中可见大量棕黄色或棕褐色。结果显示CD3和CD21阳性信号有一定的差异,Polymer-HRP组显色反应更深,辨识度明显,更容易显示试验结果。
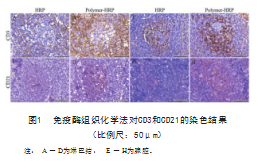
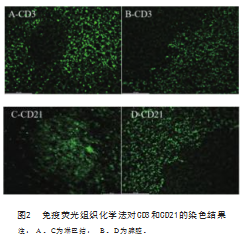
2.2免疫荧光组织化学染色结果
采用AIexa FIuorTM 488标记的二抗后,染色结果可见CD3和CD21阳性淋巴细胞呈现明亮的绿色荧光,由图2可见,仔猪肠系膜淋巴结和小鼠脾脏中都可见大量的绿色荧光。
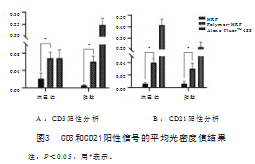
2.3平均光密度值分析结果
利用I PP软件分析免疫组化结果的平均光密度值,结果见图3。仔猪肠系膜淋巴结切片中HRP组CD3和CD21蛋白的平均光密度均值为0.021 3和0.006 2,Polymer-HRP组分别为0.067 7和0.039 8,2组的结果差异显著,AIexa FIuorTM 488组CD3和CD21蛋白的平均光密度均值为0.076 6和0.413 8。小鼠脾脏切片中,HRP组CD3和CD21蛋白的平均光密度均值为0.005 4和0.006 2,Polymer-HRP组中分别为0.060 0和0.030 1,2组差异也显著,AIexa FIuorTM 488组CD3和CD21蛋白的平均光密度均值为0.248 6和0.223 4。以上结果表明,与HRP组相比,Polymer-HRP和AIexa FIuorTM 488标记的二抗组能获得更高的平均光密度值。
3讨论
免疫组化技术因其特异性强、灵敏度高、定位准确等特点,在动物疾病诊断中发挥着不可或缺的作用。该技术的原理是基于抗体与抗原的特异性结合,以组织化学原理和技术对抗原抗体复合物进行可视化[7]。免疫组化中可以使用不同类型的标记物来显示出抗原或抗体,常用有酶标记和荧光标记。在免疫组化中,抗体的选择非常重要,其中抗体偶联标记物的选择是结果显现的重要影响因素。HRP酶标记是指由辣根过氧化物酶标记[8],HRP可催化底物产生有色沉淀并标记出抗原抗体反应产物。Polymer-HRP酶标是通过与一个多聚氨基酸聚合物的载体连接,该多聚体即可结合抗体,也能标记多个HRP/AP酶分子,产生了强大的信号放大功能[9]。常用于标记的荧光素有FITC、RB200和AIexa FIuor系列等。AIexa FIuor 488是一种能在488 nm激光谱线上被激发出明亮的绿色荧光染料[10],具有发光亮度强,光稳定性更好等特点,应用较广泛。
不同标记的二抗广泛应用在各种免疫组化检测中,但是它们之间的差异少有报道。因此,本试验选取健康仔猪肠系膜淋巴结和小鼠脾脏石蜡切片,来观察采用不同标记二抗的结果差异。试验中分为HRP组、Polymer-HRP组和AIexa FIuorTM 488组,结果发现HRP、Polymer-HRP和AIexa FIuorTM 488组都能清楚显示淋巴结和脾脏中CD3和CD21蛋白,但是其信号强弱略有不同。在HRP组中淋巴结和脾脏切片上仅在部分位置呈现CD3和CD21的棕色颗粒,而Polymer-HRP和AIexa FIuorTM 488组中出现更多的阳性信号,其中Polymer-HRP组显色反应更深、辨识度更大,定位结构更清晰,与HRP组相比较差异显著。这与刘绍琼等[11]对PEV的免疫荧光和免疫组化检测结果相似,在其他报道中使用普通HRP标记的二抗也能得到阳性结果[12]。结果显示,Polymer-HRP和AIexa FIuorTM 488标记的二抗要比HRP标记的效果更好,这给免疫组化检测方法的改进提供了依据。免疫荧光法具有特异性、敏感性和快速性等优点,在免疫检测中也发挥重要作用。本试验中AIexa FIuorTM 488荧光素标记的二抗组显现出明亮的绿色荧光,其辨识度也较强。但免疫荧光染色时容易受到胶原蛋白、福尔马林固定等因素影响,常有背景色过深等问题[13],且其结果需要借助荧光显微镜观察,荧光也容易淬灭,而酶标记的切片仅需用光学显微镜观察,也可以长时间保存,因此研究中时应根据具体情况选择合适的方法。
参考文献
[1]Wik J A,Skålhegg B S.T Cell Metabolism in Infection[J].Front Immunol,2022,13:840 610.
[2]Hoyer B F,Radbruch A.Protective and pathogenic memory plasma cells[J].Immunol Lett,2017,189(4):10-12.
[3]Liu Y,Ye S,Guo X,et al.Discovery and characteristics of B cell-like T cells:A potential novel tumor immune marker[J].Immunol Lett,2020,220:44-50.
[4]Vale A M,Schroeder H J.Clinical consequences of defects in B-cell development[J].J Allergy Clin Immunol,2010,125(4):778-787.
[5]杨红.免疫组化质量控制中的3个基本影响因素[J].临床与实验病理学杂志,2001(2):183.
[6]高艳,吴永红,张成岗.整合平均光密度和面积比两种参数用于显微图像定量分析的初步研究[J].军事医学科学院院刊,2009,33(5):405-408.
[7]杨汉春.动物免疫学(第2版)[M].北京:中国农业大学出版,2003.
[8]戚红卷,陈苏红,王升启.辣根过氧化物酶(HRP)底物的研究进展[J].军事医学科学院院刊,2007(6):560-563.
[9]张爱凤,刘建娥,刘东风,等.Polymer双染检测技术在肿瘤研究中的应用及改进[J].临床与实验病理学杂志,2010,26(4):499-500.
[10]Sumner J P,Kopelman R.Alexa Fluor 488 as an iron sensing molecule and its application in PEBBLE nanosensors[J].The Analyst,2005,130(4):528-533.
[11]刘绍琼,王健,张培培,等.免疫组织化学法与间接免疫荧光法对REV抗原定位的比较[J].中国预防兽医学报,2011,33(9):709-712.
[12]熊艳杰,裴银辉,朱玉芳,等.风湿寒症型类风湿性关节炎动物模型滑膜CD3、CD21和CD68的表达[J].华北理工大学学报(医学版),2016,18(4):259-263.
[13]Davis A S,Richter A,Becker S,et al.Characterizing and Diminishing Autofluorescence in Formalin-fixed Paraffin-embedded Human Respiratory Tissue[J].J Histochem Cytochem,2014,62(6):405-423.










