TBC1D5与策勒黑羊多胎性状的关联分析论文
2025-01-14 11:14:04 来源: 作者:dingchenxi
摘要:为研究TBC1D5基因对策勒黑羊多胎的影响,运用PCR产物直接测序技术扫描基因TBC1D5的SNP,分析了其多态位点与策勒黑羊多胎特性的相关性
摘要:为研究TBC1D5基因对策勒黑羊多胎的影响,运用PCR产物直接测序技术扫描基因TBC1D5的SNP,分析了其多态位点与策勒黑羊多胎特性的相关性,得出结果为改善地方绵羊品种的遗传性状和推动其创新利用提供科学依据。相关分析表明,g.328889 G>C与产仔数(P=0.03)显著相关。GG基因型个体的平均产仔数比GC型个体多0.33只。这一结果验证了TBC1D5基因g.328889 G>C在策勒黑羊中的多态性,对于分子标记选择和策勒黑羊的育种选育具有重要意义。
关键词:策勒黑羊;基因;多胎性状;PCR
0引言
新疆生态系统具有多样性,绵羊种质资源丰富。策勒黑羊是新疆南*独有的的一种高繁殖率的地方良种,主要分布在和田地区的策勒县,以盛产优质羔皮和多胎多产而闻名[1]。多胎性状是一种阈性状,受微效多基因控制,包括BMP15、BMPR1B和GDF9基因,至今还未发现其他有效位点与多胎性状相关[2]。
策勒黑羊的起源时间可追溯至19世纪末,从事经商的和朝拜者将库车和其他地方的黑皮羊带回与当地的母羊杂交形成[3]。策勒黑羊具有极强的生存能力,可在恶劣气候条件和粗饲的环境中生存[4]。但在2009年的统计数据中显示,策勒黑羊的数量不足4万只,为更好的利用策勒黑羊资源,进一步开发其生产性能,充分发挥策勒黑羊的繁殖性能[5],在进行杂交时,可将策勒黑羊选择为亲本的一方,利用其遗传基因中含有多胎特性,用来改善地方良种繁殖率低的情况,也可以用于培育肉用或者毛肉兼用型品系或品种,丰富国内的绵羊地方品种资源,促进当地养羊业的又好、又快的发展[6]。
1文献来源
1.1研究背景
畜禽养殖业中,羊是常见的畜禽之一,但策勒黑羊是所有绵羊中是为数不多的常年发情绵羊之一,更多的人因此研究策勒黑羊。在过去的研究中,已经发现了一些基因与羊的多胎性状相关,但是还有很多羊的多胎性状相关基因没有被发现。近年,随着基因测序技术的不断进步,通过基因测序的数据挖掘,可为羊的多胎性状相关基因的筛选和发现提供更为有效和高效的手段。因此,对羊的多胎性状相关基因的筛选和发现具有重要意义。
1.2策勒黑羊的品种介绍
依据绵羊品种地理分布及遗传关系的相关研究,可将中国家养绵羊分为三大类谱系,分别是藏羊系、哈萨克羊系和蒙古羊系,这3个绵羊谱系都起源于阿尔卡尔羊或盘羊及其若干亚种[7],这些绵羊不仅能够提供丰富的毛、肉和奶制品,还对当地畜牧业的发展起到重要的支撑作用。策勒黑羊是一种地方特色品种,属于羔皮型绵羊。这种羊全年都会发情,并且繁殖能力非常高,这也是它的一大特点。在除了性早熟以外的方面,策勒黑羊与一般绵羊品种没有太大的差异。策勒黑羊的发情周期通常是15~17 d,持续时间为2~3 d。妊娠期一般为150 d左右。在繁殖方面,母羊通常在2年内能够产下三胎以上,而在3~4岁时产羔率最高。
长期以来,当地民众倾向于选育毛卷好、繁殖力强的多胎个体作为种羊,通过世代筛选与精心培育,才培育出独具特色的策勒黑羊品种。在产区的产羔季节,选种要求十分严格。公羊需展现出双羔或多胎的繁殖优势,同时体型健硕,毛质优良,毛发卷曲且紧密,毛色有花纹且具有光泽度;母羊选种要求表现为毛发卷曲、丰富且具有高度的一致性。公母羊后代若是产三羔及以上的,则更受人们青睐。相反,未能达到标准的羔羊,则会被宰杀制成羔皮。
策勒黑羊的外貌表现为头部形态狭长,耳朵较大,鼻梁较高。母羊绝大多数没有角,仅少数有角;相比之下公羊普遍有螺旋形角,角朝上向外伸展,体型结构紧凑,胸部略窄,背腰部平直而短,十字部宽平,四肢强健有力,尾略短,呈锐三角形,尾尖通常不超过飞节。策勒黑羊通体被长毛覆盖,细毛为辫状结构,但多以粗毛较多。成年的策勒黑羊以黑色为主流,约有1/3的个体表现为棕黑色、黄黑色或灰色。极少数个体的头部、四肢乃至尾尖,会出现白斑或白星。初生羔羊基本上是全身被毛墨黑色,随着成长,其头部和四肢的毛色会逐渐变成深灰色。
1.3研究意义
为验证候选基因的多态性和基因型对产羔数的相关性,使用Sanger测序技术对PCR产物进行测序。近年来,国内学者在策勒黑羊的多胎性状、产羔数和生长性状等方面开展多项研究。讨论策勒黑羊的基因多态性位点与其产羔数繁殖性能的关联性,通过qRT-PCR技术在转录组层面上研究分析绵羊妊娠过程中的关键阶段(包括卵泡期、黄体期和妊娠期30 d)的mRNA表达量。策勒黑羊繁殖率高,常年发情,这使得它成为了理想的研究对象。本次研究为改善绵羊低繁殖率和在分子育种方面提供理论参考。
2试验材料与试验方法
2.1样品采集及DNA提取
采集绵羊颈静脉血样,将其保存在低温抗凝管中以确保血液质量。接着将这些样本带回实验室,把它们放置在-20℃冰箱中长期保存,以确保样本的质量和稳定性。最后,使用血液基因组DNA提取试剂盒来提取策勒黑羊的基因组DNA,从而对其进行了更深入的研究。通过这些样本,期望能够探究更多关于策勒黑羊的遗传基础和性状特征。
2.2主要试剂
试验所用试剂见表1。
2.3引物设计与合成
从NCBI数据库中获取TBC1D5序列(NC_ 056054。1,275,717,666-275,124,543,ARS-UI_Ramb_v2.0),并选取其310 bp的片段(28802~29111)作为目标序列。然后使用Primer Premier 6.0软件设计引物(引物信息见表2)。这个310 bp序列来自绵羊TBC1结构域家族成员5(TBC1D5)的转录变体X7。这个变异对转录有影响,因此具有研究价值。接下来对提取的DNA进行PCR扩增。PCR混合物(25μL)由2×Hieff PCR Master Mix(翌圣生物科技(上海)有限公司)12.5μL、上游引物0.5μL、下游引物0.5μL、ddH2O 10.5μL和模板DNA 1μL制成(PCR扩增引物信息见表2)。

2.4 DNA片段PCR扩增
PCR反应总体积为25μL,其中各成分的组成详见表3。PCR反应分为2个步骤:预变性步骤为在94℃下进行5 min,接下来是35个循环,每个循环包括以下3个步骤:在94℃下进行30 s的变性,60℃下进行30 s的退火,以及72℃下进行45 s的延伸。最后进行一次72℃下延伸5 min,反应结束后保持在4℃。为检测PCR产物,使用1.2%琼脂糖凝胶进行电泳,电泳条件为120 V的电压和110 mA的电流,电泳时间为25 min。

2.5 PCR产物的测序
为探究候选基因TBC1D5在影响绵羊产羔数方面的作用,借助生工生物技术(上海)有限公司提供支持的Sanger测序技术对特定PCR产物进行精准的测序。在过程中,将获得的每个样品PCR产物放入100μL的离心管中,并进行逐一标记,确保测序准确性,使得样品的测序数据与表型特征可以一一匹配。随后,抽取每个样本中的20μL作为送检样本,进行密封保存,放置于特制专用袋以免受到外界污染,为保持转运过程的低温稳定性和送样的质量,将其放在填充有冰袋的保温泡沫箱中。最后对测序结果进行分析,利用SPSS 21软件对策勒黑羊的窝产仔数与TBC1D5进行关联分析,并进一步研究基因突变位点对产羔数的影响,以便得到该候选基因对策勒黑羊繁殖性能的作用,为畜牧业生产实践提供理论支持与科学依据,提升绵羊繁殖效率和生产性能。

3结果分析
各个策勒黑羊样品DNA的质量检测评估是利用超微量分光光度计来进行分析的,观察到所有样品DNA浓度在稳定在100 ng/μL左右,A260:A280均在1.8~2.0,符合进一步开展试验的标准。进行电泳后的结果见图1,DNA条带清晰完整,可用于进行后续的PCR试验。
3.1候选基因PCR扩增
在此次试验中,采用了常规的聚合酶链式反应技术,以便获得候选基因目的片段,将所有样品均进行了PCR扩增,使用1.5%的琼脂糖凝胶电泳技术来对产物进行检测。经过检测,发现PCR产物在电泳中呈现出良好的表现,见图2。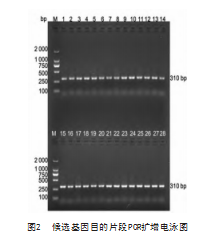
3.2候选基因PCR产物测序峰图
凝胶电泳检测结果表明,候选基因的PCR扩增产物呈现为无杂带、条带清晰现象,然后将样品标记,送至上海生工生物工程有限公司进行PCR产物测序,得到的测序结果见图3。
3.3候选基因的PCR产物测序结果和候选基因与产羔数相关性分析
SNPs位点检测发现TBC 1D5基因g.328889 G>C,表明存在2种基因型,即GC型和GG型,具体见表4。GG型基因型的平均产羔数显著高于GC型基因型(P<0.05),但整个群体的哈代—温伯格平衡状态并未受到影响(P>0.05)。
4讨论
TBC1D5又称TBC1结构域家族成员5,位于绵羊1号染色体的275 124 543~275 717 666 bp。TBC1D5是一个RabGAP家族蛋白[8],含有一个保守的TBC结构域,是一个与Rab家族的小GTPase相互作用的GAP结构域。Rab GTPases是真核细胞细胞膜转运的重要调节因子,而TBC1D5蛋白与Rab7蛋白特异性相互作用[9],Rab7参与了晚期内吞途径[10]。TBC1D5的缺失导致人类同卵双胞胎性别不一致[11]。在本研究中,TBC1D5基因有GG和GC 2种基因型可用于群体验证,初步结果表明GG型比GC型的平均产羔数高,验证了TBC1D5基因对策勒黑羊多胎的主效性。
常倩倩[12]在研究中使用重测序技术筛选出与策勒黑羊多胎性状相关的基因,并探讨了其功能,关于策勒黑羊多胎性状和生长性状的研究,常倩倩运用重测序技术筛选出了与羊多胎性状相关的基因,并对其功能进行了研究,常倩倩运用重测序技术筛选出了与羊多胎性状相关的基因,并对其功能进行了研究。张辉等[13]对策勒黑羊产羔数和生长性状关键候选基因进行了筛选,并进行了群体验证,关于策勒黑羊多胎性状和生长性状的研究,张辉对关键候选基因进行了筛选,并进行了群体验证。这些研究为策勒黑羊多胎繁殖特性及其生长发育过程中基因调控机制提供了重要的参考价值。
5结论
以上试验使用PCR产物直接测序法检测策勒黑羊中TBC1D5基因的328889 bp处发生点突变GC。相应的基因型为GG,在这个品种中表现出优势基因型特征。相关分析表明,g.328889 G>C与产仔数(P=0.03)显著相关。GG基因型个体的平均产仔数比GC型个体多0.33只。结果验证了TBC1D5基因g.328889 G>C在策勒黑羊中的多态性,对于分子标记选择和策勒黑羊的育种选育具有重要意义。
参考文献
[1]米日尼萨汗,秦崇凯,刘武军.策勒黑羊的现状及发展对策[J].新疆畜牧业,2012(S1):11-12.
[2]白杰,史洪才,刘明军,等.BMP15和GDF9基因作为策勒黑羊和多浪羊的多胎主效候选基因的研究[J].草食家畜,2007(2):1-4.
[3]肖婷.新疆策勒黑羊多胎品种选育的研究[J].畜牧与饲料科学,2016,37(4):82-84.
[4]米热妮萨·图尔荪托合提.策勒黑羊生长性状全基因组关联分析[D].阿拉尔:塔里木大学,2023.
[5]於建国,杨飞,袁军,等.策勒黑羊多胎性能的研究进展[J].中国畜禽种业,2010,6(10):57-58.
[6]李昱辉,史琳.绵羊基因组DNA的提取及TLR基因片段的PCR扩增[J].现代畜牧科技,2022(11):88-90.
[7]王慧华,赵福平,张莉,等.中国地方绵羊品种的地域分布及肉用相关性状的多元分析[J].中国农业科学,2015,48(20):4 170-4 177.
[8]Roy S,Leidal A M,Ye J,et al.Autophagy-Dependent Shuttling of TBC1D5 Controls Plasma Membrane Translocation of GLUT1 and Glucose Uptake[J].Mol Cell,2017,67(1):84-95,e5.
[9]Borg D M,Hofstad H L,Wang Y,et al.TBC1D5 controls the GTPase cycle of Rab7b[J].JCell Sci,2018,131(17):jcs216 630.
[10]Priya A,Kalaidzidis I V,Kalaidzidis Y,et al.Molecular insights into Rab7-mediated endosomal recruitment of core retromer:deciphering the role of Vps26 and Vps35[J].Traffic,2015,16(1):68-84.
[11]Inamdar AA,Diamond M,Shertz W.Gender-Discordant Monochorionic-Diamniotic Twins Both With 45,X/46,X,Idic(J)Mosaicism and a Novel Deletion Within the TBC1D5 Gene[J].Pediatr Dev Pathol,2020,23(5):392-398.
[12]常倩倩.基于重测序技术筛选策勒黑羊多胎性状相关的基因及其功能研究[D].阿拉尔:塔里木大学,2022.
[13]张辉,狄冉,王凤艳,等.策勒黑羊GDF9和BMP15基因多态性与产羔数关联分析[J].安徽农业大学学报,2022,49(2):265-271.










