非洲猪瘟的检测方法论文
2024-06-05 11:23:45 来源: 作者:xieshijia
摘要:非洲猪瘟(ASF)由非洲猪瘟病毒(ASFV)引起,极易在家猪和野猪中传播。由于非洲猪瘟的流行日益加剧和变异毒株不断出现,及时有效地诊断非洲猪瘟对于迅速控制其传播至关重要。该文阐述了与非洲猪瘟病毒相关检测病毒基因组或颗粒以及检测与非洲猪瘟相关的抗体的各种基因/蛋白质所建立最常见和最新方法,旨在为不同应用场景中选择适当诊断方法的参考,为全面控制和预防非洲猪瘟的扩散提供理论基础。
摘要:非洲猪瘟(ASF)由非洲猪瘟病毒(ASFV)引起,极易在家猪和野猪中传播。由于非洲猪瘟的流行日益加剧和变异毒株不断出现,及时有效地诊断非洲猪瘟对于迅速控制其传播至关重要。该文阐述了与非洲猪瘟病毒相关检测病毒基因组或颗粒以及检测与非洲猪瘟相关的抗体的各种基因/蛋白质所建立最常见和最新方法,旨在为不同应用场景中选择适当诊断方法的参考,为全面控制和预防非洲猪瘟的扩散提供理论基础。
关键词:非洲猪瘟;毒株;诊断;检测
Detection Methods for African Swine Fever
XU Licong1,LIAO Jinyan1,LONG Chunbei2,HUANG Lifei3
(1.Animal Disease Prevention and Control Center of Longzhou County,Chongzuo City,Chongzuo Guangxi 532400,China;2.Animal Disease Prevention and Control Center of Tiandeng County,Chongzuo City,
Chongzuo Guangxi 532800,China;3.Animal Disease Prevention and Control Center of Chongzuo City,
Chongzuo Guangxi 532200,China)
Abstract:African Swine Fever,caused by the African Swine Fever Virus,is highly contagious in domestic and wild pigs.Due to the escalating prevalence of African Swine Fever and the continuous emergence of variant strains,timely and effective diagnosis is crucial for rapidly controlling its spread.This article elucidates various established and recent methods related to the detection of viral genome or particles associated with the African Swine Fever Virus,as well as the detection of antibodies associated with African Swine Fever.The aim is to serve as a reference for selecting appropriate diagnostic methods in different application scenarios,with the ultimate goal of providing a theoretical foundation for the comprehensive control and prevention of the spread of African Swine Fever.
Keywords:African swine fever,strains,diagnosis,detection
0引言
非洲猪瘟(ASF)对我国养猪业造成严重的经济损失,非洲猪瘟病毒基因组的高度变异性使得该病毒不断演变,出现各种毒株[1]。非洲猪瘟病毒(ASFV)具有复杂的结构,包括包膜、衣壳、内包膜、核心壳和核仁,编码着丰富的结构和非结构蛋白。本文旨在综述与ASFV相关的检测方法,涵盖病毒基因组和颗粒的检测,以及ASFV抗体的检测。在实验室检测方面,PCR技术是一种高度敏感和特异的方法,可在感染早期阶段对组织、血浆和血清样本中的ASFV基因组进行检测[2]。ELISA和免疫层析法是常用的抗体检测感染状态的方法。鉴于ASF的流行和变种株的不断涌现,及时、准确的ASFV检测至关重要。本文旨在为ASFV检测方法的选择提供指导,并为未来疫情监测和控制提供理论基础。

1病毒基因组的PCR检测方法
1.1 qPCR
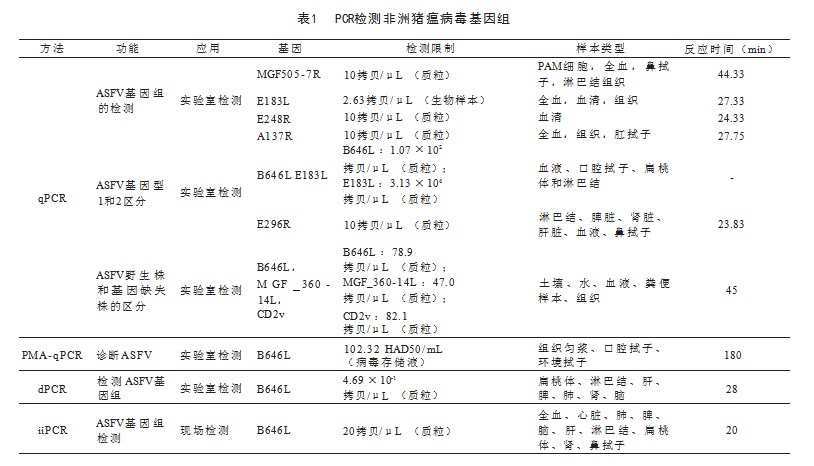
qPCR方法是在ASF实验室诊断程序中一种常见技术。B646L为ASFV毒诊断的目标基因,在进一步对非洲猪瘟病毒基因结构进行分析的背景下,已经鉴定出越来越多用于ASFV检测目的的靶基因。利用ASFVMGF505-7R基因、E183L基因、9GL基因、E248R基因和A137R基因,已经设计出各种qPCR方法显示出检测限2.63~20拷贝/μL,见表1[3]。此外,还开发了双重qPCR检测方法,针对B646L基因、E183L基因和E296R基因,以区分ASFV基因型I和II株系,以满足临床对此区分的需求。此外,三重RT-qPCR检测方法专门针对ASFVp72基因,可区分ASFV、CSFV和PRRSV。
1.2丙碘单偶氮氯化物荧光定量PCR
ASFV感染性的鉴定对于监测流行病、评估消毒措施的有效性以及消除假阴性结果,采用了乙啶单偶氮或丙碘单偶氮作为生物染色剂对样本进行预处理。该方法已应用于许多具有膜结构的微生物,包括细胞、细菌、真菌和包膜病毒。ASFV是一种包膜病毒,因此一些研究人员已应用PMA预处理来区分有感染性病毒和无感染性病毒。PMA-qPCR检测方法,用于快速诊断有感染性的ASFV以及评估消毒效果[4]。该方法表现出101.28 HAD50/mL的检测灵敏度,通过热处理ASFV的检测限为102.28 HAD50/mL,而使用氯消毒剂,检测限为105.28HAD50/mL。
1.3数字聚合酶链反应
数字聚合酶链反应(dPCR),包括液滴型数字PCR和基于芯片的数字PCR技术。定向芯片数字PCR方法通过特异性靶向B646L基因来量化ASFV。采用相同的引物和探针以ASFV标准质粒稀释10倍作为模板。结果显示cdPCR方法的LOD为每反应30.199 5拷贝,而qPCR方法的LOD为每反应1 000拷贝,表明cdPCR方法比qPCR方法敏感性约高33倍。一种多重数字PCR(dPCR)检测方法,可检测ASFV、经典猪瘟病毒和猪繁殖与呼吸综合症病毒,除了高灵敏度外,dPCR还可以提供直接的绝对定量[5]。
1.4绝缘等温PCR
利用荧光水解探针的iiPCR技术是基于Rayleigh-Benard对流原理运作的,通过变化温度梯度的循环进行扩增。以B646L基因为中心的iiPCR方法,表现出qPCR相当的灵敏性,并且只需25 min即可进行现场测试。以E296R基因为靶点的iiPCR检测方法,能迅速区分ASFV基因型I和基因型II,检测限为每反应20拷贝。因此,iiPCR方法是ASFV现场检测和基因型区分的高灵敏度和快速方法。
2多聚合酶扩增技术检测病毒基因或颗粒
2.1重组酶聚合酶扩增/重组酶辅助扩增
RPA技术是在等温环境中通过重组酶、聚合酶和单链DNA结合蛋白进行基因扩增的手段。根据具体使用的重组酶,RPA可以进一步分为RPA(T4噬菌体)或RAA(细菌/真菌)[6]。表2为多聚合酶扩增技术检测ASFV基因或颗粒。专门靶向B646L基因的RPA方法表现出高效的检测能力,在10~15 min内完成。达到3.5拷贝/μL的显著灵敏度。此外,通过开发针对相同B646L基因的RPA/RAA方法,展示了93.4和53.6拷贝/μL的灵敏度。与实时荧光定量PCR相比,这些方法在诊断结果一致。将RPA与各种方法结合,以提高ASFV的迅速可视化识别,从而增强检测效能。
2.2环介导等温扩增技术
环介导等温扩增技术涉及设计4个引物,专门靶向所需基因上的6个区域,并在恒定温度条件下利用DNA聚合酶进行扩增。已经开发了各种LAMP检测方法,以靶向特定的病毒基因,如K78R、B646L、9GL和TPII,相应的检测限分别为30拷贝/μL、10拷贝/反应、13拷贝/μL和400拷贝/μL。梯形熔解温度等温扩增(LMTIA)技术专门靶向ASFV-B646L基因。该方法表现出与商业可用的qPCR试剂盒相同的灵敏度,检测限为0.5拷贝/μL。此外,将LAMP与碳纳米点技术结合,促进了荧光生物传感器的开发,使ASFV的高灵敏度检测成为可能,检测灵敏度为15.21拷贝/μL。

2.3 CRISPR/Cas系统基于聚集的有规律间隔短回文重复
CRISPR/Cas基因检测技术依赖于Cas12a/Cas13a蛋白对特定序列的靶向剪切,导致荧光报告探针释放荧光信号[7]。将CRISPR/Cas技术与RPA或LAMP技术集成,可以在离心管或侧流层析试纸中进行反应,从而方便可视化检测过程和随后的结果解释。通过将CRISPR-Cas12a系统与LAMP方法结合开发了多种ASFV检测方法,特异性靶向B646L基因,检测限范围1~7拷贝/μL。此外,CRISPR-Cas12a/Cas13a系统与RPA/RAA方法的组合表现出10~20拷贝/μL的检测范围。
3 ASFV相关抗体检测
3.1 ELISA
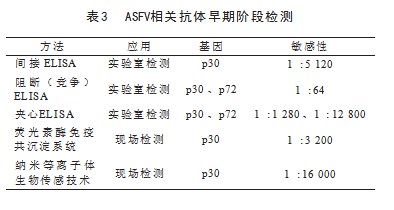
ELISA(酶联免疫吸附法)是一种依赖于抗原和抗体的特异性结合的检测技术,通常用于检测血清样本中的抗体,包括间接ELISA、阻断(竞争性)ELISA、夹心ELISA和多重ELISA(表3)[8]。利用CD2v和p30蛋白来区分野生型菌株和低毒性的CD2v缺失菌株进行双重ELISA方法检测。此外,基于ASFV的非结构蛋白,包括pB602L、pp62、pK205R、I329L、p11.5、CD2v、p22和p30的间接ELISA方法表现出有利的检测能力,分析灵敏度范围为1:1 280到1:12 800。与间接ELISA相比,阻断(竞争性)ELISA的主要优势在于对复杂抗原混合物中成分差异的高敏感性[9]。双抗原夹心ELISA是利用特定的酶偶联抗原,即p30蛋白和p72蛋白,检测灵敏度范围为1:1 280到1:12 800。
3.2免疫层析法
免疫层析法方便快速,具有高特异性和提供可视化结果,非常适合现场检测。免疫层析法利用p72作为标记蛋白,胶体金作为标签,具有1:64到1:10 000的分析灵敏度。在抗体检测领域建立额外的荧光酶联抗体检测方法。荧光素酶免疫沉淀系统法使用Gaussia荧光酶标记的p30或p35蛋白,专门用于识别猪血清中的ASFV抗体,其分析灵敏度范围从1:3 200到1:10 240[10]。利用纳米等离子体生物传感技术创建一种创新的装置用于检测ASFV抗体,能快速的反应时间、卓越的灵敏度以及通过简化的一步样本添加过程防止交叉污染。
4结束语
非洲猪瘟检测在养猪业中至关重要,有助于及时发现并控制该高度传染性疾病的传播。目前ASFV检测分为实验室测试和现场快速测试2类。实验室测试灵敏且经济,但更适合大型养殖场。现场测试可直接应用,但反应时间短,可能导致灵敏性下降。抗体检测可作为补充,评估感染状态,尤其对弱毒株感染提前敏感。未来可研究提高现场测试灵敏性,设计更全面的抗体检测技术,并应对进出口检疫和跨区域运输的挑战。
参考文献
[1]Liu Y,Zhang X,Qi W,et al.Prevention and control strategies of African swine fever and progress on pig farm repopulation in China[J].Viruses,2021,13(12):2 552.
[2]Zhao D,Sun E,Huang L,et al.Highly lethal genotype I and II recombinant African swine fever viruses detected in pigs[J].Nat Commun,2023,14(1):3 096.
[3]Qiu Z,Li Z,Yan Q,et al.Development of Diagnostic Tests Provides Technical Support for the Control of African Swine Fever[J].Vaccines(Basel),2021,9(4):343-356.
[4]Qi C,Zhang Y,Wang Z,et al.Development and application of a TaqMan-based real-time PCR method for the detection of the ASFV MGF505-7R gene[J].Front Vet Sci,2023,10:1 093 733.
[5]Shi K,Chen Y,Yin Y,et al.A multiplex crystal digital PCR for detection of African swine fever virus,classical swine fever virus,and porcine reproductive and respiratory syndrome virus[J].Front Vet Sci,2022,9:926 881.
[6]Wu K,Zhang Y,Zeng S,et al.Development and application of RAA nucleic acid test strip assay and souble RAA gel electrophoresis detection methods for ASFV and CSFV[J].Front Mol Biosci,2022,8:811 824.
[7]Yang B,Shi Z,Ma Y,et al.LAMP assay coupled with CRISPR/Cas12a system for portable detection of African swine fever virus[J].Transbound Emerg Dis,2022,69(4):e216-e223.
[8]Watanabe M,Kitamura T,Nagata K,et al.Development of a novel indirect ELISA for the serological diagnosis of African swine fever using p11.5 protein as a target antigen[J].Pathogens,2023,12(6):774-789.
[9]Zhang A,Wu S,Duan X,et al.K205R specific nanobody-horseradish peroxidase fusions as reagents of competitive ELISA to detect African swine fever virus serum antibodies[J].BMC Vet Res,2022,18(1):321-335.
[10]Ding J,Yang J,Jiang D,et al.Development of a highly sensitive Gaussia luciferase immunoprecipitation assay for the detection of antibodies against African swine fever virus[J].Front Cell Infect Microbiol,2022,12:988 355.










