非洲猪瘟病毒I10L蛋白通过靶向IKKβ抑制NF-κB信号通路论文
2024-06-05 11:14:12 来源: 作者:xieshijia
摘要:炎性因子在非洲猪瘟病毒(ASFV)致非洲猪瘟(ASF)的发病机制中发挥着重要作用,该病毒引发高度传染性且严重的出血性疾病。在本研究中ASFV的I10L蛋白可能是TNF-α和IL-1β触发的NF-κB信号通路的潜在抑制剂。在HEK293T和PK-15细胞中,异位表达的pI10L显著抑制了NF-κB信号的激活。缺乏I10L基因的ASFV突变体(ASFVΔI10L)在初代猪肺泡巨噬细胞(PAMs)中诱导了比其亲本ASFV HLJ/2018株(ASFVWT)更高水平的炎症因子产生。该研究阐明了pI10L的免疫抑制
摘要:炎性因子在非洲猪瘟病毒(ASFV)致非洲猪瘟(ASF)的发病机制中发挥着重要作用,该病毒引发高度传染性且严重的出血性疾病。在本研究中ASFV的I10L蛋白可能是TNF-α和IL-1β触发的NF-κB信号通路的潜在抑制剂。在HEK293T和PK-15细胞中,异位表达的pI10L显著抑制了NF-κB信号的激活。缺乏I10L基因的ASFV突变体(ASFVΔI10L)在初代猪肺泡巨噬细胞(PAMs)中诱导了比其亲本ASFV HLJ/2018株(ASFVWT)更高水平的炎症因子产生。该研究阐明了pI10L的免疫抑制活性,并为深入了解ASFV病理生物学以及开发针对ASF的疫苗提供参考。
关键词:非洲猪瘟病毒;炎症反应;I10L蛋白;IKKβ
African Swine Fever Virus I10L Protein Inhibits NF-κB Signaling Pathway by Targeting
IKKβ
LIAO Jinyan1,XU Licong1,HUANG Lifei2,LONG Chunbei3
(1.Animal Disease Prevention and Control Center of Longzhou County,Chongzuo City,Guangxi,Chongzuo Guangxi 532400,China;2.Guangxi Chongzuo Animal Disease Prevention and Control Center,Chongzuo Guangxi 532200,
China;3.Animal Disease Prevention and Control Center of Tiandeng County,Chongzuo City,Guangxi,Chongzuo
Guangxi 532800,China)
Abstract:In the pathogenesis of African Swine Fever(ASF)caused by the African Swine Fever Virus(ASFV),inflammatory factors play a crucial role,leading to a highly contagious and severe hemorrhagic disease.In this study,the I10L protein of ASFV is identified as a potential inhibitor of the NF-κB signaling pathway triggered by TNF-αand IL-1β.Ectopically expressed pI10L significantly inhibits the activation of the NF-κB signaling pathway in HEK293T and PK-15 cells.The ASFV mutant lacking the I10L gene(ASFVΔI10L)induces higher levels of inflammatory factors in primary porcine alveolar macrophages(PAMs)compared to its parental ASFV HLJ/2018 strain(ASFVWT).This study elucidates the immunomodulatory activity of pI10L and provides insights for a deeper understanding of ASFV pathobiology and the development of vaccines against ASF.
Keywords:African Swine Fever Virus,inflammatory response,I10L protein,IKKβ
0引言
非洲猪瘟是一种高度传染的猪类疾病,死亡率接近100%,严重影响猪的商业饲养。非洲猪瘟病毒是一种多层次的双链DNA(dsDNA)病毒,与其他大型核质DNA病毒共享结构、基因组和复制特征[1]。ASFV编码了超过160种蛋白质,使其能够在体内成功感染、复制和免疫逃逸[2]。ASFV主要靶向初级巨噬细胞和单核细胞,导致分泌前炎症细胞因子的增加,如肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、IL-6和IL-8[3]。由于其具有促炎、促凋亡和促凝血特性,升高的TNF-α水平在ASF的发病机制中起着重要作用[4]。迄今为止,对非洲猪瘟病毒的病理生物学和免疫逃逸机制了解不足,导致市场上缺乏安全有效的疫苗或抗病毒策略。本研究旨在揭示ASFV编码的I10L蛋白在TNF-α/IL-1β触发的NF-κB信号通路中的关键作用,为深入了解ASFV的发病机制提供新的见解,为开发针对ASF的疫苗提供帮助。

1材料与方法
1.1质粒构建
表达HA-、Flag-或His标签的pI10L、TRADD、MYD88、TAK1、TAB1、TAB2、TAB3、IKKα、IKKβ、NEMO、IκBα、p65、p50及其突变体的质粒采用标准的分子生物学技术构建。使用携带HA标签的pI10L或其截短突变体的稳定细胞系,采用lentivirus介导的基因编辑技术建立。HEK293T细胞转染了包装质粒psPAX2和pMD2.0G、重组质粒或空载体pLOV。36~48 h后,收集含假病毒的培养上清液,加入感染PK-15细胞。用帕培霉素筛选感染的细胞,以建立稳定的细胞系,引物见表1。

1.2 RT-qPCR
使用TRIzol试剂提取总RNA,并使用HiScript III 1st Strand cDNA合成试剂盒按照制造商的方案进行逆转录到cDNA。采用HiScript II Q RT SuperMix按照制造商的方案进行三重复合,显示的数据是相对于GAPDH的那些mRNA的相对丰度。RT-qPCR所用的引物序列见表2。
1.3免疫共沉淀和免疫印迹分析
转染携带表达指示蛋白的质粒的细胞用M2裂解缓冲液含有蛋白酶抑制剂,并超声处理2 min。裂解液在4℃离心10 min,以13 000 g离心。上清液用鼠抗Flag MAbs、兔抗HA、抗Myc、抗IKKβ或抗NF-κB p65 MAbs,或兔抗NF-κB1或抗IKKγPAbs,或抗Flag M2磁珠免疫沉淀。然后用冷M2裂解液洗涤珠子3次。通过SDS-PAGE分离结合蛋白,然后进行免疫印迹分析。
1.4统计分析
使用GraphPad Prism和SPSS Statistics进行统计分析。直方图中的定量数据以“平均值±标准差”表示。使用Log-rank(Mantel-Cox)检验或不配对的Student's t检验对数据进行分析。*的数量表示与P值相关的显著性程度,*P<0.05,**P<0.01,***P<0.001。
2结果与分析
2.1 ASFV pI10L抑制TNF-α和IL-1β引发的NF-κB信号通路激活
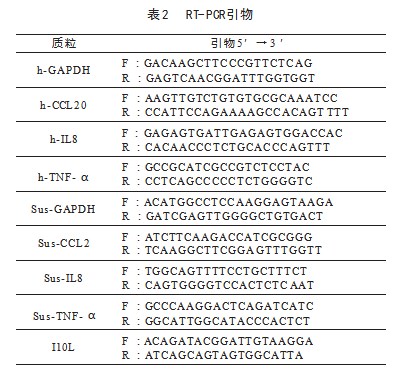
为识别与病毒诱导的炎症反应相关的候选分子,在报告基因试验中对179个ASFV蛋白进行了筛选,以确定其调节TNF-α引发的NF-κB信号激活的能力。将pNF-κB-Fluc(0.1μg)、pRL-TK(0.01μg)和表达不同ASFV蛋白的质粒(0.2μg)转染入HEK293T细胞中。20 h后,细胞用TNF-α(10 ng/mL)处理10 h,然后进行荧光素酶测定。通过筛选,鉴定出了ASFV pI10L(图1A)。HEK293T细胞转染pNF-κB-Fluc(0.1µg)、pRL-TK(0.01µg)和不同剂量的pI10L表达质粒。细胞处理和测定方式如图1A所述。在HEK293T细胞中的进一步试验表明,pI10L以剂量依赖的方式抑制了TNF-α和IL-1β引发的NF-κB启动子的激活(图1B)。为研究pI10L是否参与内源性NF-κB信号的调节,测定在pI10L表达的HEK293T细胞中经过TNF-α和IL-1β处理后多种促炎细胞因子的转录水平。HEK293T细胞转染pI10L或空载体(Vec)质粒,随后用TNF-α(10 ng/mL)和IL-1β(10 ng/mL)处理。经过RT-qPCR分析检测CCL20、IL-8和TNF-α基因的mRNA水平。外源表达的pI10L显著抑制了TNF-α和IL-1β诱导的CCL20、IL-8和TNF-α基因的mRNA转录水平(图1C)。HEK293T细胞转染pI10L或Vec质粒,然后用TNF-α(10 ng/mL)和IL-1β(10 ng/mL)处理。经过免疫印迹分析检测IκBα和p65的磷酸化水平。与空载体转染的细胞相比,TNF-α和IL-1β诱导的IκBα和p65的磷酸化,这是下游信号组分激活的标志,显著在表达pI10L的HEK293T细胞中被抑制(图1D)。这些结果表明,pI10L参与调节由TNF-α和IL-1β引发的促炎细胞因子的表达。
2.2 ASFV I10L蛋白调节IKKβ与IκBα和p65的激活和相互作用
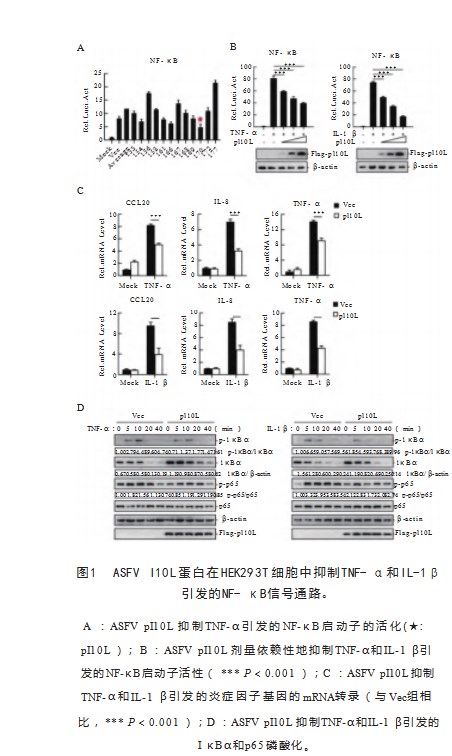
IKKβ是磷酸化IκBα和p65的主要激酶,而IKKβ的磷酸化在IKK复合物激活中起着核心作用。HEK293T细胞转染pRK(Vec)或pFlag-pI10L质粒。细胞随后用TNF-α(20 ng/mL)处理5、10、20 min或40 min,然后进行免疫印迹分析。使用ImageJ软件进行蛋白表达水平的密度分析。本研究表明,pI10L的外源表达显著阻止了TNF-α引发的IKKβ的磷酸化(图2A)。已经报道,IKK复合物的调节亚单位NEMO可以被TRAF6和TRAF2/5泛素化,而这种K63链多泛素化对于激活IKKβ至关重要。为了确定pI10L如何调节IKKβ的激活,检测了NEMO的K63链泛素化(Ub)。HEK293T细胞转染表达HA-K63O、Myc-NEMO或Flag-pI10L的质粒,随后进行共免疫沉淀和免疫印迹分析。免疫印迹分析显示,在pI10L存在的情况下,NEMO的Ub-K63链连接减少了(图2B)。HEK293T细胞转染表达HA-K63O、Myc-NEMO或Flag-pI10L的质粒,随后进行共免疫沉淀和免疫印迹分析。PAMs未感染或感染ASFVWT或ASFVΔI10L(MOI=3)24 h后,细胞被处理或不处理TNF-α(20 ng/mL)20 min,随后进行共免疫沉淀和免疫印迹分析。使用ImageJ软件进行蛋白表达水平的密度分析。与亲代病毒ASFVWT相比,ASFVΔI10L感染在TNF-α处理时一致且显著增强了IKKβ的磷酸化水平(图2C)和NEMO的K63链泛素化(图2D)。这表明pI10L通过减少NEMO的K63链泛素化抑制了IKKβ的磷酸化。已经显示IKK复合物的组装对于IKKβ的激活至关重要。研究结果表明,pI10L通过调节NEMO的K63链多泛素化来抑制IKKβ的激活。此外,pI10L与IKKβ相关,从而抑制其对IκBα和p65的激酶活性,从而抑制NF-κB信号通路的激活。
3讨论
先天免疫反应是宿主对病毒感染的首要防线,是在宿主细胞通过感知病毒结构成分(称为病原相关分子模式,PAMPs)的保守途径识别后启动的[5]。PRRs在感染后通过感知病毒PAMPs激活一系列信号事件,导致下游抗病毒效应蛋白(包括I型干扰素和促炎细胞因子)的表达[6]。ASFV是一种巨大、复杂的DNA病毒,编码了160多种在成功感染中所需的蛋白质,从而在体内实现复制和免疫逃逸。ASFV感染会激活抗病毒信号通路,增加干扰素刺激基因和促炎细胞因子的表达水平,尤其是NF-κB信号通路[7]。然而,ASFV免疫逃逸的机制仍然不清楚。本研究中,ASFV pI10L作为在病毒感染和TNF-α或IL-1β处理后抑制病毒诱导的炎症反应的抑制剂。在HEK293T细胞中转染I10L能显著抑制NF-κB启动子的活化、促炎细胞因子的转录以及由TNF-α或IL-1β引起的IκBα和p65的磷酸化。
在稳定表达pI10L的PK-15细胞中,表明pI10L在不同细胞类型中在ASFV的免疫逃逸中发挥重要作用。考虑到pI10L对TNF-α和IL-1β引发的NF-κB信号通路的无偏效应,假设pI10L在TAK1-TABs复合物的水平或下游发挥作用。pI10L抑制了p65以及NF-κB信号通路中p65上游的所有被测试蛋白的活化。此外,发现pI10L与IKKβ、NEMO和NF-κB有关联。有几种可能的机制解释pI10L的功能。首先,pI10L通过干扰IKKβ复合物的组装或NEMO的多泛素化来抑制IKKβ的激活。其次,pI10L可能抑制p65与p50的结合。最后,pI10L可能阻断p65的激活和核转运。结果表明,pI10L通过调节NEMO的K63-泛素化来抑制IKKβ的磷酸化,同时通过与IKKβ相互作用减弱其对IκBα和p65的催化活性。然而,pI10L对NF-κB或IKK复合物的组装仅有轻微干扰。IκBα和p65在TNF-α和IL-1β引发的NF-κB信号通路中被IKKβ磷酸化[8]。因此,在体外进行了激酶活性分析。结果证实IKKβ能够磷酸化IκBα和p65,但pI10L显著抑制了这一过程,因为pI10L中断了IκBα和p65与IKKβ的结合。pI10L通过与IKKβ直接结合、阻碍其催化中心或与IκBα和p65竞争作为底物来抑制IKKβ的激酶活性。
此外,通过使用I10L基因删除的ASFV,探讨了pI10L对促炎细胞因子表达的影响。结果显示,pI10L在PAMs中轻微影响了ASFV的溶血吸附和复制。然而,与ASFVWT相比,ASFVΔI10L引起了NF-κB信号通路的更强烈激活。到目前为止,已经鉴定了几种其他调节NF-κB激活的ASFV编码蛋白,如pL83L、pMGF505-7R和H240R蛋白(pH240R)[9]。缺乏这些基因的ASFV导致各种促炎细胞因子表达减少和病毒复制增加,而这些调节蛋白之间的关系尚不清楚。单一基因缺失几乎不影响ASFV的毒力(除了pMGF505-7R和pH240R),这可能是因为这些蛋白在病毒感染和发病的不同阶段共同发挥作用。例如,这些蛋白可能在病毒感染的不同阶段参与炎症反应。为了加快对ASF的有效疫苗的研发,需要进一步深入研究这些蛋白如何共同发挥作用。
4结束语
pI10L通过靶向IKKβ在调节TNF-α和IL-1β引发的NF-κB信号通路中发挥了关键作用。由于炎症反应在ASF的发病机制和宿主抗病毒先天免疫中起着重要作用,因此pI10L的发现有助于阐明ASFV复杂的免疫逃逸机制,并可能为发现用于开发新型ASF疫苗或抗病毒药物的潜在靶点提供线索。
参考文献
[1]Shao Z,Su S,Yang J,et al.Structures and implications of the C962R protein of African swine fever virus[J].Nucleic Acids Res,2023,51(17):9 475-9 490.
[2]Malogolovkin A,Kolbasov D.Genetic and antigenic diversity of African swine fever virus[J].Virus Res,2019,271:197 673.
[3]Zakaryan H,Cholakyans V,Simonyan L,et al.A study of lymphoid organs and serum proinflammatory cytokines in pigs infected with African swine fever virus genotype II[J].Arch Virol,2015,160(6):1 407-1 414.
[4]Zheng Y,Li S,Li S H,et al.Transcriptome profiling in swine macrophages infected with African swine fever virus at single-cell resolution[J].Proc Natl Acad Sci USA,2022,119(19):e2 201 288 119.
[5]Hu M M,Shu H B.Innate Immune Response to Cytoplasmic DNA:Mechanisms and Diseases[J].Annu Rev Immunol,2020,38:79-98.
[6]Yang Q,Shu H B.Deciphering the pathways to antiviral innate immunity and inflammation[J].Adv Immunol,2020,145:1-36.
[7]Cackett G,Portugal R,Matelska D,et al.African Swine Fever Virus and Host Response:Transcriptome Profiling of the Georgia 2007/1 Strain and Porcine Macrophages[J].J Virol,2022,96(5):e0 193 921.
[8]Schoggins J W,MacDuffD A,Imanaka N,et al.Corrigendum:Pan-viral specificity of IFN-induced genes reveals new roles for cGAS in innate immunity[J].Nature,2015,525(7 567):144.
[9]Li D,Yang W,Li L,et al.African Swine Fever Virus MGF-505-7R Negatively Regulates cGAS-STING-Mediated Signaling Pathway[J].J Immunol,2021,206(8):1 844-1 857.










