索非那新琥珀酸盐合成工艺比较论文
2024-04-29 09:47:46 来源: 作者:liyuan
摘要:本文对琥珀酸索非那新不同的合成路线进行了研究对比。通过对比发现,由(S)-1-苯基- 1,2,3,4-四氢异喹啉引入离去基团(Lv)后,与(R)-3-奎宁环醇发生酯化反应,成盐,总收率约 90%,具有明显的优势,不仅具有较高的收率,而且产品质量好,也更加适合工业化生产。
摘 要:本文对琥珀酸索非那新不同的合成路线进行了研究对比。通过对比发现,由(S)-1-苯基- 1,2,3,4-四氢异喹啉引入离去基团(Lv)后,与(R)-3-奎宁环醇发生酯化反应,成盐,总收率约 90%,具有明显的优势,不仅具有较高的收率,而且产品质量好,也更加适合工业化生产。
关键词:索非那新;膀胱过度活动症;化学合成
琥珀酸索非那新(solifenacin succinate),化学名 为(3R)-1-氮杂双环[2.2.2]辛烷-8-基-(1S)-1-苯 基-3,4-二氢-1H-异喹啉-2-甲酸酯丁二酸盐,是日 本 Astellas 公司开发的选择性毒蕈碱 M3 受体拮抗 剂,能选择性松弛膀胱逼尿肌,用于治疗有尿频尿急 症状的膀胱多动症(OAB)[1]。
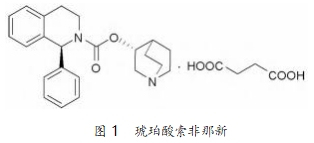
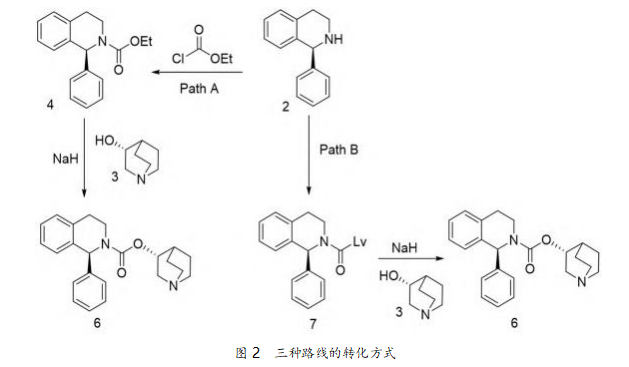
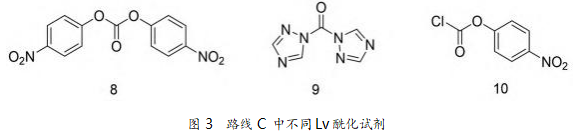
目前,公开报道的合成 1 的方法有多种,在生产 中具有价值 的 主流路线均是以(S)-1 - 苯基 - 1,2,3,4-四氢异喹啉(2)和(R)-3-奎宁环醇(3)作 为关键中间体。其中,合成方法上的主要差别在于 对 2 的转化方式(图 2)。路线 A 中 2 与氯甲酸乙酯 缩合,然后在强碱 NaH 作用下,在甲苯中与(R)-3- 奎宁环醇(3)回流,发生酯交换反应生成 6。路线 B 中先将 3 氯甲酰化,然后其盐酸盐与 2 在吡啶溶剂 中反应生成 6。路线 C 是通过对 2 引入离去基团 (Lv)后,再与 3 进行缩合得到 6。上述方法各有优劣 势。例如,路线 B 使用了大量的吡啶,按目前流行的 绿色化学的观点来看,环保安全不能满足要求。
1 实验部分
1.1 路线 A
1.1.1 化合物 4((S)-1-苯基-3,4-二氢异喹啉-2 (1H)-羧酸乙酯)的合成
将甲苯溶剂和水的混合溶剂(甲苯和水的量分 别为 12 mL 和 8 mL)开启搅拌,在搅拌的过程中分 别加入化合物 2((S)-1-苯基 -1,2,3,4-四氢异喹 啉)(2.4 g,5.7 mmol)和无水碳酸钾(1.66 g,6.0 mmol);搅拌均匀后,将整个体系降温到 0~10 ℃之 间,然后开始滴加氯甲酸乙酯(1.3 g,6.0 mmol),在 滴加过程中要保持整个体系的温度维持在 0~10 ℃ 之间;滴加完毕后,撤掉冷媒,将体系内的温度自然 回温至室温(25~30 ℃),并在室温下反应 1 h。反应 完毕后,分液,弃掉水层,将有机层进行 4 次洗涤、分 液,洗涤剂分别为自来水(10 mL)、盐酸(1 mol/L,4 mL)、自来水(10 mL)和饱和氯化钠溶液(16 mL);洗 涤完成后,还需要进行干燥处理(无水硫酸钠),然后 将滤液控制在 35 ℃温度下进行减压蒸馏,蒸至无液 体流出,得到无色油状物 4(3 g)。
1.1.2 化合物 6(索非那新)的合成
在甲苯溶剂(30 mL)中加入上一步制备的化合 物 4(3 g,5.3 mmol),开启搅拌,将甲苯溶液逐渐加 热至 110~120 ℃ , 并在此温度下搅拌 2 h,以除掉溶 液中的水分;然后冷却降温到 70~80 ℃ , 加入(R)- 3-奎宁环醇(4.04 g,12.2 mmol),再分批次地加入 60%氢化钠(0.42 g,8.8 mmol)。加入完毕后,将整个 甲苯体系升温至 140 ℃,形成微回流,回流的液体 (乙醇副产物)分开收集,保持此反应状态 6 h。停止 保温,并将反应体系自然冷却至室温(25~30 ℃),将 溶液进行3次洗涤、分液,洗涤剂分别为饱和氯化钠溶液(20 mL)、自来水(16 mL)、盐酸(1 mol/L,8 mL);最后再用2 mol/L氢氧化钠溶液将有机相调至碱性pH约为10。接着再用乙酸乙酯(40 mL)萃取,并依次用水(16 mL)和饱和氯化钠溶液(20 mL)洗涤。最后经无水硫酸钠干燥、过滤,滤液在35℃以下减压蒸馏至无液体流出,得淡黄色油状物6(3.38 g,以6计收率81.3%)[2],直接投入下步反应。
1.1.3琥珀酸索非那新的合成
将Step 2的黄色油状产物1.69 g溶于15.8 mL乙酸乙酯和0.7 mL无水乙醇混合溶液中,加入0.54 g琥珀酸,加热回流搅拌反应20 min,加热后很快有大量白色晶体析出。体系搅拌冷却至室温(25~30℃),搅拌析晶2 h,然后冰浴中降温至10℃搅拌析晶1 h。抽滤,晶体用10℃的乙酸乙酯溶剂洗涤(500 mL×2)。60℃真空干燥得粉末状白色晶体,干重:1.63 g,总收率75%。纯度99.3%(HPLC归一化法:色谱柱Phenomenex Gemini C18柱(4.6 mm×250 mm,5μm);流动相:磷酸氢二钾溶液(磷酸氢二钾4.35 g溶于水500 mL中,用磷酸调至约pH 6)-乙腈(55∶45);检测波长210 nm;流速1 mL/min;柱温40℃;tR 5.7 min[3]。
1.2路线B
1.2.1化合物7的合成
氮气保护下,将120 g Lv酰化剂(结构如图3)加入800 mL甲苯中,密封反应容器,室温下搅拌溶解,冰浴将反应体系冷却至3℃。200 g化合物2,加入600 mL甲苯,室温下搅拌溶解(溶解过程为吸热反应,可适当加热促进溶解);溶解完全后加入15 g(77 mL)吡啶,冷却至室温,缓慢滴加至上述体系中,保持温度低于10℃。反应放热很剧烈,前期滴加应缓慢,中期可稍快,后期可快速滴加。滴加完毕后移去冰浴,加热至80℃搅拌反应45 min(升温至50℃开始计时),TLC监测反应结束,体系冷却至室温。加入 60 g 硅藻土,搅拌 10 min,抽滤除去吡啶盐酸 盐,得黄色澄清溶液;60~65 ℃减压蒸除溶剂,得红 褐色油状物 298.86 g。
1.2.2 化合物 6 的合成
110.48 g 化合物 3、THF 1 600 mL 加入 5 000 mL 反应瓶中。先缓慢加入 60% NaH 至体系无明显 气饱溢出,再投入共计 86.88 g 的60% NaH。加热至 回流,搅拌 45 min。Step1 油状产物 298.86 g 加入
500 mL THF,搅拌溶解;缓慢滴加到上述回流体系 中,滴加速度约为 3~4 滴/s,总滴加时间约为 2.5 h。 TLC 跟踪反应 ,至化合物 3 点基本消失时结束反 应。体系冷却至室温(30 ℃),缓慢滴加水,完全淬灭 未反应的 NaH,用水(800 mL)洗涤 5 min;分液,水 相加入 500 mL 甲苯搅拌萃取 5 min;分液,合并有 机相,加入饱和 NaCl 溶液 800 mL 洗涤 5 min;分 液,有机相用 20% HCl 500 mL 提取 20 min;分液, 水相用 2 mol/L NaOH 溶液调节 pH 约为 10;水相用 1 600 mL 乙酸乙酯提取 10 min;分液,有机相用饱 和 NaCl 溶液 800 mL 洗涤 5 min;分液,有机相加入
500 g 无水硫酸钠搅拌干燥 4 h,50~60 ℃减压旋蒸 除去溶剂,得黄色油状产物 326.06 g。
1.2.3 琥珀酸索非那新的合成
将 Step 2 的黄色油状产物 326.06 g 溶于 1800 mL EA 和 135 mL 无水 乙醇混合溶液 中 ,加入 102.57 g 琥珀酸;加热回流搅拌反应 20 min,很快有 大量白色晶体析出。体系搅拌冷却至室温(30 ℃), 搅拌析晶 2 h;然后冰浴中降温至 10 ℃搅拌析晶 1 h。抽滤,晶体用 10 ℃的 EA 洗涤(500 mL×2)。60 ℃ 真空干燥得粉末状白色晶体,干重:379 g ,总收率 90.8%。
2 结果与讨论
将上面两个实验的过程和结果进行对比可发 现,Path A 的合成路线先由(S)-1-苯基-1,2,3,4- 四氢异喹啉与氯甲酸乙酯缩合生成酯类化合物,然 后再与(R)-3-奎宁环醇发生酯交换反应,成盐,总 收率约 75%;其中第一步反应简单高效,但在第二 步的酯交换反应中,需要高温并移走产生的乙醇才 能推动反应平衡右移,长时间的高温使副反应加剧, 杂质增多,给产物的纯化带来不利影响。如应用到中 试或生产,偏高的能耗也是一大弊端。Path B 的合成 是由(S)-1-苯基-1,2,3,4-四氢异喹啉与 Lv 酰化 试剂发生酰化反应生成甲酰化物质后,再与(R)-3- 奎宁环醇发生酯化反应,成盐,总收率约 90%;其收 率比较客观,纯度也比较高,工艺快捷安全,生产效 率高,操作的可行性和安全性比 Path A 高。
3 结论
通过两条路线的对比发现,路线 B 不仅具有较 高的收率,而且产品质量好、工艺快捷安全、生产效 率高,更适合用于工业化生产。
参 考 文 献
[1] 陈燕, 李金升, 孟庆军, 等. 索利那新治疗膀胱过度活动 症 4 周疗效分析[J]. 第三军医大学学报, 2011, 33(1): 104-105.
[2] NATO R, YONETOKU Y, OKAMOTO Y, et al. Synthesis and antimuscarinic preperties of quinuclidin-3-yl 1,2,3,4-tetrahydroisoquinoline-2-carboxylate derivatives as novel muscarinic receptor antagonists[J]. J Med Chem, 2005, 48(21): 6597-6606.
[3] 李强, 朱金林, 黄伟, 等. 琥珀酸索非那新的合成[J]. 中 国医药工业杂志, 2012, 43(1): 1-4.










