天然食用色素在食品中应用及稳定性研究论文
2024-04-29 09:39:29 来源: 作者:liyuan
摘要:天然食用色素除了能够补充食物在加工过程中损失的色泽,还兼具安全性、抗氧化能力等 生物活性优势。本文分析了目前市面上不同来源的天然食用色素的分离和纯化方式以及不同来源 的天然色素在食品应用中的特点,探讨了各种天然食用色素在食品加工领域的应用现状,针对天然 色素的不稳定性,归纳总结了增强其稳定性的方法,为天然色素在食品加工领域的应用和发展提供 了一定的参考和借鉴价值。
摘 要:天然食用色素除了能够补充食物在加工过程中损失的色泽,还兼具安全性、抗氧化能力等 生物活性优势。本文分析了目前市面上不同来源的天然食用色素的分离和纯化方式以及不同来源 的天然色素在食品应用中的特点,探讨了各种天然食用色素在食品加工领域的应用现状,针对天然 色素的不稳定性,归纳总结了增强其稳定性的方法,为天然色素在食品加工领域的应用和发展提供 了一定的参考和借鉴价值。
关键词:天然食用色素;提取工艺;食品应用;稳定性
颜色是衡量食品质量和营养成分最直观的表 现。在食品中添加颜色是为了增加其吸引力,弥补 食品在加工过程中造成的颜色损失,提高产品的质 量。食品营销与色彩存在很大的关联,比如眼睛看 到橙色的饮料就会暗示大脑这是橙子与橘子味的味 道。天然染料是指从植物、昆虫、动物和微生物等自 然来源中提取的染料。在这些天然染料中,植物性 色素最具药用价值,是应用最广的天然染料。当前, 在开发具有成本效益和可行性的食品色素过程中, 其制备技术及其在食品加工领域的应用虽是一项挑 战,但也拥有广阔的市场发展前景和需求。
化学合成的染料,颜色稳定,产量更高,价格更 便宜,但存在一定的安全隐患[1],人工合成色素都是 从石油中提炼出来的,比如,柠檬黄作为一种常用食 用色素,常用于糖果、冰淇淋、麦片、汤、果冻、蛋糕、 饮料和其他食品的制作过程中,是最具安全性争议 的色素添加剂之一。该色素能与人体血清蛋白相互 作用,可能与儿童患多动症有关[2-3]。苋菜红也是人 工合成的染料,可使糖果、冰淇淋和饮料等食品呈红 色,但其具有致癌性[4],当然这种毒害作用也与添加剂的剂量密切相关,但面对不同人群,其可食用的安 全剂量也不同。基于此,与人工合成色素对健康的潜 在影响相比,天然色素不仅安全,还带有生物功能活 性,例如抗氧化和抗菌能力,因此天然色素染料更受 市场青睐。

1 天然染料的提取方法与来源
1.1 植物性色素
植物色素是指由植物自身代谢生成的天然引 物,植物色素主要包括三大类,分别为花青素、类胡 萝卜素和甜菜色素[5],甜菜色素是从酪氨酸中提取 的吡啶色素,提取的甜菜色素有红色和黄色两种颜 色,在进行超声波处理前配以有机溶剂就可以从苋 菜叶,甜菜根、仙人掌果实,火龙果中提取;甜菜色素 本身还具有抗氧化抗菌的功效,在高温和碱性条件 下,红色的甜菜色素中的醛二胺键会发生水解,变成 黄色。叶黄素和类胡萝卜素是食物中特有的淡黄色 与橙色色素,是多烯色素[6],可以利用超临界流体萃 取的方式从胡萝卜、南瓜、辣椒和番茄中提取[7];类 胡萝卜素在食品加工和储存的过程中容易被异构化,也很容易在加工过程中因氧化而失去黄色[8]。花 青素也是一种常见的酚类天然色素,大部分蔬菜和 花卉中都含有丰富的花青素[9-10];其在弱酸的条件下 呈红色,在中碱性条件下呈紫色。花青素是一个水 溶性的色素染料,在进行食品加工时稳定性较差。 具体的植物色素提取方式详见表 1。
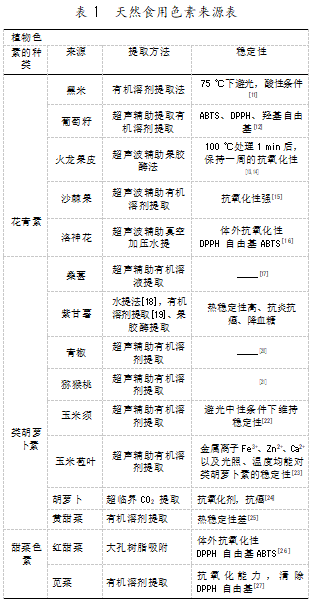
综上,植物性色素来源广,提取成本较低,但是 由于植物性色素大都具有抗氧化活性,在食品加工 过程中容易被氧化,而且在不同 pH 条件下还会呈 现不同的颜色,添加了天然植物色素的食品对保存 条件的需求会更苛刻,而且添加天然色素还会缩短 食品的保质日期。因此,植物色素很难可以达到化学添加剂鲜艳饱满的颜色。
1.2 动物色素
带壳的水生动物可以利用从藻类中摄取类胡萝 卜素,并通过代谢反应对自身进行修饰。甲壳类动物 可以将 β-胡萝卜素转化为虾青素,并将其积累在外 皮、甲壳、卵和卵巢中。通过代谢转化,其体内的类胡 萝卜素会将其颜色从黄色的 β-胡萝卜素变为红色 的虾青素[28]。在生产生活中,人类可以利用微波辅助 和生物酶法从海洋生物中提取虾青素[29]。除了大多 数可以作为天然红色食用色素来源的植物,还有一 种依附于仙人掌的昆虫胭脂虫;从胭脂虫中提取的 红色素,无论是热稳定性还是颜色鲜艳程度,都优于 植物色素。
动物色素的优点是稳定性高,但其提取成本远 高于植物色素,颜色也没有植物色素丰富,目前动物 色素的商业化使用还非常有限。
1.3 微生物色素
微生物产生的天然色素可以免受季节影响,同 时可以减少化学提取过程中造成的环境污染问题 [30]。比如从植物中提取的花青素会受地域、保存条件 等多种因素影响,在大肠杆菌中插入一段产生花青 素的基因,优化培养条件,就可以直接在大肠杆菌的 代谢过程中产生代谢产物花青素[31]。类胡萝卜素和 虾青素可以从微藻中提取,比如利用雨生藻在其补 料批量时添加营养物质,让雨生红细胞生产虾青素。 红曲红色素是红曲的次级代谢物,红曲红色素本身 具有抗氧化特性,使用红曲色素代替亚硝酸盐腌制 肉类,不仅可以使肉在腌制过程中保持色泽红润,还 可以减少亚硝酸盐的毒害作用,同时也具有一定的 抑菌作用。
目前,大规模使用微生物合成色素依旧比较困 难,在调节微生物的代谢途径、避免其生成有害物 质、减少副产物的积累和促进色素合成途径的发展 等方面,还需要进行进一步的调控与改进。
2 天然食品色素的分离纯化
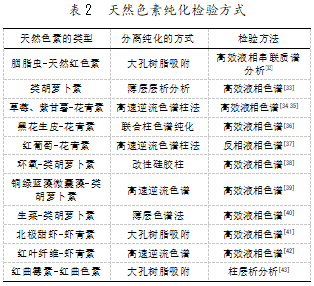
天然食物色素的提取方法大部分都是用有机溶 剂(甲醇、乙醇、丙酮)提取的,提取方法简单,通过这 种方式提取出来的物质大多是混合物,提取物的质 量也参差不齐。在作为食品添加剂时,就无法参照准确的数据依据,无法判断提取色素质量的高低;在利 用有机溶剂进行提取时,由于提取溶剂也是有毒物 质,损害了天然色素的质量,提取的色素需要我们进 行进一步分离纯化以得到纯度更高的色素。提取色 素的方式集中于树脂吸附和高速逆流色谱柱分离 等,具体方式见表 2。
3 天然色素在食品中的应用
消费者对人工合成色素的担忧推动了对天然色 素开发和推广,消费者很容易将天然食用色素与健 康联系在一起。天然色素可以增添食品的颜色,我 国出台的国标《食品安全国家标准 食品添加剂使用 标准》(GB 2760)中允许添加到食品中的天然色素 有 40 多种,普遍用于奶酪制品、酒水饮料,肉制品加 工等各个领域。当然,添加到食品中,也要考虑色素 本身的稳定性,根据色素的特性添加适宜的色素。
3.1 烘焙食品
关于天然食用色素在烘焙食品中应用情况的报 道文献不多,这可能与部分植物性色素热稳定性弱、 不适宜作为食品添加色素参与烘焙食品加工的现状 有关。彩色小麦粉富含花青素,有助于预防各种慢 性疾病,用彩色小麦烘焙的面包富含类胡萝卜素,但 在烘焙过程中还是损失了许多花青素和类胡萝卜 素[44];胭脂虫中提取出来的红色素,在强酸条件下呈 红色,在碱性条件下呈紫色,但是胭脂虫提取出来的 红色素不受光和温度影响,还能螯合金属离子形成 胭脂红,胭脂红十分稳定,不受 pH 影响,可广泛应用于面包制作中,但是胭脂虫在提取胭脂红色素时 会有虫体蛋白残存其中,导致提取出来的色素品质 差、有异味,且研究发现残留在色素产品中的虫体蛋 白可能会导致人体过敏,引发过敏性哮喘等[45]。
3.2 饮料
饮料的颜色是其作为消费品被接受的一个非常 重要的视觉属性,不同饮料都有自身独特的属性,比 如牛奶需要添加脂溶性色素,水果饮料需要水溶性 色素等,由此可见,需要根据饮料的特性挑选合适的 色素。花青素颜色丰富,酸性条件下花青素可以维持 好看的红色,商业上常常被用于做酸奶的食品添加 剂,同时富含花青素的提取物显示出了其作为饮料 着色剂,质量浓度为 40 mg/mL 时抑制淀粉降解酶 约 1%的潜力[46]。天然色素着色能力强,在饮料中添 加 0.03%~0.04%就能达到着色的目的[47],洛神花是 一种可食用花萼,富含大量花青素,使用喷雾干燥的 洛神花青素多被用作饮料和明胶甜点的着色剂。而 且结果显示,这些食品中的色素在长达 4 周的储存 过程中仍可保持稳定[48]。花青素清除氧自由基的活 性最强,可以抑制脂蛋白氧化和血小板聚集。葡萄酒 中的花青素有助于软化心血管[49]。甜菜红色素在 pH 为 3~7 时颜色稳定,红甜菜提取的甜菜素带有泥土 的味道,仙人掌果实中的也富含甜菜红色素,已成为 饮料色素的另一重要来源。β-类胡萝卜素是一种天 然的橙色的脂溶性色素,具有高维生素活性,常用作 果味饮料的添加剂。
3.3 肉类
肉类富含脂类物质,易脂质氧化会导致肉类质 量下降,肉类产品在加工过程中往往需要补充红色 色素来维持其色泽的健康性,也需要添加抗氧化物 质,延长其保质期。花青素和甜菜红素具备天然抗氧 化活性,在猪肉碎中加入 2%的甜菜素能显著增强 其抗氧化活性,在牛肉香肠和煮熟的火腿中添加甜 菜红素可以削弱其保存过程中的减色度[50]。红曲色 素主要适合作为腌制品的添加剂,在肉末中添加 1.00%的红曲色素,储存一周或两周后就会发现红 曲色素具有显著的抗氧化活性,红曲色素在减少贮 藏过程中氢氧化物的形成方面具有较强的抗氧化作 用[51],同时可以减少亚硝酸盐的毒害[52],加上红曲色 素本身具有一定的抗菌性,因此还可以延长食品的货期。
4 增强天然食用色素稳定性的途径
天然食品色素虽然颜色丰富,安全性高,但其 光、热稳定性差,在食品加工过程中容易变色,且不 利于加工食品保藏。为了提高天然色素的热稳定性 和化学稳定性,研究者开发了不同的方式以期改善 这一现象。
4.1 化学方式
将提取出的色素不稳定的官能团通过化学反应 形成新的稳定的官能团。花青素和甜菜碱都是不稳 定的水溶性色素,花青素的糖分子可以通过酯键与 有机酸的酰化,增强其热稳定性和光电阻率,改变花 青素的分子大小和极性,降低其水溶性[53],增强其在 加工过程中的热稳定性[54]。甜菜碱的热不稳定性限 制了其在食品加工领域的应用,可以利用漂烫的方 式灭活甜菜色素脱色酶,在其脱色后,将异抗坏血酸 添加到甜菜花青素溶液中有助于再生甜菜色素,再 生甜菜色素的热稳定性可以得到显著提升[55]。红曲 色素在 pH 为 4 时不溶于水且会形成沉淀,酪蛋白 有亲水基团,通过红曲色素与酪蛋白结合使其形成 红曲色素-酪蛋白酸钠复合物,可以形成稳定红曲 色素,且能够避免其在酸性条件下沉淀[56]。
4.2 包封微胶囊化
包封是一种将生物的活性成分捕获在合适的载 体中的方法,微胶囊化是食品工业中最常用的包封 方式,而纳米胶囊由于封装高效、稳定性高、可以有 针对性地释放封装物质且能够包封大分子物质而越 来越受关注了。利用冻干法对酸樱桃皮提取物中的 花青素进行微胶囊化,以乳清蛋白分离物和阿拉伯 胶为包衣剂。所提取的粉末具有良好的抗氧化性, 以封装的花青素颜料作为果冻粉中人造色素的替代 品,与人工合成着色剂相比,使用 7%封装的花青素 颜料的果冻在所有感官属性和物理化学的评估中得 到了更高的分数[57]。微胶囊化和纳米胶囊化是保护 颜料免受有害环境条件影响的有效平台,可以提供 有针对性的受控释放[58]。利用喷雾干燥分装工艺将 仙人掌中的甜菜碱素封装到麦芽糖糊精机制中,既 可以保留甜菜黄素的鲜黄色,还可保留其抗氧化活 性[59]。
5 总结与展望
天然来源的色素通常比人工合成的颜料更昂 贵,而由于当前消费市场日益重视食品安全和健康 的发展趋势,食品着色剂公司纷纷展开了对天然食 品着色剂的研究与开发。获取稳定的天然色素的投 入成本一直是该行业面临的最大的挑战。这个问题 促使人们寻找新颖且经济可行的解决方案来生产、 提取、纯化和稳定天然食品着色剂,并尝试在微生物 中表达植物色素的基因,直接获取色素代谢产物,或 开发含有更丰富色素的植物。
市场上绝大部分的天然色素的来源还是植物, 受时节及生长环境限制,而且从微生物中提取的方 式可以完全规避所提取的色素质量参差不齐的缺 点,未来天然色素生产新技术的探究可将微生物扩 大化培养。微生物扩大培养,还需要在生产过程中添 加营养物,更需要进一步调控反应时间,才能避免其 产生更多副产物,同时获取更多植物色素。关于所提 取的植物色素稳定性不高问题,目前传统的方式只 能通过改变加工方式,保留植物色素的活性,限制了 天然色素的使用范围;而利用包封的方式用可食用 材料包裹植物色素,可以在保留天然色素本身活性 的同时,增强其稳定性。需要注意的是,包封会提高 食物的生产成本,所以如何在微生物扩大化培养中 提升天然色素的产量并更低成本的增强色素的稳定 性,是我们未来在开展食用色素研究时需要重点解 决的问题。
参 考 文 献
[1] KOBYLEWSKI S, JACOBSON M F. Toxicology of food dyes [J]. International Journal of Occupational and Environmental Health, 2012, 18(3): 220-246.
[2] MATTES J A, GITTELMAN R. Effects of artificial food colorings in children with hyperactive symptoms. A critical review and results of a controlled study[J]. Archives of General Psychiatry, 1981, 38(6): 714-718.
[3] ROWE K S, ROWE K J. Synthetic food coloring and behavior: a dose response effect in a double-blind, placebo-controlled,repeated-measures study[J]. The Journal of Pediatrics, 1994, 125(5 Pt 1): 691-698.
[4] RAMOS-SOUZA C, BANDONI D H, BRAGOTTO A P A,et al. Risk assessment of azo dyes as food additives: Revision and discussion of data gaps toward their improvement[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(1): 380-407.
[5]冯涛,Brockington S.植物色素甜菜素的起源进化机制[C]//首届植物科学前沿学术大会摘要集(二).中国植物学会,2022.
[6]SIGURDSON G T,TANG P,GIUSTI M M.Natural Colorants:Food Colorants from Natural Sources[J].Annual Review of Food Science and Technology,2017,8(1):261-280.
[7]DIAS M G,BORGE G I A,KLJAK K,et al.European Database of Carotenoid Levels in Foods.Factors Affecting Carotenoid Content[J].Foods,2021,10(5):912.
[8]RODRIGUEZ-AMAYA D B.Changes in carotenoids during processing and storage of foods[J].Archivos Latinoamericanos De Nutricion,1999,49(3 Suppl 1):38S-47S.
[9]Anthocyanidins and anthocyanins:colored pigments as food,pharmaceutical ingredients,and the potential health benefits|Food&Nutrition Research[EB/OL].
[10]DI MEO F,SANCHO GARCIA J C,DANGLES O,et al.Highlights on Anthocyanin Pigmentation and Copigmentation:A Matter of Flavonoidπ-Stacking Complexation To Be Described by DFT-D[J].Journal of Chemical Theory and Computation,2012,8(6):2034-2043.
[11]吴春燕,蔡敏,翁艳英,等.响应面法优化黑米花青素的提取工艺及其稳定性研究[J].山西化工,2023,43(03):14-18.
[12]梅瀚,曹金凤,刘世巍,等.超声辅助提取葡萄籽中原花青素工艺及抗氧化活性研究[J].广东化工,2023,50(5):38-41.
[13]黄爱妮,马哲,李婷,等.火龙果皮中花青素的提取工艺研究[J].粮食与油脂,2022,35(12):119-122.
[14]卢梦婷,陶志杰,祁文慧,等.火龙果果皮花青素提取及其热稳定性研究[J].广州化工,2020,48(23):66-68,75.
[15]郑玉荣,陈龙,王晓,等.沙棘花青素提取物对双氧水诱导的H1299细胞损伤的保护作用及Nrf2/HO-1通路的影响[J].食品工业科技,2023,44(6):396-404.
[16]冯敏,幸宏伟,尤琳烽,等.洛神花花青素提取工艺及抗氧化活性研究[J].重庆工商大学学报(自然科学版),2023,40(6):1-7.
[17]夏川林,廖国钊,殷浩,等.桑葚花青素的提取与纯化研究进展[J].四川蚕业,2022,50(3):40-43.
[18]LIU X,MUT,SUN H,et al.Optimisation of aqueous two-phase extraction of anthocyanins from purple sweet potatoes by response surface methodology[J].Food Chemistry,2013,141(3):3034-3041.
[19]SILVA S,COSTA E M,CALHAU C,et al.Anthocyanin extraction from plant tissues:A review[J].Critical Reviews in Food Science and Nutrition,2017,57(14):3072-3083.
[20]全沁果,秦靖茹,张晴,等.青椒类胡萝卜素的提取及纯化[J].中国食品添加剂,2022,33(11):27-33.
[21]李灵,熊芸,张钰瑶,等.响应面法优化猕猴桃类胡萝卜素提取工艺[J].四川大学学报(自然科学版),2022,59(5):162-168.
[22]敖艳,全沁果,马良.玉米须类胡萝卜素的提取及其稳定性[J].核农学报,2017,31(10):1946-1954.
[23]李宪钞,谭姣,刘梦海,等.超声辅助提取玉米苞叶中类胡萝卜素及其稳定性研究[J].分子植物育种,2019,17(17):5783-5791.
[24]MI KUS N,IQBAL A,MARSZA?EK K,et al.Green Chemistry Extractions of Carotenoids from Daucus carota L.—Supercritical Carbon Dioxide and Enzyme-Assisted Methods[J].Molecules,2019,24(23):4339.
[25]李治城.黄甜菜中甜菜黄色素的稳定性及分离纯化技术研究[D].烟台:烟台大学,2021.
[26]吕思润.甜菜红素的提取纯化及其生物活性研究[D].哈尔滨:哈尔滨工业大学,2017.
[27]郑学立.苋菜甜菜红素合成的生理生化与分子生物学研究[D].福州:福建农林大学,2016.
[28]Maoka T.Carotenoids as natural functional pigments[J].Journal of Natural Medicines,2020,74(1):1-16.
[29]AMBATI R R,SIEW MOI P,RAVI S,et al.Astaxanthin:sources,extraction,stability,biological activities and its commercial applications—a review[J].Marine Drugs,2014,12(1):128-152.
[30]XU S,GAO S,AN Y.Research progress of engineering microbial cell factories for pigment production[J].Biote chnology Advances,2023,65:108150.
[31]SUNIL L,SHETTY N P.Biosynthesis and regulation of anthocyanin pathway genes[J].Applied Microbiology and Biotechnology,2022,106(5):1783-1798.
[32]崔易.胭脂虫天然红色素提取纯化工艺研究[D].西安:西北大学,2007.
[33]于萍.凤眼莲天然色素的提取、分离鉴定及应用[D].上海:东华大学,2014.
[34]ZOU H,MA Y,XU Z,et al.Isolation of strawberry anthocyanins using high-speed counter-current chromatography and the copigmentation with catechin or epicatechin by high pressure processing[J]. Food Chemistry, 2018, 247: 81-88.
[35] QIU F, LUO J, YAO S, et al. Preparative isolation and purification of anthocyanins from purple sweet potato by high-speed counter-current chromatography[J]. Journal of Separation Science, 2009, 32(12): 2146-2151.
[36] ZHAO Z, WU M, ZHAN Y, et al. Characterization and purification of anthocyanins from black peanut (Arachis hypogaea L.) skin by combined column chromatography [J]. Journal of Chromatography A, 2017, 1519: 74-82.
[37] ONGKOWIJOYO P, LUNA-VITAL D A, GONZALEZ DE MEJIA E. Extraction techniques and analysis of anthocyanins from food sources by mass spectrometry: An update[J]. Food Chemistry, 2018, 250: 113-126.
[38] NAGY V, AGÓCS A, TURCSI E, et al. Isolation and
purification of acid-labile carotenoid 5,6-epoxides on modified silica gels[J]. Phytochemical Analysis, 2009, 20 (2): 143-148.
[39] CHEN F, LI H B, WONG R N S, et al. Isolation and purification of the bioactive carotenoid zeaxanthin from the microalga Microcystis aeruginosa by high-speed counter- current chromatography[J]. Journal of Chromatography A, 2005, 1064(2): 183-186.
[40] SAINI R K, MOON S H, GANSUKH E, et al. An efficient one-step scheme for the purification of major xanthophyll carotenoids from lettuce, and assessment of their comparative anticancer potential[J]. Food Chemistry, 2018, 266: 56-65.
[41] WANG L, HU J, LV W, et al. Optimized extraction of astaxanthin from shrimp shells treated by biological enzyme and its separation andpurification using macroporous resin[J]. Food Chemistry, 2021, 363: 130369.
[42] DU X, DONG C, WANG K, et al. Separation and purification of astaxanthin from Phaffia rhodozyma by preparative high-speed counter-current chromatography [J]. Journal of Chromatography B, 2016, 1029-1030: 191-197.
[43] CHEN S, SU D X, GAO M X, et al. A facile macroporous resin-based method for separation of yellow and orange Monascus pigments[J]. Food Science and Biotechnology, 2021, 30(4): 545-553.
[44] SAINI P, KUMAR N, KUMAR S, et al. Bioactive compounds, nutritional benefits and food applications of colored wheat: acomprehensive review[J]. Critical Reviews in Food Science and Nutrition, 2021, 61 (19): 3197-3210.
[45] LIZASO M T, MONEO I, GARC?A B E, et al. Identification of allergens involved in occupational asthma due to carmine dye[J]. Annals of Allergy, Asthma & Immunology, 2000, 84(5): 549-552.
[46] WANG Y, YANG C, ZHANG J, et al. Influence of rose anthocyanin extracts on physicochemical properties and in vitro digestibility of whey protein isolate sol/gel: Based on different pHs and protein concentrations[J]. Food Chemistry, 2023, 405(Pt B): 134937.
[47] MATEUS N, DE FREITAS V. Anthocyanins as Food Colorants[M]//Winefield C, Davies K,Gould K.Anthocyanins: Biosynthesis, Functions, and Applications. New York, NY: Springer, 2009: 284-304.
[48] CLYDESDALE F M, MAIN J H, FRANCIS F J. Roselle (Hibiscus sabdariffa L.) Anthocyanins as Colorants for Beverages and Gelatin Desserts[J].Journal ofFoodProtection, 1979, 42(3): 204-207.
[49] B1KOWSKA-BARCZAK A. Acylated anthocyanins as stable, natural food colorants a review[J]. Polish Journal of Food and Nutrition Sciences, 2005, 14: 55.
[50] MARTfNEZ L, CILLA I, BELTRÁN J A, et al. Comparative effect of red yeast rice (Monascus purpureus), red beet root (Beta vulgaris) and betanin (E-162) on colour and consumer acceptability of fresh pork sausages packaged in a modified atmosphere[J]. Journal of the Science of Food and Agriculture, 2006, 86(4): 500-508.
[51] AMANY M, BASUNY A, ABDEL-RAHEAM H. Red and yellow monascus pigments as potential natural antioxidants in fatty foods[J]. Agricultural and Food Sciences, 2020: 444-449.
[52] HE J, JIA M, LI W, et al. Toward improvements for enhancement the productivity and color value of Monascus pigments: a critical review with recent updates [J]. Critical Reviews in Food Science and Nutrition, 2022, 62(26): 7139-7153.
[53] HE J, GIUSTI M M. Anthocyanins: natural colorants with health-promoting properties[J]. Annual Review of Food Science and Technology, 2010, 1: 163-187.
[54] Light and heat sensitivity of red cabbage extract in soft drink model systems - ScienceDirect[EB/OL].
[55] HERBACH K M, STINTZING F C, CARLE R. Betalain Stability and Degradation—Structural and Chromatic Aspects[J].Journal of Food Science, 2006, 71(4): R41-R50.
[56] ALI I, AL-DALALI S, HAO J, et al. The stabilization of Monascus pigment by formation of Monascus pigment-sodium caseinate complex[J]. Food Chemistry, 2022, 384: 132480.
[57] AKHAVAN MAHDAVI S, JAFARI S M, ASSADPOUR E, et al. Storage stability of encapsulated barberry ’s anthocyanin and its application in jelly formulation[J].Journal of Food Engineering, 2016, 181: 59-66.
[58] GHOSH S, SARKAR T, DAS A, et al. Micro and Nanoencapsulation of Natural Colors: a holistic view[J].Applied Biochemistry and Biotechnology, 2021, 193(11): 3787-3811.
[59] GAND魱A-HERRERO F, JIM魪NEZ-ATI魪NZAR M, CABANES J, et al. Stabilization of the bioactive pigment of opuntia fruits through maltodextrin encapsulation[J]. Journal of Agricultural and Food Chemistry, 2010, 58(19): 10646-10652.










